高一化学鲁科版必修2 第3章 重要的有机化合物乙酸课件 课件(共22张ppt)
文档属性
| 名称 | 高一化学鲁科版必修2 第3章 重要的有机化合物乙酸课件 课件(共22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-09 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第三章 第3节
第二课时 乙酸
走进美食世界
糖 醋 鱼
【活动】小组合作,利用课本信息搭建乙酸分子的球棍模型,并根据搭建的球棍模型写出乙酸的分子式,结构式,结构简式。(2min)
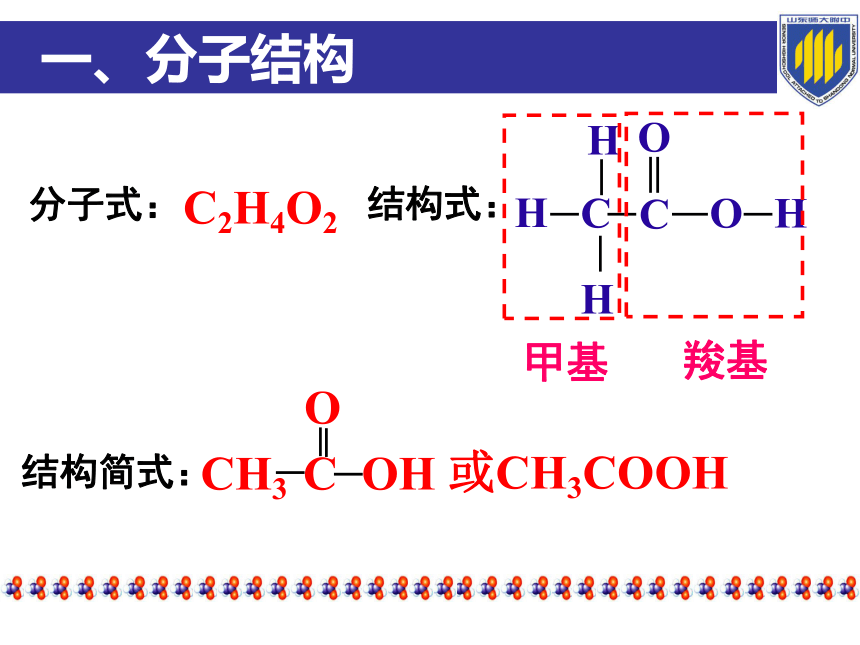
一、分子结构
结构简式:
分子式:
结构式:
C2H4O2
甲基
羧基
一、分子结构
1.颜色、气味、状态:
2.溶解性:
3.熔点:熔点16.6?C
无色有强烈刺激性气味的液体(易挥发)
易溶于水和乙醇。
二、性质 1.物理性质
【活动】 用“化学的眼光”观察你面前的乙酸,联系生活实际,你能知道乙酸的哪些物理性质?
当低于这个温度时,乙酸就凝结成像冰一样的晶体,因此无水乙酸又称为冰醋酸。
2、化学性质
【合作探究 】
设计实验证明乙酸具有酸性(小组合作讨论实验方案)
(可供选择的试剂:乙酸溶液、紫色石蕊溶液、镁条、
氢氧化钠和酚酞溶液、碳酸钠溶液、CuO粉末)
紫色石蕊溶液 取1-2ml乙酸溶液于试管中,
向试管中滴加几滴紫色石蕊溶液,
观察实验现象
碳酸钠溶液 取1-2ml乙酸溶液于试管中,
向试管中滴加碳酸钠溶液,
观察实验现象
溶液变红 乙酸有酸性
有气泡产生 乙酸有酸性
注意:
1. 少取,节约药品。
2.规范操作,胶头滴管应竖直悬空。
3.取用完药品,滴管放回原试剂瓶, 避免污染试剂。
4.及时记录实验现象。
【思考】乙酸的酸性与碳酸相比,谁强,为什么?
选择药品 实验方案 实验现象 实验结论
【迁移 应用】
根据乙酸的化学性质,写出用食醋除水垢的反应原理。
(1)乙酸的酸性
2CH3COOH + CaCO3=(CH3COO)2Ca+H2O+CO2↑
2CH3COOH + Mg(OH)2 =(CH3COO)2Mg+2H2O
水垢的主要成分为
Mg(OH)2和CaCO3
【总 结】
1.乙酸在溶于水时能够电离出CH3COO-和H+ ,
是一种常见的有机酸,它能使指示剂变色,能与活泼金属,碱,碱性氧化物及盐等物质反应,具有酸的通性。
2.乙酸的酸性比碳酸强。酸性 CH3COOH>H2CO3
*
(1)乙酸的酸性
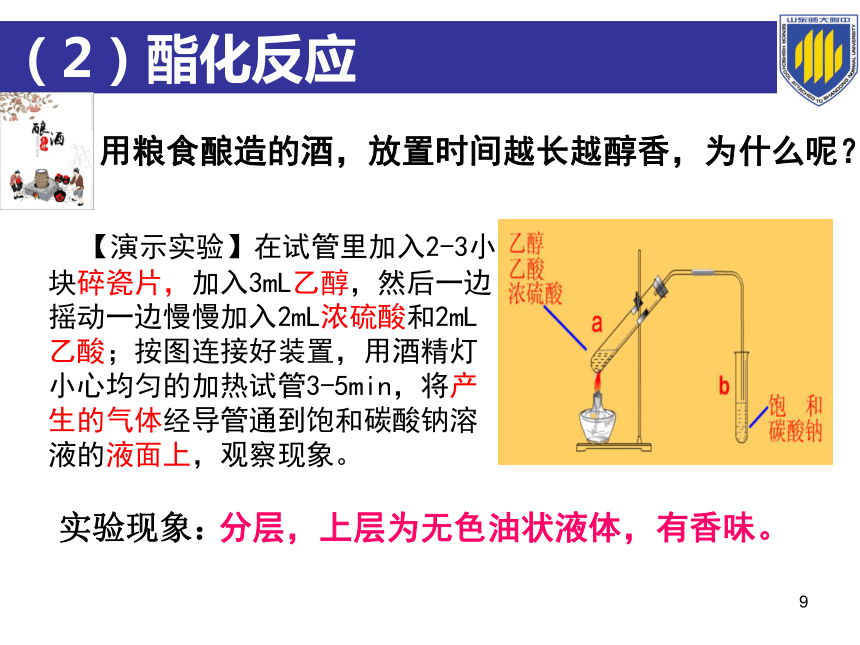
【演示实验】在试管里加入2-3小块碎瓷片,加入3mL乙醇,然后一边摇动一边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯小心均匀的加热试管3-5min,将产生的气体经导管通到饱和碳酸钠溶液的液面上,观察现象。
*
(2)酯化反应
用粮食酿造的酒,放置时间越长越醇香,为什么呢?
实验现象:
分层,上层为无色油状液体,有香味。
(2)酯化反应
乙酸乙酯
反应方程式:
像乙酸和乙醇这样生成酯和水的反应称之为酯化反应。
(2)酯化反应
【合作探究】 酯化反应的反应机理
观察该化学方程式,思考:
(1)如何断键生成水
(2)如何确定哪种方式是正确的。
(提示:可用同位素示踪法,用180标记氧原子)
乙酸乙酯
反应方程式:
探究酯化反应可能的脱水方式
【得出结论】 酯化反应机理
酸脱羟基,醇脱羟基上的氢原子形成水分子。
(2)酯化反应
【猜想与假设】
【验证】同位素示踪法
方式1:
方式2:
(2)酯化反应
用粮食酿造的酒,放置时间越长越醇香,为什么呢?
(2)酯化反应
不仅是酿酒,酿醋也与酯化反应有关,我国是世界上谷物酿醋最早的国家,在传统的酿醋工艺中,通过蒸、酵、沥、陈4步,在此过程中,乙酸能和乙醇缓慢的反应生成乙酸乙酯,就可以得到香醋。
(2)酯化反应
【迁移应用】
假设某有机物也含有官能团羧基,通过刚才的学习,你能预测它的化学性质吗?
三、乙酸的用途
阅读资料,分析醋可以去除腥味的原因。
糖醋鱼,鱼要吃醋;
除水垢,水垢要吃醋;
降血压降血脂、减肥美容,人也要吃醋。
*
三、乙酸的用途
醋是日常生活中饮食烹调的常用调味品,从医学保健角度来看,食醋还是保持身体健康的灵丹妙药。在工业上醋酸更是一种重要的有机化工原料,用于生产纤维、香料、染料、医药以及农药等。
课堂小结
课堂练习
1.下列关于乙酸物理性质和分子结构的叙述中不正确的是( )
A.醋酸是一种具有强烈刺激性气味的液体
B.乙酸和乙醇可以互溶故不能用分液法分离
C.乙酸分子是由一个乙基和一个羧基构成
D.乙酸分子中虽然有四个氢原子,但乙酸是一元酸
C
2.丙烯酸(CH2=CH—COOH)的性质可能有 ① 加成反应 ② 取代反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应( )
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
D
课堂练习
3.在酯化反应的实验中制得的乙酸乙酯中混有少量的 CH3COOH,应选用下列哪种试剂洗涤除去( )
A.乙醇
B.饱和Na2CO3溶液
C.水
D.NaOH溶液
B
课堂练习
4.图为实验室制乙酸乙酯的装置
1)反应的化学方程式 :
2)浓H2SO4的作用: 。
3)装置中通蒸气的导管要在饱和Na2CO3溶液的液面以上,
不能插在溶液中,目的是 。
4)饱和Na2CO3的作用 。
催化剂、吸水剂
防止倒吸
溶解乙醇、反应乙酸,降低乙酸乙酯的溶解度
课后作业:
完成学案上对应的练习。
第三章 第3节
第二课时 乙酸
走进美食世界
糖 醋 鱼
【活动】小组合作,利用课本信息搭建乙酸分子的球棍模型,并根据搭建的球棍模型写出乙酸的分子式,结构式,结构简式。(2min)
一、分子结构
结构简式:
分子式:
结构式:
C2H4O2
甲基
羧基
一、分子结构
1.颜色、气味、状态:
2.溶解性:
3.熔点:熔点16.6?C
无色有强烈刺激性气味的液体(易挥发)
易溶于水和乙醇。
二、性质 1.物理性质
【活动】 用“化学的眼光”观察你面前的乙酸,联系生活实际,你能知道乙酸的哪些物理性质?
当低于这个温度时,乙酸就凝结成像冰一样的晶体,因此无水乙酸又称为冰醋酸。
2、化学性质
【合作探究 】
设计实验证明乙酸具有酸性(小组合作讨论实验方案)
(可供选择的试剂:乙酸溶液、紫色石蕊溶液、镁条、
氢氧化钠和酚酞溶液、碳酸钠溶液、CuO粉末)
紫色石蕊溶液 取1-2ml乙酸溶液于试管中,
向试管中滴加几滴紫色石蕊溶液,
观察实验现象
碳酸钠溶液 取1-2ml乙酸溶液于试管中,
向试管中滴加碳酸钠溶液,
观察实验现象
溶液变红 乙酸有酸性
有气泡产生 乙酸有酸性
注意:
1. 少取,节约药品。
2.规范操作,胶头滴管应竖直悬空。
3.取用完药品,滴管放回原试剂瓶, 避免污染试剂。
4.及时记录实验现象。
【思考】乙酸的酸性与碳酸相比,谁强,为什么?
选择药品 实验方案 实验现象 实验结论
【迁移 应用】
根据乙酸的化学性质,写出用食醋除水垢的反应原理。
(1)乙酸的酸性
2CH3COOH + CaCO3=(CH3COO)2Ca+H2O+CO2↑
2CH3COOH + Mg(OH)2 =(CH3COO)2Mg+2H2O
水垢的主要成分为
Mg(OH)2和CaCO3
【总 结】
1.乙酸在溶于水时能够电离出CH3COO-和H+ ,
是一种常见的有机酸,它能使指示剂变色,能与活泼金属,碱,碱性氧化物及盐等物质反应,具有酸的通性。
2.乙酸的酸性比碳酸强。酸性 CH3COOH>H2CO3
*
(1)乙酸的酸性
【演示实验】在试管里加入2-3小块碎瓷片,加入3mL乙醇,然后一边摇动一边慢慢加入2mL浓硫酸和2mL乙酸;按图连接好装置,用酒精灯小心均匀的加热试管3-5min,将产生的气体经导管通到饱和碳酸钠溶液的液面上,观察现象。
*
(2)酯化反应
用粮食酿造的酒,放置时间越长越醇香,为什么呢?
实验现象:
分层,上层为无色油状液体,有香味。
(2)酯化反应
乙酸乙酯
反应方程式:
像乙酸和乙醇这样生成酯和水的反应称之为酯化反应。
(2)酯化反应
【合作探究】 酯化反应的反应机理
观察该化学方程式,思考:
(1)如何断键生成水
(2)如何确定哪种方式是正确的。
(提示:可用同位素示踪法,用180标记氧原子)
乙酸乙酯
反应方程式:
探究酯化反应可能的脱水方式
【得出结论】 酯化反应机理
酸脱羟基,醇脱羟基上的氢原子形成水分子。
(2)酯化反应
【猜想与假设】
【验证】同位素示踪法
方式1:
方式2:
(2)酯化反应
用粮食酿造的酒,放置时间越长越醇香,为什么呢?
(2)酯化反应
不仅是酿酒,酿醋也与酯化反应有关,我国是世界上谷物酿醋最早的国家,在传统的酿醋工艺中,通过蒸、酵、沥、陈4步,在此过程中,乙酸能和乙醇缓慢的反应生成乙酸乙酯,就可以得到香醋。
(2)酯化反应
【迁移应用】
假设某有机物也含有官能团羧基,通过刚才的学习,你能预测它的化学性质吗?
三、乙酸的用途
阅读资料,分析醋可以去除腥味的原因。
糖醋鱼,鱼要吃醋;
除水垢,水垢要吃醋;
降血压降血脂、减肥美容,人也要吃醋。
*
三、乙酸的用途
醋是日常生活中饮食烹调的常用调味品,从医学保健角度来看,食醋还是保持身体健康的灵丹妙药。在工业上醋酸更是一种重要的有机化工原料,用于生产纤维、香料、染料、医药以及农药等。
课堂小结
课堂练习
1.下列关于乙酸物理性质和分子结构的叙述中不正确的是( )
A.醋酸是一种具有强烈刺激性气味的液体
B.乙酸和乙醇可以互溶故不能用分液法分离
C.乙酸分子是由一个乙基和一个羧基构成
D.乙酸分子中虽然有四个氢原子,但乙酸是一元酸
C
2.丙烯酸(CH2=CH—COOH)的性质可能有 ① 加成反应 ② 取代反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应( )
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
D
课堂练习
3.在酯化反应的实验中制得的乙酸乙酯中混有少量的 CH3COOH,应选用下列哪种试剂洗涤除去( )
A.乙醇
B.饱和Na2CO3溶液
C.水
D.NaOH溶液
B
课堂练习
4.图为实验室制乙酸乙酯的装置
1)反应的化学方程式 :
2)浓H2SO4的作用: 。
3)装置中通蒸气的导管要在饱和Na2CO3溶液的液面以上,
不能插在溶液中,目的是 。
4)饱和Na2CO3的作用 。
催化剂、吸水剂
防止倒吸
溶解乙醇、反应乙酸,降低乙酸乙酯的溶解度
课后作业:
完成学案上对应的练习。
