浙科版高中生物选修1第4部分试验11植物的组织培养(共25张PPT)
文档属性
| 名称 | 浙科版高中生物选修1第4部分试验11植物的组织培养(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 852.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙科版 | ||
| 科目 | 生物学 | ||
| 更新时间 | 2020-03-16 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
第四部分 浅尝现代生物技术
实验目的
1、进行菊花的组织培养
2、尝试植物激素的应用
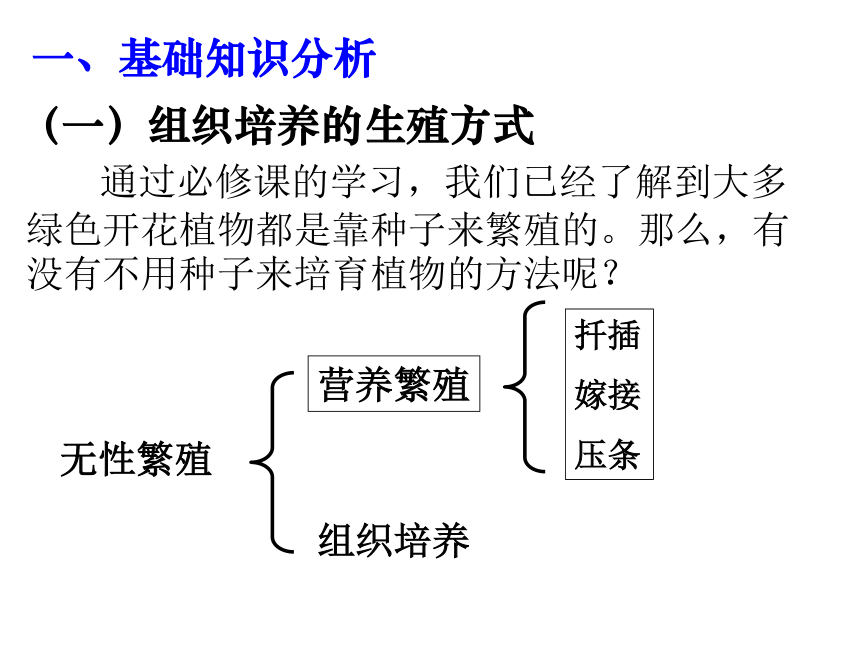
通过必修课的学习,我们已经了解到大多绿色开花植物都是靠种子来繁殖的。那么,有没有不用种子来培育植物的方法呢?
组织培养
无性繁殖
一、基础知识分析
(一)组织培养的生殖方式
(二)植物组织培养的基本过程
知识要点:
1.细胞分化的概念;
2.离体植物细胞的脱分化和再分化。
(三)影响植物组织培养的因素
影响植物组织培养的因素有培养基配制、外植体的选取、消毒、接种、培养、移栽和栽培等。
(1)外植体选取:不同的植物组织
同一植物的不同材料
(2)营养
(3)环境条件(pH、温度、光照)
(4)植物激素
(5)消毒
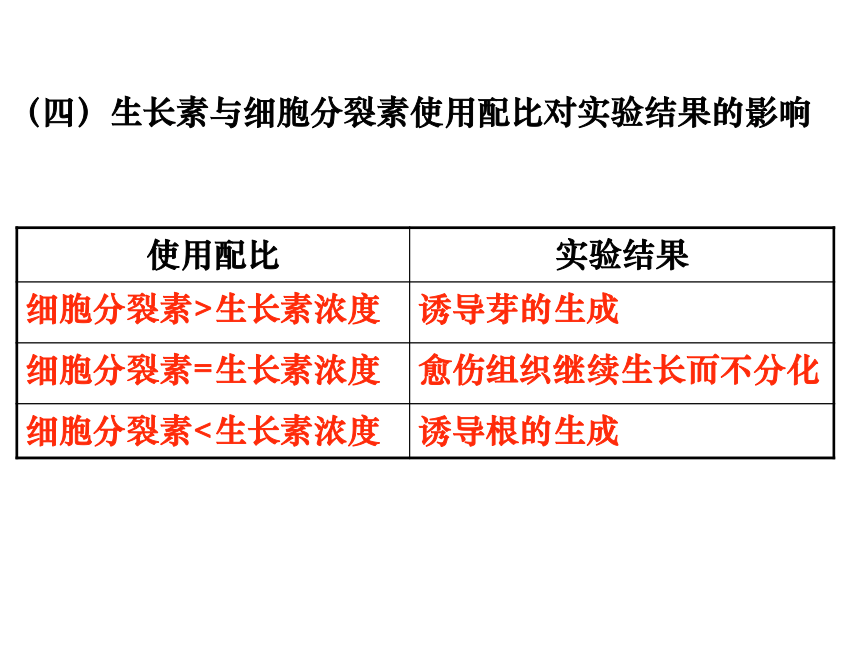
(四)生长素与细胞分裂素使用配比对实验结果的影响
使用配比 实验结果
细胞分裂素>生长素浓度 诱导芽的生成
细胞分裂素=生长素浓度 愈伤组织继续生长而不分化
细胞分裂素<生长素浓度 诱导根的生成
制备MS固体培养基
外植体消毒
接种
培 养
栽培
移 栽
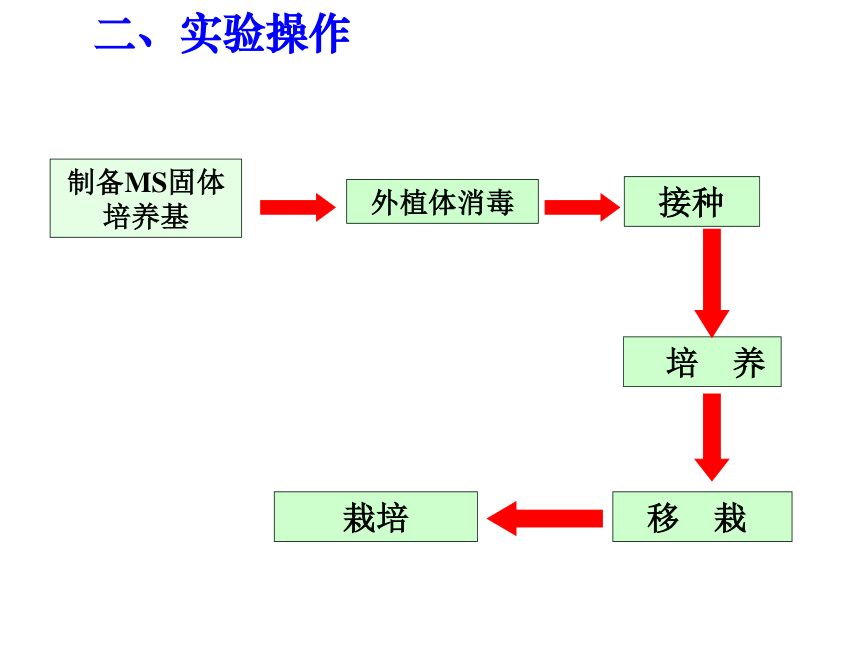
二、实验操作
(一)制备MS固体培养基
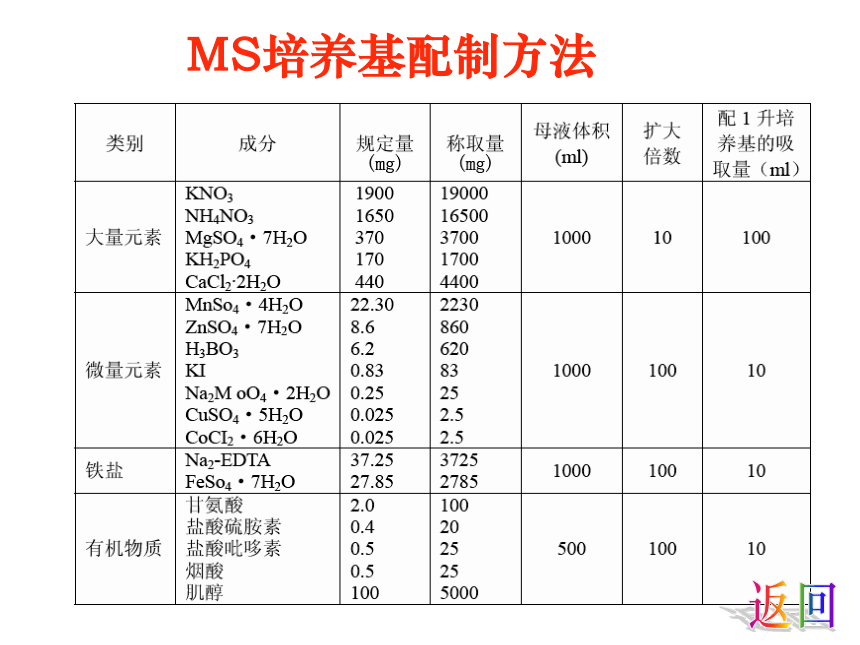
1、配制母液
按照MS培养基成分表, 分别配制培养基的母液。
(1)大量元素母液(10倍液)
分别称取10倍用量的各种大量无机盐,依次溶解于大约800ml热的(60-80℃)蒸馏水中。(一种成分完全溶解后再加入下一种,最后加水,定容至1000ml后装入试剂瓶中,冰箱内贮存备用)。
(2)微量元素母液(100倍液)
(3)铁盐母液(100倍液)
(4)有机物质母液(100倍数)
(5)生长素母液
(6)细胞分裂素母液
注意:配制培养基时,一定要注意调节pH。
MS培养基配制方法
你能说出各种营养物质的作用吗?同微生物培养基的配方相比,MS培养基的配方有哪些明显的不同?
微量元素和大量元素提供植物细胞生活所必需的无机盐;蔗糖提供碳源,同时能够维持细胞的渗透压;甘氨酸、维生素等物质主要是为了满足离体植物细胞在正常代谢途径受到一定影响后所产生的特殊营养需求。
微生物培养基以有机营养为主。与微生物的培养不同,MS培养基则需提供大量无机营养,无机盐混合物包括植物生长必须的大量元素和微量元素两大类。
(1) 取1000ml烧杯一只,加大量元素10倍母液100ml,微量元素100倍母液10ml,铁盐100倍母液10ml,有机物质100倍母液10ml。此外,根据培养材料和实验目的还要附加一定量的生长素,细胞分裂素及蔗糖等,然后加水至1000ml,待蔗糖充分溶解后用1mol/L 的NaOH或HCl调酸碱度为pH5.8,最后加入琼脂粉6.5g,如用琼脂条,则要加8g。
2.培养基配制与分装:
(2)将盛有培养基的烧杯在电磁炉上,煮至琼脂完全融化,补加蒸馏水至1000ml。
将配制好的培养基分装到培养用三角瓶中,每只100ml三角瓶约装40ml培养基。
分装时要避免把培养基倒在瓶口上,否则培养时容易引起杂菌污染。
(1)把装好的培养基的三角瓶放入高压灭菌锅中,盖好锅盖。
(2)设置灭菌温度参数为121℃,20min,开始灭菌。
3、灭菌
无菌技术是植物组织培养能否获得成功的关键.
(二)外植体(离体组织)消毒
注意:对培养材料进行表面灭菌时,一方面要考虑药剂的消毒效果;另一方面还要考虑植物材料的耐受能力。不同药剂、不同植物材料,甚至不同器官要区别对待。
1、70﹪酒精中浸泡10min,无菌水冲洗
2、5%次氯酸钠溶液中浸泡,无菌水冲洗
3、用另一5%次氯酸钠溶液浸泡5min,无菌水冲洗
4、超净台中用无菌水多次冲洗
(三)切段后接种
1、先用肥皂洗手,穿上工作服,戴上口罩和工作帽。
2、放入培养瓶和灭菌后的接种用具(镊子、解剖刀、接种针),把镊子、解剖刀、接种针插入内盛70%酒精的广口瓶中。
3、在酒精灯火焰旁,打开三角瓶,把花茎用无菌解剖刀切成几段,每段至少有一张叶片
4、切段插入培养基,诱导愈伤组织,盖上封口膜。
5、愈伤组织插入生芽培养基,盖上封口膜。
6、用记号笔在瓶壁上写明培养材料、培养基代号、 接种日期。
注意事项
全部接种操作都是在无菌条件下进行的,所以要特别认真仔细,以防杂菌污染。
(四)培养
接种后的锥形瓶最好放在无菌箱中培养。培养期间应定期消毒,温度控制在18~25℃,并且每日照光14.5小时 。观察记录生长情况,并照相存档。
2-3周后将生长健壮的丛状苗在无菌条件下一个个转入生根培养基中,在上述条件下继续培养
(五)移栽
(六)栽培
生根后,将苗移至消毒的草炭土或蛭石中,用玻璃罩或塑料布保持80%以上湿度,2-3天后打开玻璃罩低湿度锻炼
转移至土中培养(定植)
三、结果分析与评价
(一)对接种操作中污染情况的分析
接种3~4 d后,在接种操作中被杂菌污染的培养物会表现出被污染的现象。请学生适时统计污染率,分析接种操作是否符合无菌要求。
(二)是否完成了对植物组织的脱分化和再分化
观察实验结果,看看是否培养出了愈伤组织,记录多长时间长出愈伤组织。统计更换培养基后愈伤组织进一步分化成根和芽的比例和时间。
(三)是否进行了统计、对照与记录
做好统计和对照,填好结果记录表,培养严谨的科学态度。从实验的第一步开始就要求做好实验记录,实验小组配制不同培养基,如诱导愈伤或直接分化丛芽的培养基,然后做不同配方的比较。
(四)生根苗的移栽是否合格
生根苗移栽技术的关键是既要充分清洗根系表面的培养基,又不能伤及根系。一般使用无土栽培的办法。培养基质要提前消毒,可以向培养基质喷洒质量分数为5%的高锰酸钾,并用塑料薄膜覆盖12 h。掀开塑料薄膜后24 h才能移栽。新移栽的组培苗要在温室过渡几天,等壮苗后再定植大田或进行盆栽。学生可以在课后统计自己移栽的成活率,看看移栽是否合格。
四、本课题知识小结
五、练习
植物组织培养所利用的植物材料体积小、抗性差,对培养条件的要求较高。用于植物组织培养的培养基同样适合于某些微生物的生长,如一些细菌、真菌等的生长。而培养物一旦受到微生物的污染,就会导致实验前功尽弃,因此要进行严格的无菌操作。
外植体的生理状态是成功进行组织培养的重要条件之一。生长旺盛的嫩枝生理状况好,容易诱导脱分化和再分化。
1.在植物组织培养过程中,为什么要进行一系列的消毒,灭菌,并且要求无菌操作?
2.在选取菊花茎段的时候,为什么要选取生长旺盛的嫩枝?
3、不同植物、不同组织的生根和生芽是否都可以使用与本实验相同的生长素和细胞分裂素浓度
4、本实验用人工合成的激素,而不用植物中存在的天然激素,为什么?
5、如果在自然界取植物样本进行组织培养,你认为应采取什么措施保证样本不被污染?
任何植物物种或品种都不可贸然使用与本实验相同的生长素和细胞分裂素浓度,必须要套索使用如何合成激素和何种激素浓度才可以。学习者可以参考已有文献上成熟的经验,也可以自己探索
植物中存在的天然激素有相应的使之分解的酶,这样,天然激素在植物体内作用和存在的时间就较短,而人工合成的激素在植物中没有相应使之分解的酶,所以作用和存在时间长,作用效果也更明显。
(1)操作环境洁净(2)植物样本洁净(3)操作过程无菌
因为污染物的来源是操作过程中和植物本身带来的,主要是微生物的污染,要采用各种措施防止微生物污染,具体做法和操作在微生物培养实验中已经介绍。除认真消毒除菌外,操作敏捷迅速,也可以降低污染率
6.右图为植物体细胞杂交过程示意图。据图回答: (1)步骤①是 ,最常用的方法是 。 (2)步骤③一般常用的化学试剂是 ,目的是 。
(3)在利用杂种细胞培育成为杂种植株的过程中,运用的技术手段是 ,其中步骤④相当于
,步骤⑤相当于 。 (4)植物体细胞杂交的目的是获得新的杂种植株。使 能够在新的植物体上有所表现,其根本原因是 。
去掉细胞壁,分离原生质体
酶解法
聚乙二醇(PEG)
诱导植物原生质体融合
植物组织培养
脱分化
再分化
远缘杂交亲本的遗传特征
杂种植株获得双亲的遗传物质
(5)若远源杂交亲本A和B都是二倍体,则杂种植株为 倍体。 (6)从理论上讲,杂种植株的育性 。若运用传统有性杂交方法能否实现? 。
并说明现由 。 因此,这项研究对于培养作物新品种方面的重大意义在于 。
(7)利用植物体细胞杂交的方法培育作物新品种过程中,遗传物质的传递是否遵循孟德尔的遗传规律?为什么? 。
四
可育
不能
因为不同种生物之间存在生殖隔离
克服远缘杂交不亲和的障碍,大大
扩展了可用于杂交的亲本组合范围
不遵循。因为在生物进行有性生殖的过程中,才遵循
孟德尔的遗传规律,而植物体细胞杂交育种的过程不属于有性生殖
第四部分 浅尝现代生物技术
实验目的
1、进行菊花的组织培养
2、尝试植物激素的应用
通过必修课的学习,我们已经了解到大多绿色开花植物都是靠种子来繁殖的。那么,有没有不用种子来培育植物的方法呢?
组织培养
无性繁殖
一、基础知识分析
(一)组织培养的生殖方式
(二)植物组织培养的基本过程
知识要点:
1.细胞分化的概念;
2.离体植物细胞的脱分化和再分化。
(三)影响植物组织培养的因素
影响植物组织培养的因素有培养基配制、外植体的选取、消毒、接种、培养、移栽和栽培等。
(1)外植体选取:不同的植物组织
同一植物的不同材料
(2)营养
(3)环境条件(pH、温度、光照)
(4)植物激素
(5)消毒
(四)生长素与细胞分裂素使用配比对实验结果的影响
使用配比 实验结果
细胞分裂素>生长素浓度 诱导芽的生成
细胞分裂素=生长素浓度 愈伤组织继续生长而不分化
细胞分裂素<生长素浓度 诱导根的生成
制备MS固体培养基
外植体消毒
接种
培 养
栽培
移 栽
二、实验操作
(一)制备MS固体培养基
1、配制母液
按照MS培养基成分表, 分别配制培养基的母液。
(1)大量元素母液(10倍液)
分别称取10倍用量的各种大量无机盐,依次溶解于大约800ml热的(60-80℃)蒸馏水中。(一种成分完全溶解后再加入下一种,最后加水,定容至1000ml后装入试剂瓶中,冰箱内贮存备用)。
(2)微量元素母液(100倍液)
(3)铁盐母液(100倍液)
(4)有机物质母液(100倍数)
(5)生长素母液
(6)细胞分裂素母液
注意:配制培养基时,一定要注意调节pH。
MS培养基配制方法
你能说出各种营养物质的作用吗?同微生物培养基的配方相比,MS培养基的配方有哪些明显的不同?
微量元素和大量元素提供植物细胞生活所必需的无机盐;蔗糖提供碳源,同时能够维持细胞的渗透压;甘氨酸、维生素等物质主要是为了满足离体植物细胞在正常代谢途径受到一定影响后所产生的特殊营养需求。
微生物培养基以有机营养为主。与微生物的培养不同,MS培养基则需提供大量无机营养,无机盐混合物包括植物生长必须的大量元素和微量元素两大类。
(1) 取1000ml烧杯一只,加大量元素10倍母液100ml,微量元素100倍母液10ml,铁盐100倍母液10ml,有机物质100倍母液10ml。此外,根据培养材料和实验目的还要附加一定量的生长素,细胞分裂素及蔗糖等,然后加水至1000ml,待蔗糖充分溶解后用1mol/L 的NaOH或HCl调酸碱度为pH5.8,最后加入琼脂粉6.5g,如用琼脂条,则要加8g。
2.培养基配制与分装:
(2)将盛有培养基的烧杯在电磁炉上,煮至琼脂完全融化,补加蒸馏水至1000ml。
将配制好的培养基分装到培养用三角瓶中,每只100ml三角瓶约装40ml培养基。
分装时要避免把培养基倒在瓶口上,否则培养时容易引起杂菌污染。
(1)把装好的培养基的三角瓶放入高压灭菌锅中,盖好锅盖。
(2)设置灭菌温度参数为121℃,20min,开始灭菌。
3、灭菌
无菌技术是植物组织培养能否获得成功的关键.
(二)外植体(离体组织)消毒
注意:对培养材料进行表面灭菌时,一方面要考虑药剂的消毒效果;另一方面还要考虑植物材料的耐受能力。不同药剂、不同植物材料,甚至不同器官要区别对待。
1、70﹪酒精中浸泡10min,无菌水冲洗
2、5%次氯酸钠溶液中浸泡,无菌水冲洗
3、用另一5%次氯酸钠溶液浸泡5min,无菌水冲洗
4、超净台中用无菌水多次冲洗
(三)切段后接种
1、先用肥皂洗手,穿上工作服,戴上口罩和工作帽。
2、放入培养瓶和灭菌后的接种用具(镊子、解剖刀、接种针),把镊子、解剖刀、接种针插入内盛70%酒精的广口瓶中。
3、在酒精灯火焰旁,打开三角瓶,把花茎用无菌解剖刀切成几段,每段至少有一张叶片
4、切段插入培养基,诱导愈伤组织,盖上封口膜。
5、愈伤组织插入生芽培养基,盖上封口膜。
6、用记号笔在瓶壁上写明培养材料、培养基代号、 接种日期。
注意事项
全部接种操作都是在无菌条件下进行的,所以要特别认真仔细,以防杂菌污染。
(四)培养
接种后的锥形瓶最好放在无菌箱中培养。培养期间应定期消毒,温度控制在18~25℃,并且每日照光14.5小时 。观察记录生长情况,并照相存档。
2-3周后将生长健壮的丛状苗在无菌条件下一个个转入生根培养基中,在上述条件下继续培养
(五)移栽
(六)栽培
生根后,将苗移至消毒的草炭土或蛭石中,用玻璃罩或塑料布保持80%以上湿度,2-3天后打开玻璃罩低湿度锻炼
转移至土中培养(定植)
三、结果分析与评价
(一)对接种操作中污染情况的分析
接种3~4 d后,在接种操作中被杂菌污染的培养物会表现出被污染的现象。请学生适时统计污染率,分析接种操作是否符合无菌要求。
(二)是否完成了对植物组织的脱分化和再分化
观察实验结果,看看是否培养出了愈伤组织,记录多长时间长出愈伤组织。统计更换培养基后愈伤组织进一步分化成根和芽的比例和时间。
(三)是否进行了统计、对照与记录
做好统计和对照,填好结果记录表,培养严谨的科学态度。从实验的第一步开始就要求做好实验记录,实验小组配制不同培养基,如诱导愈伤或直接分化丛芽的培养基,然后做不同配方的比较。
(四)生根苗的移栽是否合格
生根苗移栽技术的关键是既要充分清洗根系表面的培养基,又不能伤及根系。一般使用无土栽培的办法。培养基质要提前消毒,可以向培养基质喷洒质量分数为5%的高锰酸钾,并用塑料薄膜覆盖12 h。掀开塑料薄膜后24 h才能移栽。新移栽的组培苗要在温室过渡几天,等壮苗后再定植大田或进行盆栽。学生可以在课后统计自己移栽的成活率,看看移栽是否合格。
四、本课题知识小结
五、练习
植物组织培养所利用的植物材料体积小、抗性差,对培养条件的要求较高。用于植物组织培养的培养基同样适合于某些微生物的生长,如一些细菌、真菌等的生长。而培养物一旦受到微生物的污染,就会导致实验前功尽弃,因此要进行严格的无菌操作。
外植体的生理状态是成功进行组织培养的重要条件之一。生长旺盛的嫩枝生理状况好,容易诱导脱分化和再分化。
1.在植物组织培养过程中,为什么要进行一系列的消毒,灭菌,并且要求无菌操作?
2.在选取菊花茎段的时候,为什么要选取生长旺盛的嫩枝?
3、不同植物、不同组织的生根和生芽是否都可以使用与本实验相同的生长素和细胞分裂素浓度
4、本实验用人工合成的激素,而不用植物中存在的天然激素,为什么?
5、如果在自然界取植物样本进行组织培养,你认为应采取什么措施保证样本不被污染?
任何植物物种或品种都不可贸然使用与本实验相同的生长素和细胞分裂素浓度,必须要套索使用如何合成激素和何种激素浓度才可以。学习者可以参考已有文献上成熟的经验,也可以自己探索
植物中存在的天然激素有相应的使之分解的酶,这样,天然激素在植物体内作用和存在的时间就较短,而人工合成的激素在植物中没有相应使之分解的酶,所以作用和存在时间长,作用效果也更明显。
(1)操作环境洁净(2)植物样本洁净(3)操作过程无菌
因为污染物的来源是操作过程中和植物本身带来的,主要是微生物的污染,要采用各种措施防止微生物污染,具体做法和操作在微生物培养实验中已经介绍。除认真消毒除菌外,操作敏捷迅速,也可以降低污染率
6.右图为植物体细胞杂交过程示意图。据图回答: (1)步骤①是 ,最常用的方法是 。 (2)步骤③一般常用的化学试剂是 ,目的是 。
(3)在利用杂种细胞培育成为杂种植株的过程中,运用的技术手段是 ,其中步骤④相当于
,步骤⑤相当于 。 (4)植物体细胞杂交的目的是获得新的杂种植株。使 能够在新的植物体上有所表现,其根本原因是 。
去掉细胞壁,分离原生质体
酶解法
聚乙二醇(PEG)
诱导植物原生质体融合
植物组织培养
脱分化
再分化
远缘杂交亲本的遗传特征
杂种植株获得双亲的遗传物质
(5)若远源杂交亲本A和B都是二倍体,则杂种植株为 倍体。 (6)从理论上讲,杂种植株的育性 。若运用传统有性杂交方法能否实现? 。
并说明现由 。 因此,这项研究对于培养作物新品种方面的重大意义在于 。
(7)利用植物体细胞杂交的方法培育作物新品种过程中,遗传物质的传递是否遵循孟德尔的遗传规律?为什么? 。
四
可育
不能
因为不同种生物之间存在生殖隔离
克服远缘杂交不亲和的障碍,大大
扩展了可用于杂交的亲本组合范围
不遵循。因为在生物进行有性生殖的过程中,才遵循
孟德尔的遗传规律,而植物体细胞杂交育种的过程不属于有性生殖
