第3节 原子结构的模型 同步练习(第2课时)
文档属性
| 名称 | 第3节 原子结构的模型 同步练习(第2课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 284.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-03-18 00:00:00 | ||
图片预览

文档简介
第 3 节原子结构的模型第2课时
知识点回顾
1.离子是带电的原子或原子团。原子得到电子形成带负电荷的离子称为________,原子失去电子形成带正电荷的离子称为________。离子所带的电荷数取决于它______________的数目。
2.离子与分子、原子一样也是____________的一种微粒。
3.钠在氯气中燃烧的现象:剧烈燃烧、发出________火焰,生成________固体。
4.原子与离子的区别和联系
5.元素:具有相同____________(即质子数)的一类原子的总称。如碳元素就是所有核电荷数为6的原子的总称。
6.原子中原子核内______________、中子数________的同类原子统称为同位素原子。如氢有氕、氘、氚三种同位素原子。因此,原子中质子数________等于中子数。大多数元素都有同位素原子。
7.同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。
知识点练习
1.一个氢原子由一个质子和一个电子构成,不含中子。当1个氢原子失去1个电子后,它不会变成( )
A.质子 B.原子核
C.阳离子 D.带负电荷的离子
2.下列有关钠原子和钠离子的说法中正确的是( )
A.钠离子比钠原子多一个质子
B.钠离子比钠原子多一个电子
C.钠离子与钠原子化学性质相同
D.钠离子与钠原子核内质子数相同
3.下列对分子、原子、离子的认识,正确的是( )
A.原子是一切变化中最小粒子,不可再分
B.元素间最本质的区别是电子数不同
C.分子、原子、离子都可以直接构成物质
D.铁原子和铁离子的化学性质相同
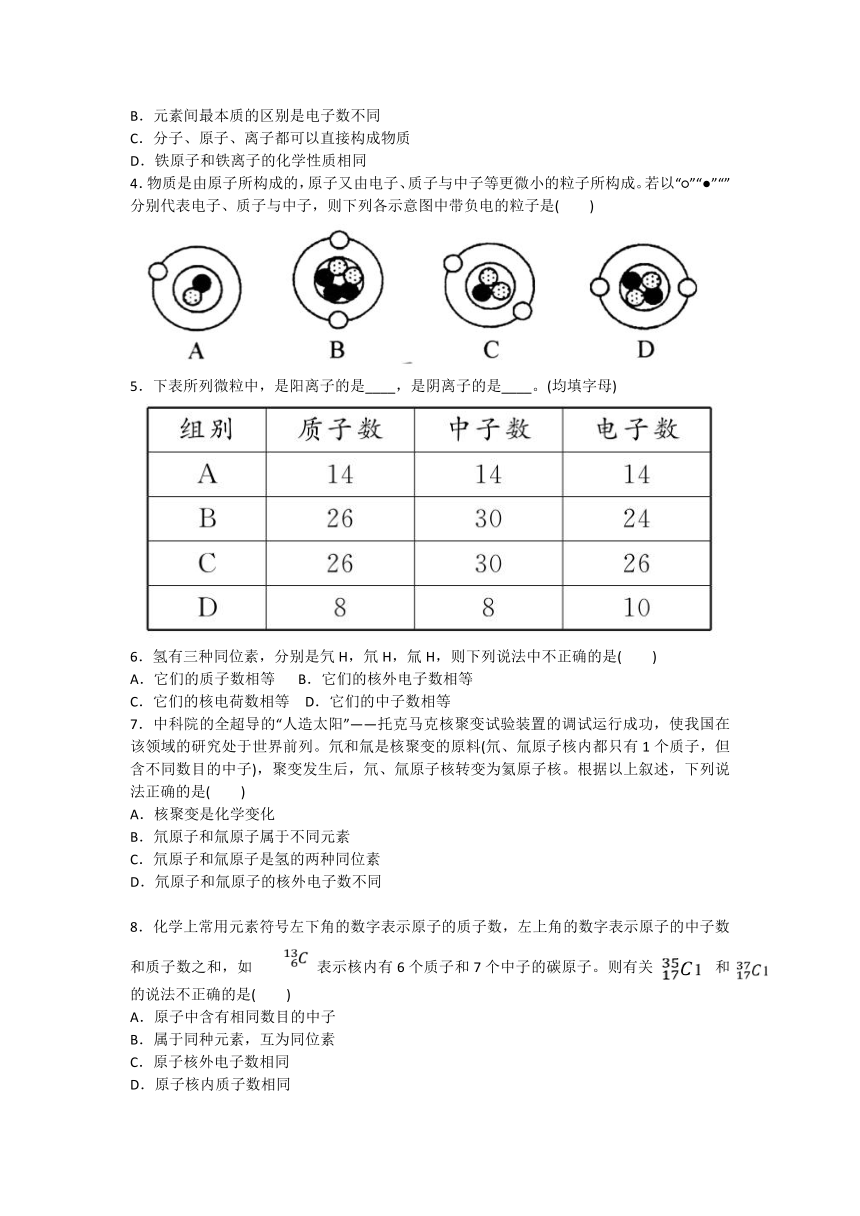
4.物质是由原子所构成的,原子又由电子、质子与中子等更微小的粒子所构成。若以“○”“●”“”分别代表电子、质子与中子,则下列各示意图中带负电的粒子是( )
5.下表所列微粒中,是阳离子的是____,是阴离子的是____。(均填字母)
6.氢有三种同位素,分别是氕H,氘H,氚H,则下列说法中不正确的是( )
A.它们的质子数相等 B.它们的核外电子数相等
C.它们的核电荷数相等 D.它们的中子数相等
7.中科院的全超导的“人造太阳”——托克马克核聚变试验装置的调试运行成功,使我国在该领域的研究处于世界前列。氘和氚是核聚变的原料(氘、氚原子核内都只有1个质子,但含不同数目的中子),聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )
A.核聚变是化学变化
B.氘原子和氚原子属于不同元素
C.氘原子和氚原子是氢的两种同位素
D.氘原子和氚原子的核外电子数不同
8.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数和质子数之和,如 表示核内有6个质子和7个中子的碳原子。则有关 和 的说法不正确的是( )
A.原子中含有相同数目的中子
B.属于同种元素,互为同位素
C.原子核外电子数相同
D.原子核内质子数相同
9.铀元素有“铀234”“铀235”“铀236”三种同位素原子,由于它们的原子的质子数都是92,所以这三种原子属于同种________,化学性质完全相同,由于________不相同,其原子的质量不同。
10.下面是4位同学对分子、原子、离子的描述,其中正确的是( )
11.用“”“○”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A.甲、丁互为同位素 B.乙、丁为同一种元素
C.甲、丙的核电荷数不同 D.甲、丙为同一种原子
12.下列有关微粒的说法错误的是( )
A.通常情况下,气体分子间的空隙大于液体分子间的空隙
B.原子核由中子和电子构成,每个电子带1个单位负电荷
C.阳离子的质子数一定大于核外电子数
D.构成物质的微粒有分子、原子、离子
13.原子、分子、离子、元素等概念的学习,有助于我们认识物质构成的奥秘,下列叙述错误的是( )
A.原子是化学变化中的最小粒子,一切变化中,原子都不能再分
B.由分子构成的物质,分子是保持其化学性质的最小粒子
C.带电的原子或原子团叫做离子,离子也是构成物质的微粒
D.元素是质子数(即核电荷数)相同的一类原子的总称
14.关于同位素原子在医学、农业、环保等方面广泛应用的说法错误的是( )
A.在医学上同位素主要用于显像、诊断和治疗,另外还包括医疗用品消毒、药物作用机理研究和生物医学研究
B.同位素的辐射育种技术为农业提供了改进质量、增加产量的多种有效手段
C.同位素在测定从工厂排放出来的CO2气体的途径及其被植物同化方面起了重要的作用,从而增加了我们对CO2带来的环境冲击的了解
D.在当前大多数应用中,同位素技术已被现有可更替的技术所取代
15.关于下表所列的四种原子的说法中,正确的是( )
①甲和乙属于同种元素 ②甲和丁互为同位素 ③丙和丁互为同位素
A.①② B.①③C.②③ D.①②③
16.科学研究证实,物质是由微粒构成的,例如铁是由铁原子构成的。请你填写构成下列物质的具体微粒的名称。
(1)金属铜是由________构成的。
(2)用于呼吸的氧气是由________构成的。
(3)用于配制生理盐水的氯化钠晶体是由________离子和________离子构成的。
17.如图所示是氕、氘、氚三种氢原子的结构示意图。请根据图中所提供的信息回答下面的问题:
(1)氕、氘、氚三种原子的核内________数相同,________数不同,我们把这三种原子称为________原子。
(2)在原子中,________数=核外________数。
18.(12分)如图所示是金属钠在氯气中燃烧生成氯化钠时的电子得失图,根据图中的信息可得出哪些结论?
(1)结论1:__________________________________________________________________;
(2)结论2:__________________________________________________________________
(3)结论3:___________________________________________________________
答案知识点回顾
1.阴离子 阳离子 得失电子 2.构成物质
3.黄色 白色 4.= > <5.核电荷数
6.质子数相同 不相同 不一定
知识点练习1.D 2.D 3.C 4.C 5.B D 6.D 7.C 8.A
9.元素 中子数
10.B 11.B 12.B 13.A 14.D 15.B
16.铜原子 氧分子 钠 氯
17.(1)质子 中子 同位素 (2)质子 电子
18.(1)原子得失电子后会形成离子 (2)离子是构成物质的一种微粒 (3)钠原子失去电子变成阳离子,氯原子得到电子后变成阴离子(合理即可)
知识点回顾
1.离子是带电的原子或原子团。原子得到电子形成带负电荷的离子称为________,原子失去电子形成带正电荷的离子称为________。离子所带的电荷数取决于它______________的数目。
2.离子与分子、原子一样也是____________的一种微粒。
3.钠在氯气中燃烧的现象:剧烈燃烧、发出________火焰,生成________固体。
4.原子与离子的区别和联系
5.元素:具有相同____________(即质子数)的一类原子的总称。如碳元素就是所有核电荷数为6的原子的总称。
6.原子中原子核内______________、中子数________的同类原子统称为同位素原子。如氢有氕、氘、氚三种同位素原子。因此,原子中质子数________等于中子数。大多数元素都有同位素原子。
7.同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。
知识点练习
1.一个氢原子由一个质子和一个电子构成,不含中子。当1个氢原子失去1个电子后,它不会变成( )
A.质子 B.原子核
C.阳离子 D.带负电荷的离子
2.下列有关钠原子和钠离子的说法中正确的是( )
A.钠离子比钠原子多一个质子
B.钠离子比钠原子多一个电子
C.钠离子与钠原子化学性质相同
D.钠离子与钠原子核内质子数相同
3.下列对分子、原子、离子的认识,正确的是( )
A.原子是一切变化中最小粒子,不可再分
B.元素间最本质的区别是电子数不同
C.分子、原子、离子都可以直接构成物质
D.铁原子和铁离子的化学性质相同
4.物质是由原子所构成的,原子又由电子、质子与中子等更微小的粒子所构成。若以“○”“●”“”分别代表电子、质子与中子,则下列各示意图中带负电的粒子是( )
5.下表所列微粒中,是阳离子的是____,是阴离子的是____。(均填字母)
6.氢有三种同位素,分别是氕H,氘H,氚H,则下列说法中不正确的是( )
A.它们的质子数相等 B.它们的核外电子数相等
C.它们的核电荷数相等 D.它们的中子数相等
7.中科院的全超导的“人造太阳”——托克马克核聚变试验装置的调试运行成功,使我国在该领域的研究处于世界前列。氘和氚是核聚变的原料(氘、氚原子核内都只有1个质子,但含不同数目的中子),聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )
A.核聚变是化学变化
B.氘原子和氚原子属于不同元素
C.氘原子和氚原子是氢的两种同位素
D.氘原子和氚原子的核外电子数不同
8.化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数和质子数之和,如 表示核内有6个质子和7个中子的碳原子。则有关 和 的说法不正确的是( )
A.原子中含有相同数目的中子
B.属于同种元素,互为同位素
C.原子核外电子数相同
D.原子核内质子数相同
9.铀元素有“铀234”“铀235”“铀236”三种同位素原子,由于它们的原子的质子数都是92,所以这三种原子属于同种________,化学性质完全相同,由于________不相同,其原子的质量不同。
10.下面是4位同学对分子、原子、离子的描述,其中正确的是( )
11.用“”“○”和“●”分别表示质子、中子和电子,如图表示四种原子结构模型,下列有关说法正确的是( )
A.甲、丁互为同位素 B.乙、丁为同一种元素
C.甲、丙的核电荷数不同 D.甲、丙为同一种原子
12.下列有关微粒的说法错误的是( )
A.通常情况下,气体分子间的空隙大于液体分子间的空隙
B.原子核由中子和电子构成,每个电子带1个单位负电荷
C.阳离子的质子数一定大于核外电子数
D.构成物质的微粒有分子、原子、离子
13.原子、分子、离子、元素等概念的学习,有助于我们认识物质构成的奥秘,下列叙述错误的是( )
A.原子是化学变化中的最小粒子,一切变化中,原子都不能再分
B.由分子构成的物质,分子是保持其化学性质的最小粒子
C.带电的原子或原子团叫做离子,离子也是构成物质的微粒
D.元素是质子数(即核电荷数)相同的一类原子的总称
14.关于同位素原子在医学、农业、环保等方面广泛应用的说法错误的是( )
A.在医学上同位素主要用于显像、诊断和治疗,另外还包括医疗用品消毒、药物作用机理研究和生物医学研究
B.同位素的辐射育种技术为农业提供了改进质量、增加产量的多种有效手段
C.同位素在测定从工厂排放出来的CO2气体的途径及其被植物同化方面起了重要的作用,从而增加了我们对CO2带来的环境冲击的了解
D.在当前大多数应用中,同位素技术已被现有可更替的技术所取代
15.关于下表所列的四种原子的说法中,正确的是( )
①甲和乙属于同种元素 ②甲和丁互为同位素 ③丙和丁互为同位素
A.①② B.①③C.②③ D.①②③
16.科学研究证实,物质是由微粒构成的,例如铁是由铁原子构成的。请你填写构成下列物质的具体微粒的名称。
(1)金属铜是由________构成的。
(2)用于呼吸的氧气是由________构成的。
(3)用于配制生理盐水的氯化钠晶体是由________离子和________离子构成的。
17.如图所示是氕、氘、氚三种氢原子的结构示意图。请根据图中所提供的信息回答下面的问题:
(1)氕、氘、氚三种原子的核内________数相同,________数不同,我们把这三种原子称为________原子。
(2)在原子中,________数=核外________数。
18.(12分)如图所示是金属钠在氯气中燃烧生成氯化钠时的电子得失图,根据图中的信息可得出哪些结论?
(1)结论1:__________________________________________________________________;
(2)结论2:__________________________________________________________________
(3)结论3:___________________________________________________________
答案知识点回顾
1.阴离子 阳离子 得失电子 2.构成物质
3.黄色 白色 4.= > <5.核电荷数
6.质子数相同 不相同 不一定
知识点练习1.D 2.D 3.C 4.C 5.B D 6.D 7.C 8.A
9.元素 中子数
10.B 11.B 12.B 13.A 14.D 15.B
16.铜原子 氧分子 钠 氯
17.(1)质子 中子 同位素 (2)质子 电子
18.(1)原子得失电子后会形成离子 (2)离子是构成物质的一种微粒 (3)钠原子失去电子变成阳离子,氯原子得到电子后变成阴离子(合理即可)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
