浙教版八下考点复习系列:第2章粒子的模型与符号 (2.1~2.3)课件
文档属性
| 名称 | 浙教版八下考点复习系列:第2章粒子的模型与符号 (2.1~2.3)课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-03-23 10:13:10 | ||
图片预览









文档简介
(共32张PPT)
考点复习系列
范围:2.1~2.3
浙教版 八年级下
考点解读
考点1:模型与符号
(1)模型:可以帮助我们认识一些不能观察到的或者复杂的事物,一个模型可以是一幅画、一张表或计算机图像,也可以是一个复杂的对象或过程(水的状态模型、化学反应模型、电路图、公式等)。
(2)符号:能简单明了地表示事物,还可避免事物外形不同和表达的文字语言不同而引起混乱。符号一般指文字、语言、电码、数学符号、化学符号、物理符号、各种交通标志、安全标志等。
课堂练习
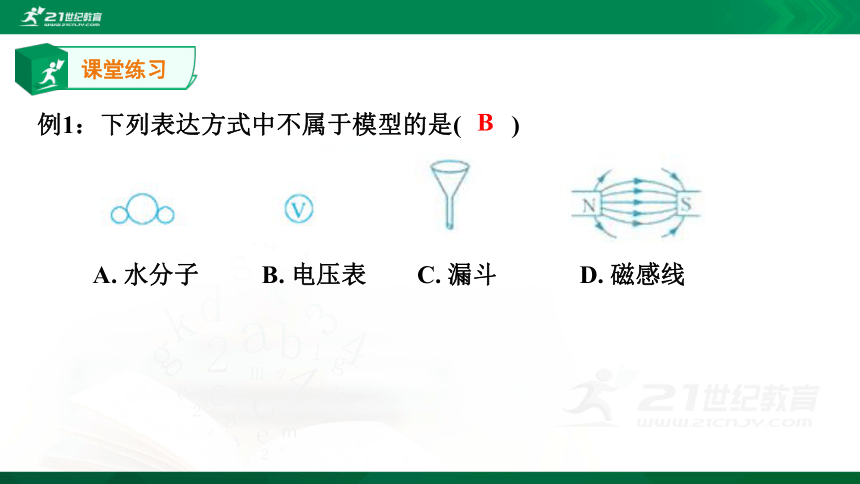
例1:下列表达方式中不属于模型的是(? ? )
A.?水分子 ? B.?电压表 C.?漏斗 D.?磁感线
B
拓展提高
例2:在科学探究的过程中,会用到很多科学方法,如控制变量法、放大法、分类法、模型法等,下列使用模型法的是( )
A.?根据生物能否进行光合作用分为植物和动物
B.?用光线表示光的传播方向
C.?探究压力的作用效果与哪些因素有关
D.?将一用细线悬挂着的乒乓球轻轻靠在发声的音叉上,乒乓球会被弹开,这一现象说明发声的音叉在振动
B
考点2:水的状态模型
(1)水的三态变化从微观角度看,本质是水分子之间的间隔发生变化,而水分子本身没有发生改变。
(2)水的状态模型既直观地表示了水的物态变化中的一些特征,揭示了水在物态变化中发生了变化的因素和没有发生变化的因素,直观地揭示了水的物态变化实质上是一种物理变化。
(3)大多数物质的状态模型表明分子间距离关系为:固态<液态<气态。
但对水而言:液态<固态<气态。
考点解读
课堂练习
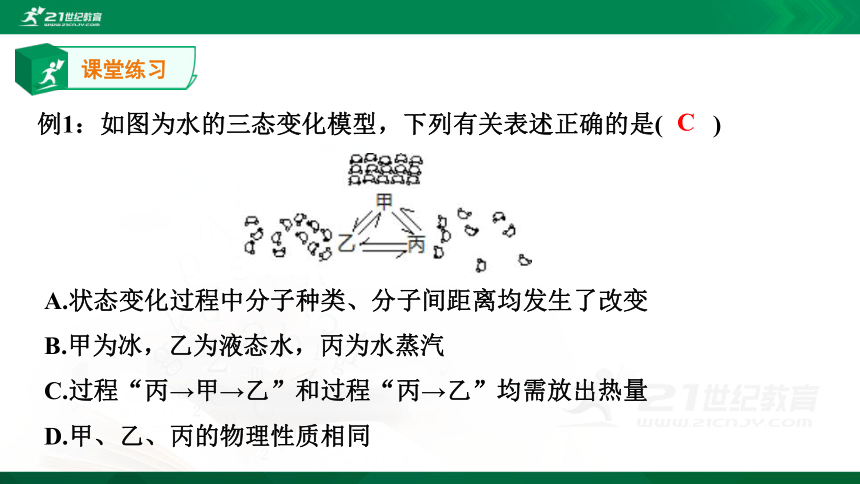
例1:如图为水的三态变化模型,下列有关表述正确的是(? ? )
A.状态变化过程中分子种类、分子间距离均发生了改变
B.甲为冰,乙为液态水,丙为水蒸汽
C.过程“丙→甲→乙”和过程“丙→乙”均需放出热量
D.甲、乙、丙的物理性质相同
C
拓展提高
例2:如图所示是电解水的过程中水分子分解的示意图,大圆表示氧原子,小圆表示氢原子。试回答:
(1)从微观上看,该变化中发生改变的微粒是 ;不变的微粒是
。
(2)从以上模型示意图可得出的结论有: ;
。(至少两个)
水分子
氢原子、氧原子
水是由氢、氧组成的
化学变化中,原子不可分,分子可分
考点解读
考点3:构成物质的微粒
(1)构成物质的微粒:分子、原子、离子;
(2)物质由分子构成,则分子是保持物质化学性质的微粒;
物质由原子构成,则原子是保持物质化学性质的微粒。
考点解读
注意:
a.分子不是保持物质化学性质的唯一微粒;
b.同种分子,物质的化学性质相同,而物理性质可相同也可不同;
不同种分子,物质的化学性质不同,而物理性质可相同也可不同;
因此,分子构成的物质,分子的种类与该物质的化学性质具有对应性,与物理性质不具有对应性,分子能保持该物质的化学性质,而不能保持物质的物理性质。
考点解读
(3)分子与原子的根本区别
化学变化中,分子可分(可变),原子不可分(不可变)。
注意:
a.分子与原子的根本区别是在化学变化中体现的;
b.在结构上,某种分子中完全有可能比某种原子要小;在质量上,同样如此;
课堂练习
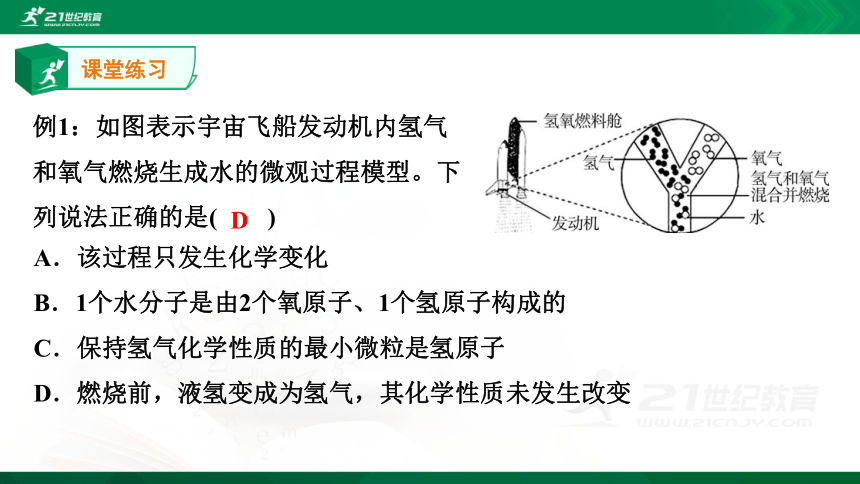
例1:如图表示宇宙飞船发动机内氢气和氧气燃烧生成水的微观过程模型。下列说法正确的是( )
A.该过程只发生化学变化
B.1个水分子是由2个氧原子、1个氢原子构成的
C.保持氢气化学性质的最小微粒是氢原子
D.燃烧前,液氢变成为氢气,其化学性质未发生改变
D
拓展提高
例2:最近,科学家制造出了含4个氧原子的新型“氧分子”,而一个普通氧分子是由2个氧原子构成的,针对以上事实,下列说法中错误的是( )
A.新型“氧分子”与普通氧分子都是由氧原子构成的
B.新型“氧分子”与普通氧分子属于不同种分子
C.新型“氧分子”、普通氧分子的种类不同是因为原子种类不同
D.分别由普通氧分子、新型“氧分子”构成的两种“氧气”,化学性质不同,而物理性质可能相同
C
考点解读
考点4:原子结构模型
(1)原子结构模型建立的发展史:
①道尔顿——实心球模型——首先提出原子;
②汤姆生——葡萄干面包模型(枣糕模型)——发现电子;
③卢瑟福——核式结构模型——α粒子散射实验、提出了原子核;
④玻尔——分层模型;
⑤现代——电子云模型。
考点解读
(2)原子的结构
a.并不是所有原子核内都有中子,如普通氢原子核有无中子;
b.质子、中子由更小的微粒——夸克构成;
c.原子不显电性的原因:
核外电子带负电,质子带正电,且核外电子数=核电荷数(质子数)。
注意:
例1:原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中。如图是锂原子结构的行星模型,根据该模型得出的结论是( )
A.原子核内有4个质子、3个中子、3个电子
B.原子核的体积比整个原子体积的小得多
C.原子的质量主要集中在原子核内
D.质子、中子均匀分布在原子内
课堂练习
B
拓展提高
例2:探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子核)轰击金箔(金原子的核电荷数为79,相对原子质量为197)时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图)。
拓展提高
(1)卢瑟福所说的“极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来”中的“质点”指的是_______。若原子质量、正电荷在原子内均匀分布,则极少数α粒子就_____(选填“会”或“不会”)发生大角度散射。
(2)绝大多数α粒子穿过后方向不变,说明_____(填字母)。
A.原子内部绝大部分空间是空的 B.原子的质量是均匀分布的
(3)金原子的核外电子数为______,中子数为_______。
(4)从原子结构模型建立的过程中,我们发现______(填字母)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
原子核
不会
A
79
118
ABD
考点解读
考点5:元素、同位素、离子
(1) 元素:质子数(或核电荷数)相同的同一类原子的总称;
(2)同位素原子:核内质子数相同、中子数不同的原子间互称;
(3)离子:带电的原子或原子团;
(4)离子的形成过程:原子得到电子形成阴离子;
原子失去电子形成阳离子;
得失电子数即为离子所带电荷数,也是离子中质子数与电子数的差数。
考点解读
注意:
a.不同元素的根本区别:质子数(或核电荷数)不同;
b.同位素原子属于同种元素,质子数相同,中子数不同、相对原子质量
不同;
c.对于原子,不显电性,核外电子数=质子数=核电荷数;
对于阳离子,显正电,核外电子数<质子数=核电荷数;
对于阴离子:显负电,核外电子数>质子数=核电荷数;
d.离子一定带电,但带电的并不一定是离子,可能是质子、电子。
课堂练习
例1:在分子、原子、电子、中子、质子、原子核、离子中选择并按要求填入:
(1)可构成物质的微粒是 ;
(2)显正电的微粒是 ;显负电的微粒是 ;
不显电性的微粒是 ;可能带负电的是 ;
(3)能保持物质化学性质的微粒是 ;
(4)质量最小的微粒是 ;
(5)在同一原子内,数目一定相等的是 ;可能相等的是 ;
(6)在 微粒内,电子数与质子数一定相等;
在 微粒内,电子数与质子数一定不相等;
(7)化学变化中的最小微粒是 ,一定改变的微粒是 。
分子、原子、离子
质子、原子核
电子
分子、原子、中子
分子、原子、离子
电子
质子、电子
质子、中子
分子、原子
离子
原子
分子
离子
提高练习
例2:用“●”、“○”、“●”分别表示质子、中子和电子,如图表示四种原子结构模型,有关说法正确的是( )
A.甲、乙属于同位素原子,因为中子数相同,质子数不同
B.丙、丁属于不同元素,因为中子数不同
C.原子核一定是由质子、中子构成
D.属于同种元素或同位素原子的是甲和丙、乙和丁
D
提高练习
例3:某元素R的原子序数为m,能够形成核外有x个电子的Rn+离子,则下列关系式一定正确的是( )
A.m═n
B.m═n+x
C.m═n-x
D.m═x-n
B
综合训练
综合训练
1.下列能证明分子在化学变化中可分的是( )
A.加热碘后得到紫色的碘蒸气
B.水通电分解得到氢气和氧气
C.冷却热的硝酸钾饱和溶液得到硝酸钾晶体
D.将少量蔗糖加入足量水中后蔗糖“消失”了
B
2.(2019·义乌调研)科学研究发现,世界上没有两片雪花(如图)的形状完全相同。下列相关说法正确的是( )
A.一片雪花只由一个水分子构成
B.不同的雪花,其分子结构不同
C.雪花融化时,水分子之间的间隔发生变化
D.形成雪花的过程中,水分子由运动变为静止
综合训练
C
拓展提高
3.由氢、氧两种原子构成的分子如图所示,其中“o”表示氢原子,
“O”表示氧原子,试回答:
(1)比较A、B、D可知: 。
(2)比较C、E可知: 。
(3)比较B、D可知: 。
分子可由同种原子构成
分子可由不同种原子构成
同种原子可构成不同分子
拓展提高
4.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b
B.原子中b与c的数目一定相同
C.原子的质量主要由a、c决定
D.原子中a与c的数目一定相同
D
5.目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成,且质子和中子都是由三个夸克组成的。u夸克的带电量为+2/3基元电荷,d夸克的带电量为-1/3基元电荷,试回答:
(1)质子由 个u夸克和 个d夸克构成,而中子由 个u夸克和 个d夸克构成;
(2)我们知道,原子的质量主要集中在原子核上,而一个质子和一个中子的质量近似相等。若将质子的质量表示为一个“单位质量”,则某原子中电子数为m,中子数为n,则该原子的质量用可表示为 个单位质量。
综合训练
2
1
1
2
m+n
综合训练
6.现有两种离子,符号表示为Xn+和Ym﹣,右上角为离子所带的电荷数,若两种离子的核外电子数完全相同,Xn+的核电荷数为a,则Y的质子数可表示为 。(用n、m、a表示)
a-n-m
综合训练
7、现有微粒:X、X2+、X3+的,有关这三种微粒的说法如下:
A.质子数:X=X2+=X3+; B.核外电子数:X3+>X2+>X;
C.属于不同种元素; D.原子质量:X3+≈X2+≈X(近似相等);
E.化学性质相同 ; F.属于同种元素;
则以上说法中正确的是 。
ADF
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
考点复习系列
范围:2.1~2.3
浙教版 八年级下
考点解读
考点1:模型与符号
(1)模型:可以帮助我们认识一些不能观察到的或者复杂的事物,一个模型可以是一幅画、一张表或计算机图像,也可以是一个复杂的对象或过程(水的状态模型、化学反应模型、电路图、公式等)。
(2)符号:能简单明了地表示事物,还可避免事物外形不同和表达的文字语言不同而引起混乱。符号一般指文字、语言、电码、数学符号、化学符号、物理符号、各种交通标志、安全标志等。
课堂练习
例1:下列表达方式中不属于模型的是(? ? )
A.?水分子 ? B.?电压表 C.?漏斗 D.?磁感线
B
拓展提高
例2:在科学探究的过程中,会用到很多科学方法,如控制变量法、放大法、分类法、模型法等,下列使用模型法的是( )
A.?根据生物能否进行光合作用分为植物和动物
B.?用光线表示光的传播方向
C.?探究压力的作用效果与哪些因素有关
D.?将一用细线悬挂着的乒乓球轻轻靠在发声的音叉上,乒乓球会被弹开,这一现象说明发声的音叉在振动
B
考点2:水的状态模型
(1)水的三态变化从微观角度看,本质是水分子之间的间隔发生变化,而水分子本身没有发生改变。
(2)水的状态模型既直观地表示了水的物态变化中的一些特征,揭示了水在物态变化中发生了变化的因素和没有发生变化的因素,直观地揭示了水的物态变化实质上是一种物理变化。
(3)大多数物质的状态模型表明分子间距离关系为:固态<液态<气态。
但对水而言:液态<固态<气态。
考点解读
课堂练习
例1:如图为水的三态变化模型,下列有关表述正确的是(? ? )
A.状态变化过程中分子种类、分子间距离均发生了改变
B.甲为冰,乙为液态水,丙为水蒸汽
C.过程“丙→甲→乙”和过程“丙→乙”均需放出热量
D.甲、乙、丙的物理性质相同
C
拓展提高
例2:如图所示是电解水的过程中水分子分解的示意图,大圆表示氧原子,小圆表示氢原子。试回答:
(1)从微观上看,该变化中发生改变的微粒是 ;不变的微粒是
。
(2)从以上模型示意图可得出的结论有: ;
。(至少两个)
水分子
氢原子、氧原子
水是由氢、氧组成的
化学变化中,原子不可分,分子可分
考点解读
考点3:构成物质的微粒
(1)构成物质的微粒:分子、原子、离子;
(2)物质由分子构成,则分子是保持物质化学性质的微粒;
物质由原子构成,则原子是保持物质化学性质的微粒。
考点解读
注意:
a.分子不是保持物质化学性质的唯一微粒;
b.同种分子,物质的化学性质相同,而物理性质可相同也可不同;
不同种分子,物质的化学性质不同,而物理性质可相同也可不同;
因此,分子构成的物质,分子的种类与该物质的化学性质具有对应性,与物理性质不具有对应性,分子能保持该物质的化学性质,而不能保持物质的物理性质。
考点解读
(3)分子与原子的根本区别
化学变化中,分子可分(可变),原子不可分(不可变)。
注意:
a.分子与原子的根本区别是在化学变化中体现的;
b.在结构上,某种分子中完全有可能比某种原子要小;在质量上,同样如此;
课堂练习
例1:如图表示宇宙飞船发动机内氢气和氧气燃烧生成水的微观过程模型。下列说法正确的是( )
A.该过程只发生化学变化
B.1个水分子是由2个氧原子、1个氢原子构成的
C.保持氢气化学性质的最小微粒是氢原子
D.燃烧前,液氢变成为氢气,其化学性质未发生改变
D
拓展提高
例2:最近,科学家制造出了含4个氧原子的新型“氧分子”,而一个普通氧分子是由2个氧原子构成的,针对以上事实,下列说法中错误的是( )
A.新型“氧分子”与普通氧分子都是由氧原子构成的
B.新型“氧分子”与普通氧分子属于不同种分子
C.新型“氧分子”、普通氧分子的种类不同是因为原子种类不同
D.分别由普通氧分子、新型“氧分子”构成的两种“氧气”,化学性质不同,而物理性质可能相同
C
考点解读
考点4:原子结构模型
(1)原子结构模型建立的发展史:
①道尔顿——实心球模型——首先提出原子;
②汤姆生——葡萄干面包模型(枣糕模型)——发现电子;
③卢瑟福——核式结构模型——α粒子散射实验、提出了原子核;
④玻尔——分层模型;
⑤现代——电子云模型。
考点解读
(2)原子的结构
a.并不是所有原子核内都有中子,如普通氢原子核有无中子;
b.质子、中子由更小的微粒——夸克构成;
c.原子不显电性的原因:
核外电子带负电,质子带正电,且核外电子数=核电荷数(质子数)。
注意:
例1:原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中。如图是锂原子结构的行星模型,根据该模型得出的结论是( )
A.原子核内有4个质子、3个中子、3个电子
B.原子核的体积比整个原子体积的小得多
C.原子的质量主要集中在原子核内
D.质子、中子均匀分布在原子内
课堂练习
B
拓展提高
例2:探究原子结构的奥秘:1803年英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子核)轰击金箔(金原子的核电荷数为79,相对原子质量为197)时,发现大多数α粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分α粒子改变了原来的运动路径,甚至有极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图)。
拓展提高
(1)卢瑟福所说的“极少数的α粒子好像碰到了坚硬不可穿透的质点而被弹了回来”中的“质点”指的是_______。若原子质量、正电荷在原子内均匀分布,则极少数α粒子就_____(选填“会”或“不会”)发生大角度散射。
(2)绝大多数α粒子穿过后方向不变,说明_____(填字母)。
A.原子内部绝大部分空间是空的 B.原子的质量是均匀分布的
(3)金原子的核外电子数为______,中子数为_______。
(4)从原子结构模型建立的过程中,我们发现______(填字母)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
原子核
不会
A
79
118
ABD
考点解读
考点5:元素、同位素、离子
(1) 元素:质子数(或核电荷数)相同的同一类原子的总称;
(2)同位素原子:核内质子数相同、中子数不同的原子间互称;
(3)离子:带电的原子或原子团;
(4)离子的形成过程:原子得到电子形成阴离子;
原子失去电子形成阳离子;
得失电子数即为离子所带电荷数,也是离子中质子数与电子数的差数。
考点解读
注意:
a.不同元素的根本区别:质子数(或核电荷数)不同;
b.同位素原子属于同种元素,质子数相同,中子数不同、相对原子质量
不同;
c.对于原子,不显电性,核外电子数=质子数=核电荷数;
对于阳离子,显正电,核外电子数<质子数=核电荷数;
对于阴离子:显负电,核外电子数>质子数=核电荷数;
d.离子一定带电,但带电的并不一定是离子,可能是质子、电子。
课堂练习
例1:在分子、原子、电子、中子、质子、原子核、离子中选择并按要求填入:
(1)可构成物质的微粒是 ;
(2)显正电的微粒是 ;显负电的微粒是 ;
不显电性的微粒是 ;可能带负电的是 ;
(3)能保持物质化学性质的微粒是 ;
(4)质量最小的微粒是 ;
(5)在同一原子内,数目一定相等的是 ;可能相等的是 ;
(6)在 微粒内,电子数与质子数一定相等;
在 微粒内,电子数与质子数一定不相等;
(7)化学变化中的最小微粒是 ,一定改变的微粒是 。
分子、原子、离子
质子、原子核
电子
分子、原子、中子
分子、原子、离子
电子
质子、电子
质子、中子
分子、原子
离子
原子
分子
离子
提高练习
例2:用“●”、“○”、“●”分别表示质子、中子和电子,如图表示四种原子结构模型,有关说法正确的是( )
A.甲、乙属于同位素原子,因为中子数相同,质子数不同
B.丙、丁属于不同元素,因为中子数不同
C.原子核一定是由质子、中子构成
D.属于同种元素或同位素原子的是甲和丙、乙和丁
D
提高练习
例3:某元素R的原子序数为m,能够形成核外有x个电子的Rn+离子,则下列关系式一定正确的是( )
A.m═n
B.m═n+x
C.m═n-x
D.m═x-n
B
综合训练
综合训练
1.下列能证明分子在化学变化中可分的是( )
A.加热碘后得到紫色的碘蒸气
B.水通电分解得到氢气和氧气
C.冷却热的硝酸钾饱和溶液得到硝酸钾晶体
D.将少量蔗糖加入足量水中后蔗糖“消失”了
B
2.(2019·义乌调研)科学研究发现,世界上没有两片雪花(如图)的形状完全相同。下列相关说法正确的是( )
A.一片雪花只由一个水分子构成
B.不同的雪花,其分子结构不同
C.雪花融化时,水分子之间的间隔发生变化
D.形成雪花的过程中,水分子由运动变为静止
综合训练
C
拓展提高
3.由氢、氧两种原子构成的分子如图所示,其中“o”表示氢原子,
“O”表示氧原子,试回答:
(1)比较A、B、D可知: 。
(2)比较C、E可知: 。
(3)比较B、D可知: 。
分子可由同种原子构成
分子可由不同种原子构成
同种原子可构成不同分子
拓展提高
4.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b
B.原子中b与c的数目一定相同
C.原子的质量主要由a、c决定
D.原子中a与c的数目一定相同
D
5.目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成,且质子和中子都是由三个夸克组成的。u夸克的带电量为+2/3基元电荷,d夸克的带电量为-1/3基元电荷,试回答:
(1)质子由 个u夸克和 个d夸克构成,而中子由 个u夸克和 个d夸克构成;
(2)我们知道,原子的质量主要集中在原子核上,而一个质子和一个中子的质量近似相等。若将质子的质量表示为一个“单位质量”,则某原子中电子数为m,中子数为n,则该原子的质量用可表示为 个单位质量。
综合训练
2
1
1
2
m+n
综合训练
6.现有两种离子,符号表示为Xn+和Ym﹣,右上角为离子所带的电荷数,若两种离子的核外电子数完全相同,Xn+的核电荷数为a,则Y的质子数可表示为 。(用n、m、a表示)
a-n-m
综合训练
7、现有微粒:X、X2+、X3+的,有关这三种微粒的说法如下:
A.质子数:X=X2+=X3+; B.核外电子数:X3+>X2+>X;
C.属于不同种元素; D.原子质量:X3+≈X2+≈X(近似相等);
E.化学性质相同 ; F.属于同种元素;
则以上说法中正确的是 。
ADF
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
