2.7 元素符号表示的量 导学案(含答案)
文档属性
| 名称 | 2.7 元素符号表示的量 导学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 135.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-03-27 18:55:05 | ||
图片预览


文档简介
元素符号表示的量
课前一练
1、某元素A的氧化物的化学式为Al2O3,在该氧化物中,A元素和氧元素的质量比为7:3,则A元素的原子量是( C )
A. 14 B. 27 C. 56 D. 64
2、食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中代表一个碳原子,代表一个氢原子,代表一个氧原子。下列说法不正确的是( C )
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1
3、只含铜和氧两种元素的固体样品18 g,测得铜的质量为16 g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:
(1)固体样品中氧元素的质量为________克;??
(2)该样品的组成情况有________(写出所有可能的组成);
(3)若固体样品由两种物质组成,则质量偏少的那种物质的质量分数为________(用分数表示)。
【答案】(1)2(2)①Cu2O ②Cu、CuO ③Cu、CuO、Cu2O(3)4/9
要点导航
一、相对原子质量
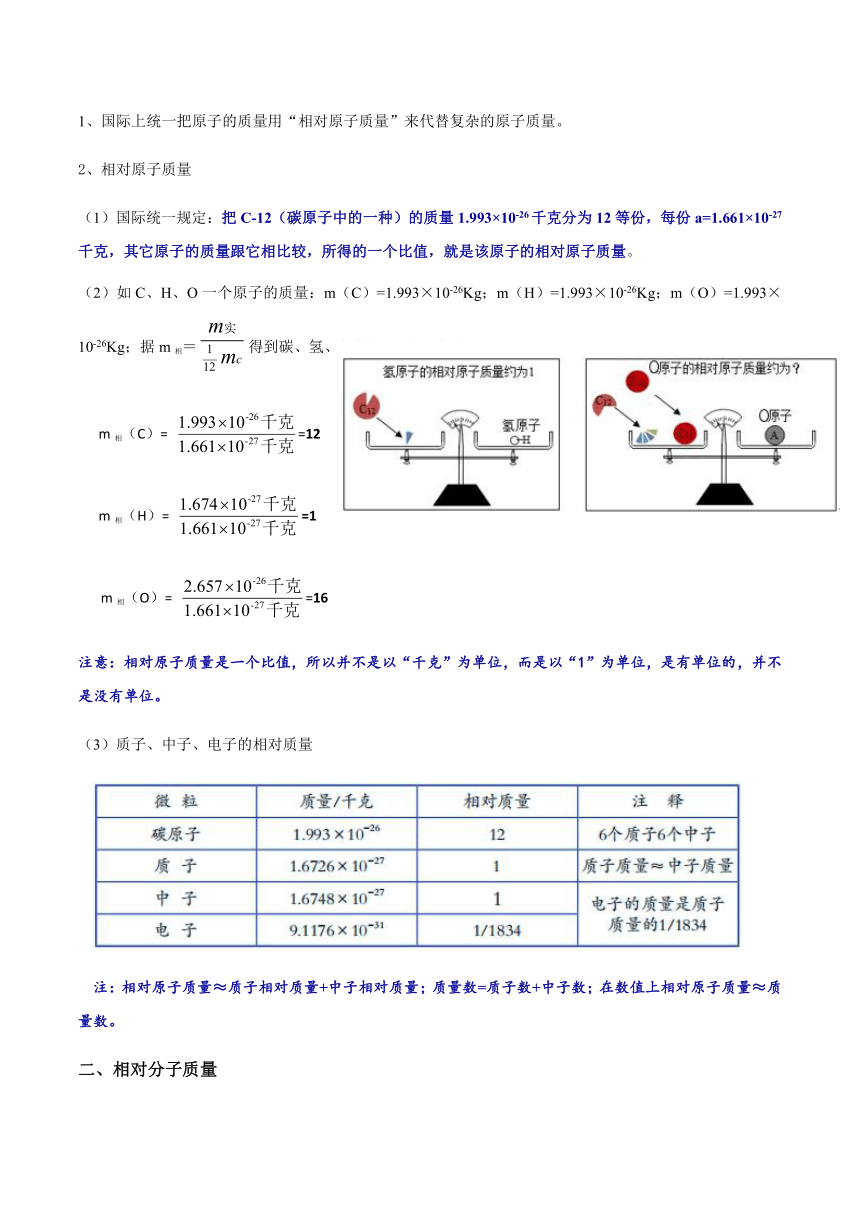
1、国际上统一把原子的质量用“相对原子质量”来代替复杂的原子质量。
2、相对原子质量
(1)国际统一规定:把C-12(碳原子中的一种)的质量1.993×10-26千克分为12等份,每份a=1.661×10-27千克,其它原子的质量跟它相比较,所得的一个比值,就是该原子的相对原子质量。
(2)如C、H、O一个原子的质量:m(C)=1.993×10-26Kg;m(H)=1.993×10-26Kg;m(O)=1.993×10-26Kg;据m相=得到碳、氢、氧的相对原子质量:
m相(C)= =12
m相(H)= =1
m相(O)= =16
注意:相对原子质量是一个比值,所以并不是以“千克”为单位,而是以“1”为单位,是有单位的,并不是没有单位。
(3)质子、中子、电子的相对质量
注:相对原子质量≈质子相对质量+中子相对质量;质量数=质子数+中子数;在数值上相对原子质量≈质量数。
二、相对分子质量
1、一个分子中各原子的相对原子质量总和就是该原子的相对分手质量。
2、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加,如CuSO4·5H2O.[来源:学科网ZXXK]
三、化学式的计算(以AxBy为例,其中A、B的相对原子质量为a、b)
1、相对分子质量:
2、元素A或B的质量分数:
3、A、B两种元素质量比:
4、A元素的质量:
5、混合物中某种物质的纯度(若混合物的质量为M,含有物质AxBy的质量为m):
同步练习
1、某氧化物RO2是一种高效安全灭菌消毒剂.实验测得该氧化物中R与0的质量比为71:64,RO2的化学式为( C )
A.CO2 B.SO2 C.ClO2 D.NO2
2、下列有关物质所含元素质量比的数值正确的是( D )
A.水(H2O) m(H)∶m(O)=1∶2
B.乙炔(C2H2) m(C)∶m(H)=2∶1
C.氨气(NH3) m(N)∶m(H)=14∶1
D.三氧化硫(SO3) m(S)∶m(O)=2∶3
3、钛铁矿(钛Ti)的主要成分是FeTiO,下列说法正确的是(??D )
A.?FeTiO3中Fe、Ti、O 元素的质量比是56:48:16 B.?FeTiO3的相对分子质量是56+48+16 C.?FeTiO3中Fe、Ti、O 的原子个数比是1:1:1 D.?FeTiO3中Ti 元素的质量分数是 ×100%
4、维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.近年来,科学家还发现维生素C有防癌作用.下列关于维生素C的说法中错误的是(?? AB ??) A.?维生素C是氧化物 B.?维生素C是由6个碳元素、8个氢元素、6个氧元素组成 C.?维生素C中,C、H、O三种元素的质量比为9:1:12 D.?青少年应多吃蔬菜水果,切忌偏食
5、有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4,则B的化学式为(??B )
A. XY2 B. XY3 C. X2Y3 D. X3Y2
6、有一可能含有下列物质的硝酸铵样品,经分析知道其中氮元素的质量分数为20%,那么该样品中一定含有的下列物质是?(括号内的数据为相应物质中氮元素的质量分数)?( B ) A.(NH4)2SO4 21%? B. NH4HCO3 18%? C. CO(HN)22%? D. NH4Cl(26%)
7、常温下,某气体可能是由SO2、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的( D )
① SO2?②SO2、CO ③SO2、N2?④CO、N2⑤SO2、CO、N2
A. ①②③ B. ②③⑤ C. ①②⑤ D. ①④⑤
8、中国科学家屠呦呦在青蒿中提取到青蒿素(化学式为C15H22O5),青蒿素被世界卫生组织称为“世界上唯一有效的疟疾治疗药物”,下列有关青蒿素的说法正确的是( C )
A.青蒿素是一种氧化物
B.青蒿素由42个原子构成
C.青蒿素中含有3种元素
D.青蒿素中碳、氧元素的质量比为3:1
9、视黄醇对治疗夜盲症有重要的作用,化学式表示为:C20H30Ox,相对分子质量286,下列有关视黄醇说法中,正确的是( B )
A.视黄醇的化学式中x=2
B.视黄醇在空气中燃烧可能生成二氧化碳和水
C.视黄醇中碳元素与氢元素的质量比为2:3
D.视黄醇中氢元素的质量分数大于碳元素的质量分数
10、碳酸二甲脂(C3H6O3)是一种具有重要应用价值和广阔市场前景的绿色化学试剂,熔点4℃、沸点90.1℃.常温下它是一种无色透明、略有刺激性气味的液体,具有无毒、无腐蚀性、含氧量高,相容性好等特点,下列说法中不正确的是( B )
A.碳酸二甲脂被视为绿色化学试剂与其无毒、无腐蚀性有关
B.一个碳酸二甲脂分子中含有3个碳原子和3个水分子
C.碳酸二甲脂由碳、氢、氧三种元素组成
D.碳酸二钾脂的相对分子质量为90
11、已知1个SO2分子的质量为nkg,1个SO3分子的质量为mkg(设两种分子中都含有同种硫原子和同种氧原子),若以1个硫原子质量的作为标准,则SO2的相对分子质量为( C )
A. B. C. D.
12、“玉兔”在月球岩石中发现了曾被认为是太阳宝石的铁橄榄石,其主要成分是原硅酸亚铁(Fe2SiO4),还在月球物质中捕获到来自太阳风的两种不同的氩原子。
(1)化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如表示核内有18个质子和18个中子的氩原子。由此可知原子核中的中子数为
(2)原硅酸亚铁中硅元素的化合价为 ;
(3)原硅酸亚铁中铁、硅、氧三种原子的质量比为 ;
(4)请计算原硅酸亚铁中氧元素的质量分数为多少?(计算结果精确到0.1%)
【答案】(1)20;(2)+4;(3)28:7:16;(4)31.4%。
课前一练
1、某元素A的氧化物的化学式为Al2O3,在该氧化物中,A元素和氧元素的质量比为7:3,则A元素的原子量是( C )
A. 14 B. 27 C. 56 D. 64
2、食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中代表一个碳原子,代表一个氢原子,代表一个氧原子。下列说法不正确的是( C )
A.乙酸是一种化合物
B.乙酸的相对分子质量为60
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1∶2∶1
3、只含铜和氧两种元素的固体样品18 g,测得铜的质量为16 g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:
(1)固体样品中氧元素的质量为________克;??
(2)该样品的组成情况有________(写出所有可能的组成);
(3)若固体样品由两种物质组成,则质量偏少的那种物质的质量分数为________(用分数表示)。
【答案】(1)2(2)①Cu2O ②Cu、CuO ③Cu、CuO、Cu2O(3)4/9
要点导航
一、相对原子质量
1、国际上统一把原子的质量用“相对原子质量”来代替复杂的原子质量。
2、相对原子质量
(1)国际统一规定:把C-12(碳原子中的一种)的质量1.993×10-26千克分为12等份,每份a=1.661×10-27千克,其它原子的质量跟它相比较,所得的一个比值,就是该原子的相对原子质量。
(2)如C、H、O一个原子的质量:m(C)=1.993×10-26Kg;m(H)=1.993×10-26Kg;m(O)=1.993×10-26Kg;据m相=得到碳、氢、氧的相对原子质量:
m相(C)= =12
m相(H)= =1
m相(O)= =16
注意:相对原子质量是一个比值,所以并不是以“千克”为单位,而是以“1”为单位,是有单位的,并不是没有单位。
(3)质子、中子、电子的相对质量
注:相对原子质量≈质子相对质量+中子相对质量;质量数=质子数+中子数;在数值上相对原子质量≈质量数。
二、相对分子质量
1、一个分子中各原子的相对原子质量总和就是该原子的相对分手质量。
2、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加,如CuSO4·5H2O.[来源:学科网ZXXK]
三、化学式的计算(以AxBy为例,其中A、B的相对原子质量为a、b)
1、相对分子质量:
2、元素A或B的质量分数:
3、A、B两种元素质量比:
4、A元素的质量:
5、混合物中某种物质的纯度(若混合物的质量为M,含有物质AxBy的质量为m):
同步练习
1、某氧化物RO2是一种高效安全灭菌消毒剂.实验测得该氧化物中R与0的质量比为71:64,RO2的化学式为( C )
A.CO2 B.SO2 C.ClO2 D.NO2
2、下列有关物质所含元素质量比的数值正确的是( D )
A.水(H2O) m(H)∶m(O)=1∶2
B.乙炔(C2H2) m(C)∶m(H)=2∶1
C.氨气(NH3) m(N)∶m(H)=14∶1
D.三氧化硫(SO3) m(S)∶m(O)=2∶3
3、钛铁矿(钛Ti)的主要成分是FeTiO,下列说法正确的是(??D )
A.?FeTiO3中Fe、Ti、O 元素的质量比是56:48:16 B.?FeTiO3的相对分子质量是56+48+16 C.?FeTiO3中Fe、Ti、O 的原子个数比是1:1:1 D.?FeTiO3中Ti 元素的质量分数是 ×100%
4、维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.近年来,科学家还发现维生素C有防癌作用.下列关于维生素C的说法中错误的是(?? AB ??) A.?维生素C是氧化物 B.?维生素C是由6个碳元素、8个氢元素、6个氧元素组成 C.?维生素C中,C、H、O三种元素的质量比为9:1:12 D.?青少年应多吃蔬菜水果,切忌偏食
5、有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4,则B的化学式为(??B )
A. XY2 B. XY3 C. X2Y3 D. X3Y2
6、有一可能含有下列物质的硝酸铵样品,经分析知道其中氮元素的质量分数为20%,那么该样品中一定含有的下列物质是?(括号内的数据为相应物质中氮元素的质量分数)?( B ) A.(NH4)2SO4 21%? B. NH4HCO3 18%? C. CO(HN)22%? D. NH4Cl(26%)
7、常温下,某气体可能是由SO2、CO、N2中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的( D )
① SO2?②SO2、CO ③SO2、N2?④CO、N2⑤SO2、CO、N2
A. ①②③ B. ②③⑤ C. ①②⑤ D. ①④⑤
8、中国科学家屠呦呦在青蒿中提取到青蒿素(化学式为C15H22O5),青蒿素被世界卫生组织称为“世界上唯一有效的疟疾治疗药物”,下列有关青蒿素的说法正确的是( C )
A.青蒿素是一种氧化物
B.青蒿素由42个原子构成
C.青蒿素中含有3种元素
D.青蒿素中碳、氧元素的质量比为3:1
9、视黄醇对治疗夜盲症有重要的作用,化学式表示为:C20H30Ox,相对分子质量286,下列有关视黄醇说法中,正确的是( B )
A.视黄醇的化学式中x=2
B.视黄醇在空气中燃烧可能生成二氧化碳和水
C.视黄醇中碳元素与氢元素的质量比为2:3
D.视黄醇中氢元素的质量分数大于碳元素的质量分数
10、碳酸二甲脂(C3H6O3)是一种具有重要应用价值和广阔市场前景的绿色化学试剂,熔点4℃、沸点90.1℃.常温下它是一种无色透明、略有刺激性气味的液体,具有无毒、无腐蚀性、含氧量高,相容性好等特点,下列说法中不正确的是( B )
A.碳酸二甲脂被视为绿色化学试剂与其无毒、无腐蚀性有关
B.一个碳酸二甲脂分子中含有3个碳原子和3个水分子
C.碳酸二甲脂由碳、氢、氧三种元素组成
D.碳酸二钾脂的相对分子质量为90
11、已知1个SO2分子的质量为nkg,1个SO3分子的质量为mkg(设两种分子中都含有同种硫原子和同种氧原子),若以1个硫原子质量的作为标准,则SO2的相对分子质量为( C )
A. B. C. D.
12、“玉兔”在月球岩石中发现了曾被认为是太阳宝石的铁橄榄石,其主要成分是原硅酸亚铁(Fe2SiO4),还在月球物质中捕获到来自太阳风的两种不同的氩原子。
(1)化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如表示核内有18个质子和18个中子的氩原子。由此可知原子核中的中子数为
(2)原硅酸亚铁中硅元素的化合价为 ;
(3)原硅酸亚铁中铁、硅、氧三种原子的质量比为 ;
(4)请计算原硅酸亚铁中氧元素的质量分数为多少?(计算结果精确到0.1%)
【答案】(1)20;(2)+4;(3)28:7:16;(4)31.4%。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
