第3章 空气与生命 阶段专项复习(一)同步练习(课件 32张ppt)
文档属性
| 名称 | 第3章 空气与生命 阶段专项复习(一)同步练习(课件 32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 475.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-04-07 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
阶段专项复习
第3章 空气与生命
答案显示
(1)4∶1 (2)B (3)9.6 (4)1∶1或7∶1
见习题
B
B
C
见习题
见习题
D
产生黑色固体
D
(1)放热(2)化合
A
使可燃物隔绝助燃物
见习题
见习题
1.下列能使带火星木条复燃的气体是( )
A.二氧化碳 B.氧气
C.水蒸气 D.稀有气体
B
2.节日期间的商场里顾客很多,有人会感觉到闷热缺氧,测定出氧气的体积分数可能是( )
A.1% B.19% C.25% D.78%
【点拨】空气中氧气含量为21%,商场里人多,氧气含量会比正常空气中含量偏低,所以氧气的体积分数可能是19%。
B
3.如图是“空气中氧气体积分数测定”实验的改进装置,主要操作是:在实际容积为150 mL的集气瓶里,先装50 mL的水,连接好装置,按下热的玻璃棒,白磷立即被点燃。下列有关该实验的说法不正确的是( )
A.该实验测得的结果误差较小
B.实验后最终集气瓶中水的体积为70 mL
C.白磷刚熄灭就打开弹簧夹
D.整个实验在封闭的容器内进行,污染较小
【点拨】该实验直接用热的玻璃棒去引燃白磷,不需要再打开瓶塞,瓶内气体不会受热从瓶口逸出,因此误差较小,A正确。氧气约占空气体积的五分之一,在实际容积为150 mL的集气瓶里,先装50 mL的水,实验结束后气体体积减少五分之一,则倒吸入的水占原空气体积的五分之一,则最终瓶内水的体积为70 mL,B正确。等装置冷却到室温再打开弹簧夹,C不准确。整个实验在封闭的容器内进行,污染较小,D正确。
【答案】C
4.空气是多种气体组成的混合物,氧气约占21%,氮气约占78%。测定空气中氧气含量的基本思路是:取一定体积的混合气体。方法一:除去氧气测氮气的体积;方法二:除去氮气测氧气的体积。根据所学知识,你认为应除去的气体是________,原因是__________________________________________________________________________。
氧气
氮气化学性质比较稳定(或氮气化学性质不活泼,不易和其他物质发生反应)
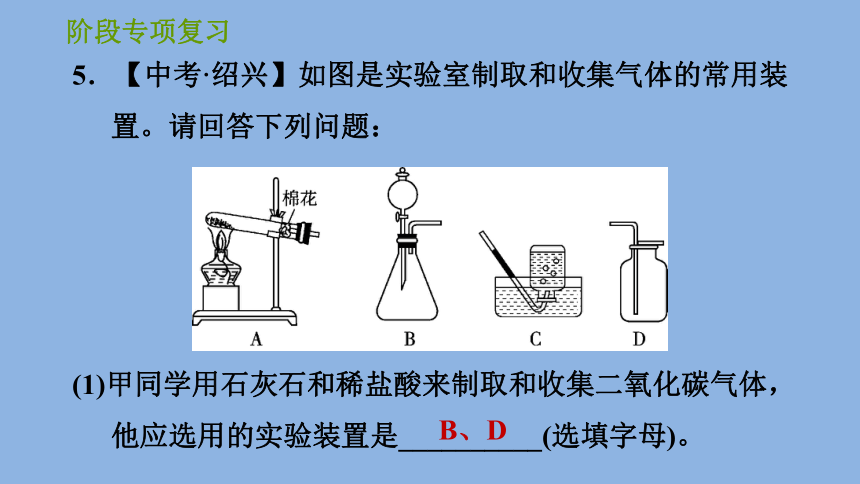
5.【中考·绍兴】如图是实验室制取和收集气体的常用装置。请回答下列问题:
?
(1)甲同学用石灰石和稀盐酸来制取和收集二氧化碳气体,他应选用的实验装置是__________(选填字母)。
B、D
(2)乙同学用加热高锰酸钾来制取氧气,实验过程中发现装置A的试管口有少量水滴。这些水不是生成物的理由是高锰酸钾不含______________。
(3)丙同学在选用B装置探究“二氧化锰能加快过氧化氢分解制氧气”的实验时,老师要求他补充“在盛有少量二氧化锰的试管中加入适量水,并把带火星的木条伸入试管,观察现象”的实验,增补该对照实验的目的是_____________________________________________。
氢元素
排除水中加入二氧化锰也会产生氧气
【点拨】(1)用石灰石和稀盐酸来制取和收集二氧化碳气体,应选择固液常温型发生装置,即B,二氧化碳要用向上排空气法收集,选D;(2)因高锰酸钾中不含氢元素,所以不能生成水;(3)过氧化氢溶液中含有水,排除水中加入二氧化锰也会产生氧气,所以要补充二氧化锰与水混合的实验。
6.【中考·金华】通过观察和实验的方法可获知物质的性质,从物质的状态、颜色、温度变化、有无沉淀或气体生成等方面可寻找物质发生变化的证据,分析各种证据能加深对物质变化和变化规律的认识。则:经引燃的铁丝在氧气中燃烧,支持铁和氧气发生化学反应的最主要证据是_______________________________。
【点拨】能够发生化学反应,一定是产生了反应前没有的新物质,而铁丝在氧气中燃烧最后能够观察到有黑色固体生成,则说明一定发生了化学反应。
【答案】产生黑色固体
7.下列叙述中正确的是( )
A.氧化反应一定是化合反应
B.凡有两种或两种以上物质生成的反应就是分解反应
C.物质只有和氧气发生的反应才是氧化反应
D.红磷在空气中燃烧既属于化合反应,又属于氧化反应
D
8.【中考·绍兴】如图是同学们探究物质燃烧条件的部分装置图。向烧杯中加入适量水,一段时间后,试管中的白磷被引燃。
(1)上述实验现象说明了生石灰和水反应是一个________(填“放热”或“吸热”)过程。
(2)实验中涉及的两个化学反应都属于
基本反应类型中的________反应。
【点拨】(1)白磷能被引燃,说明生石灰与水反应是放热过程。
放热
化合
9.美国化学教材把化学反应分为5种类型,除化合反应、分解反应、置换反应、复分解反应外,第五种是燃烧反应,燃烧反应是一种物质快速结合氧气生成一种或多种氧化物的反应。下列反应既属于化合反应又属于燃烧反应的是( )
【答案】A
10.【中考·宁波】5月12日是我国的“防灾减灾日”,当天宁波会拉响警报,以增强市民的国防观念和防空防灾意识。
若我们掌握一定的应急避险技能,可通过自救与互救来降低灾害风险。例如身上着火,可快速倒在地上,把身上的火苗压灭。这种灭火方式,利用的原理主要是____________________________________。
使可燃物隔绝助燃物
解:碳酸氢钠喷射到燃烧物上受热分解会产生水和二氧化碳;水汽化吸热降低可燃物的温度;又由于二氧化碳不能燃烧也不支持燃烧,密度比空气大而覆盖在可燃物上隔绝氧气,从而起到灭火的作用。
12.【期末·嵊州】有A、B两种物质组成的混合物四份,总质量均为12 g。A和B在一定条件下可发生化合反应生成物质C。四份混合物内含A和B的质量,及它们充分反应后生成C的质量见下表。
物质 第一份 第二份 第三份 第四份
反应前A的质量/g 11 8 a ?
反应前B的质量/g 1 4 b ?
反应后生成C的质量/g 5 10 ? 7.5
(1)第一份混合物中参加反应的A和B的质量比为________。
(2)第二份混合物在反应结束后,反应物中的______________有剩余。
(3)若第三份混合物恰好能完全反应,则a的值是________。
(4)第四份混合物反应前,A和B的质量比为____________。
4∶1
B
9.6
1∶1或7∶1
【点拨】(1)第一份混合物中,B完全反应,则参加反应的A的质量为:5 g-1 g=4 g,那么参加反应的A、B的质量之比:4 g∶1 g=4∶1;(2)第二份混合物中,假设A完全反应,设B的质量为x,可得8 g∶x=4∶1,那么B的质量x=2 g;因为2 g<4 g,所以B有剩余;(3)若第三份混合物恰好能完全反应,那么A、B、C的质量之比为4∶1∶5,即A的质量为:12 g×4/5=9.6 g,B的质量为:12 g-9.6 g=2.4 g;
(4)生成7.5 g C需要A的质量:7.5 g×4/5=6 g,需要B的质量:7.5 g×1/5=1.5 g;混合物剩余:12 g-7.5 g=4.5 g;如果A完全反应,那么B的质量为:1.5 g+4.5 g=6 g,这时A、B质量之比:6 g∶6 g=1∶1;如果B完全反应,那么A的质量为:6 g+4.5 g=10.5 g,这时A、B的质量之比:10.5 g∶1.5 g=7∶1。
13.配平化学方程式时,所配化学计量数是否正确的依据是看等号两边( )
A.化学式前后计量数之和是否相等
B.化学式前后各种元素的种类是否相同
C.化学式前后各种物质的状态是否相同
D.化学式前后各种元素的原子总数是否相等
D
N2
(或氮气)
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2,有科学家正在研究一种不生成CO2的新方法来制取原料气H2,若需要合成8.5万吨氨改用新方法制取原料气H2,可以减少排放多少万吨CO2?
15.【一模·杭州】小乐在验证“CO2能与NaOH溶液反应”时,进行了如下实验:已知①20 ℃、101 kPa时,1体积H2O中最多可溶解1体积CO2,1体积酒精中最多可溶解0.3体积CO2;②20 ℃,在酒精中,NaOH易溶,Na2CO3微溶。
(1)利用两套图甲装置进行实验,在第一套装置中注入3 mL浓NaOH溶液,在第二套装置中注入等量的H2O,振荡试管;当观察到__________________________
_____________________(填写现象),可证明CO2与NaOH发生了反应。
第一套装置中水沸腾,而第二套装置中水不沸腾
(2)利用图乙装置进行实验,将3 mL浓NaOH溶液注入试管后,观察到注射器自动向左移动,最终注射器中剩余5 mL酒精;试管内出现白色沉淀物。出现白色沉淀物的原因是____________________________________
___________________。与NaOH反应的CO2至少是________mL(酒精和氢氧化钠溶液混合后的总体积等于两者体积之和)。
CO2与NaOH反应生成Na2CO3,Na2CO3在酒精中微溶而析出
10.5
【点拨】(1)利用两套图甲装置进行实验,在第一套装置中注入3 mL浓NaOH溶液,在第二套装置中注入等量的H2O,振荡试管;当观察到第一套装置中水沸腾,而第二套装置中水不沸腾可证明CO2与NaOH发生了反应。第一套装置中水沸腾的原因是气压降低会导致原本96 ℃以上但未沸腾的热水沸点降低,从而沸腾起来,说明二氧化碳的量减少,从而得出二氧化碳与氢氧化钠发生反应的结论。
(2)利用图乙装置进行实验,将3 mL浓NaOH溶液注入试管后,观察到注射器自动向左移动,最终注射器中剩余5 mL酒精;试管内出现白色沉淀物。由(1)可知CO2与NaOH反应,生成Na2CO3,而20 ℃,在酒精中,NaOH易溶,Na2CO3微溶,因此碳酸钠在酒精中析出,可看到试管内出现白色沉淀物。由题干所给信息可知,1体积酒精中最多可溶解0.3体积CO2,则20 mL的酒精最后剩余5 mL,说明二氧化碳减少的体积为15 mL,同时压入试管内的15 mL的酒精最多溶解二氧化碳15 mL×0.3=4.5 mL,则与NaOH反应的CO2至少是15 mL-4.5 mL=10.5 mL。
阶段专项复习
第3章 空气与生命
答案显示
(1)4∶1 (2)B (3)9.6 (4)1∶1或7∶1
见习题
B
B
C
见习题
见习题
D
产生黑色固体
D
(1)放热(2)化合
A
使可燃物隔绝助燃物
见习题
见习题
1.下列能使带火星木条复燃的气体是( )
A.二氧化碳 B.氧气
C.水蒸气 D.稀有气体
B
2.节日期间的商场里顾客很多,有人会感觉到闷热缺氧,测定出氧气的体积分数可能是( )
A.1% B.19% C.25% D.78%
【点拨】空气中氧气含量为21%,商场里人多,氧气含量会比正常空气中含量偏低,所以氧气的体积分数可能是19%。
B
3.如图是“空气中氧气体积分数测定”实验的改进装置,主要操作是:在实际容积为150 mL的集气瓶里,先装50 mL的水,连接好装置,按下热的玻璃棒,白磷立即被点燃。下列有关该实验的说法不正确的是( )
A.该实验测得的结果误差较小
B.实验后最终集气瓶中水的体积为70 mL
C.白磷刚熄灭就打开弹簧夹
D.整个实验在封闭的容器内进行,污染较小
【点拨】该实验直接用热的玻璃棒去引燃白磷,不需要再打开瓶塞,瓶内气体不会受热从瓶口逸出,因此误差较小,A正确。氧气约占空气体积的五分之一,在实际容积为150 mL的集气瓶里,先装50 mL的水,实验结束后气体体积减少五分之一,则倒吸入的水占原空气体积的五分之一,则最终瓶内水的体积为70 mL,B正确。等装置冷却到室温再打开弹簧夹,C不准确。整个实验在封闭的容器内进行,污染较小,D正确。
【答案】C
4.空气是多种气体组成的混合物,氧气约占21%,氮气约占78%。测定空气中氧气含量的基本思路是:取一定体积的混合气体。方法一:除去氧气测氮气的体积;方法二:除去氮气测氧气的体积。根据所学知识,你认为应除去的气体是________,原因是__________________________________________________________________________。
氧气
氮气化学性质比较稳定(或氮气化学性质不活泼,不易和其他物质发生反应)
5.【中考·绍兴】如图是实验室制取和收集气体的常用装置。请回答下列问题:
?
(1)甲同学用石灰石和稀盐酸来制取和收集二氧化碳气体,他应选用的实验装置是__________(选填字母)。
B、D
(2)乙同学用加热高锰酸钾来制取氧气,实验过程中发现装置A的试管口有少量水滴。这些水不是生成物的理由是高锰酸钾不含______________。
(3)丙同学在选用B装置探究“二氧化锰能加快过氧化氢分解制氧气”的实验时,老师要求他补充“在盛有少量二氧化锰的试管中加入适量水,并把带火星的木条伸入试管,观察现象”的实验,增补该对照实验的目的是_____________________________________________。
氢元素
排除水中加入二氧化锰也会产生氧气
【点拨】(1)用石灰石和稀盐酸来制取和收集二氧化碳气体,应选择固液常温型发生装置,即B,二氧化碳要用向上排空气法收集,选D;(2)因高锰酸钾中不含氢元素,所以不能生成水;(3)过氧化氢溶液中含有水,排除水中加入二氧化锰也会产生氧气,所以要补充二氧化锰与水混合的实验。
6.【中考·金华】通过观察和实验的方法可获知物质的性质,从物质的状态、颜色、温度变化、有无沉淀或气体生成等方面可寻找物质发生变化的证据,分析各种证据能加深对物质变化和变化规律的认识。则:经引燃的铁丝在氧气中燃烧,支持铁和氧气发生化学反应的最主要证据是_______________________________。
【点拨】能够发生化学反应,一定是产生了反应前没有的新物质,而铁丝在氧气中燃烧最后能够观察到有黑色固体生成,则说明一定发生了化学反应。
【答案】产生黑色固体
7.下列叙述中正确的是( )
A.氧化反应一定是化合反应
B.凡有两种或两种以上物质生成的反应就是分解反应
C.物质只有和氧气发生的反应才是氧化反应
D.红磷在空气中燃烧既属于化合反应,又属于氧化反应
D
8.【中考·绍兴】如图是同学们探究物质燃烧条件的部分装置图。向烧杯中加入适量水,一段时间后,试管中的白磷被引燃。
(1)上述实验现象说明了生石灰和水反应是一个________(填“放热”或“吸热”)过程。
(2)实验中涉及的两个化学反应都属于
基本反应类型中的________反应。
【点拨】(1)白磷能被引燃,说明生石灰与水反应是放热过程。
放热
化合
9.美国化学教材把化学反应分为5种类型,除化合反应、分解反应、置换反应、复分解反应外,第五种是燃烧反应,燃烧反应是一种物质快速结合氧气生成一种或多种氧化物的反应。下列反应既属于化合反应又属于燃烧反应的是( )
【答案】A
10.【中考·宁波】5月12日是我国的“防灾减灾日”,当天宁波会拉响警报,以增强市民的国防观念和防空防灾意识。
若我们掌握一定的应急避险技能,可通过自救与互救来降低灾害风险。例如身上着火,可快速倒在地上,把身上的火苗压灭。这种灭火方式,利用的原理主要是____________________________________。
使可燃物隔绝助燃物
解:碳酸氢钠喷射到燃烧物上受热分解会产生水和二氧化碳;水汽化吸热降低可燃物的温度;又由于二氧化碳不能燃烧也不支持燃烧,密度比空气大而覆盖在可燃物上隔绝氧气,从而起到灭火的作用。
12.【期末·嵊州】有A、B两种物质组成的混合物四份,总质量均为12 g。A和B在一定条件下可发生化合反应生成物质C。四份混合物内含A和B的质量,及它们充分反应后生成C的质量见下表。
物质 第一份 第二份 第三份 第四份
反应前A的质量/g 11 8 a ?
反应前B的质量/g 1 4 b ?
反应后生成C的质量/g 5 10 ? 7.5
(1)第一份混合物中参加反应的A和B的质量比为________。
(2)第二份混合物在反应结束后,反应物中的______________有剩余。
(3)若第三份混合物恰好能完全反应,则a的值是________。
(4)第四份混合物反应前,A和B的质量比为____________。
4∶1
B
9.6
1∶1或7∶1
【点拨】(1)第一份混合物中,B完全反应,则参加反应的A的质量为:5 g-1 g=4 g,那么参加反应的A、B的质量之比:4 g∶1 g=4∶1;(2)第二份混合物中,假设A完全反应,设B的质量为x,可得8 g∶x=4∶1,那么B的质量x=2 g;因为2 g<4 g,所以B有剩余;(3)若第三份混合物恰好能完全反应,那么A、B、C的质量之比为4∶1∶5,即A的质量为:12 g×4/5=9.6 g,B的质量为:12 g-9.6 g=2.4 g;
(4)生成7.5 g C需要A的质量:7.5 g×4/5=6 g,需要B的质量:7.5 g×1/5=1.5 g;混合物剩余:12 g-7.5 g=4.5 g;如果A完全反应,那么B的质量为:1.5 g+4.5 g=6 g,这时A、B质量之比:6 g∶6 g=1∶1;如果B完全反应,那么A的质量为:6 g+4.5 g=10.5 g,这时A、B的质量之比:10.5 g∶1.5 g=7∶1。
13.配平化学方程式时,所配化学计量数是否正确的依据是看等号两边( )
A.化学式前后计量数之和是否相等
B.化学式前后各种元素的种类是否相同
C.化学式前后各种物质的状态是否相同
D.化学式前后各种元素的原子总数是否相等
D
N2
(或氮气)
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2,有科学家正在研究一种不生成CO2的新方法来制取原料气H2,若需要合成8.5万吨氨改用新方法制取原料气H2,可以减少排放多少万吨CO2?
15.【一模·杭州】小乐在验证“CO2能与NaOH溶液反应”时,进行了如下实验:已知①20 ℃、101 kPa时,1体积H2O中最多可溶解1体积CO2,1体积酒精中最多可溶解0.3体积CO2;②20 ℃,在酒精中,NaOH易溶,Na2CO3微溶。
(1)利用两套图甲装置进行实验,在第一套装置中注入3 mL浓NaOH溶液,在第二套装置中注入等量的H2O,振荡试管;当观察到__________________________
_____________________(填写现象),可证明CO2与NaOH发生了反应。
第一套装置中水沸腾,而第二套装置中水不沸腾
(2)利用图乙装置进行实验,将3 mL浓NaOH溶液注入试管后,观察到注射器自动向左移动,最终注射器中剩余5 mL酒精;试管内出现白色沉淀物。出现白色沉淀物的原因是____________________________________
___________________。与NaOH反应的CO2至少是________mL(酒精和氢氧化钠溶液混合后的总体积等于两者体积之和)。
CO2与NaOH反应生成Na2CO3,Na2CO3在酒精中微溶而析出
10.5
【点拨】(1)利用两套图甲装置进行实验,在第一套装置中注入3 mL浓NaOH溶液,在第二套装置中注入等量的H2O,振荡试管;当观察到第一套装置中水沸腾,而第二套装置中水不沸腾可证明CO2与NaOH发生了反应。第一套装置中水沸腾的原因是气压降低会导致原本96 ℃以上但未沸腾的热水沸点降低,从而沸腾起来,说明二氧化碳的量减少,从而得出二氧化碳与氢氧化钠发生反应的结论。
(2)利用图乙装置进行实验,将3 mL浓NaOH溶液注入试管后,观察到注射器自动向左移动,最终注射器中剩余5 mL酒精;试管内出现白色沉淀物。由(1)可知CO2与NaOH反应,生成Na2CO3,而20 ℃,在酒精中,NaOH易溶,Na2CO3微溶,因此碳酸钠在酒精中析出,可看到试管内出现白色沉淀物。由题干所给信息可知,1体积酒精中最多可溶解0.3体积CO2,则20 mL的酒精最后剩余5 mL,说明二氧化碳减少的体积为15 mL,同时压入试管内的15 mL的酒精最多溶解二氧化碳15 mL×0.3=4.5 mL,则与NaOH反应的CO2至少是15 mL-4.5 mL=10.5 mL。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
