沪教版九年级全册化学第7章《应用广泛的酸、碱、盐》—从离子视角复习酸碱盐(71张PPT)
文档属性
| 名称 | 沪教版九年级全册化学第7章《应用广泛的酸、碱、盐》—从离子视角复习酸碱盐(71张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-10 16:27:03 | ||
图片预览










文档简介
(共71张PPT)
《第7章 应用广泛的酸、碱、盐》
----从离子视角复习酸碱盐
化学
一、理清几个概念
1、酸
(1)什么是酸?
(2)溶液酸性的强弱和什么有关?
(3)如何简单区分强酸和弱酸?
(4)酸性溶液和酸的溶液是一回事吗?
酸:a 、定义:电离时生成的阳离子全部是氢离子
的化合物。
b、组成:酸——H+ + 酸根离子(SO42-、
CO32- 、 NO3- 、 Cl- 、 S2-)
c、酸性的强弱和溶液中氢离子(H+)的浓度有关,
氢离子浓度越大,酸性越强。
d、酸溶于水,氢离子完全电离出来的是强酸。
如:硫酸、盐酸、硝酸等
H2SO4=2H++SO42-
酸溶于水,部分电离出氢离子的是弱酸。
如:碳酸 H2CO3?H++HCO3-;HCO3- ?H++CO32-。
e 、酸的溶液一定是酸性的,但酸性溶液不一定是酸的溶液。
例:硫酸氢钠(NaHSO4= Na++H++SO42- )、硫酸铵等。
2、碱
(1) 什么是碱?
(2) 碱性的强弱和什么有关?
(3) 你知道哪些强碱和弱碱?
(4) 碱性溶液和碱的溶液是一回事吗?
碱:a 、定义:电离时生成的阴离子全部是氢氧根离子的化合物。
b、组成:碱——OH- +金属阳离子(或铵根离子)
c、氢氧化钠、氢氧化钾等是强碱,氨水、氢氧化铜等是弱碱。
氨气溶到水中:NH3 +H2O ? NH3·H2O ? NH4++ OH-,
氨水中存在的微粒: NH3·H2O 、NH4+ 、OH- 、NH3 、 H2O 等。
d、碱的溶液一定呈碱性,碱性溶液不一定是碱的溶液。
例:纯碱(Na2CO3) 、草木灰的主要成分(K2CO3)、
小苏打 ( NaHCO3 )都是盐 , 但溶液呈碱性。
3、盐
(1)什么是盐?
(2)盐的溶液都是中性吗?
(3)如何判断盐溶液的酸碱性?
a 、盐 :定义:电离时生成金属离子(或铵根离子)和酸根离子的
化合物。
b、组成: 盐—酸根离子+金属离子(或铵根离子)
c、盐的溶液不一定显中性,一般来说,
强酸和强碱形成的盐溶液呈中性,如:硫酸钠、
氯化钾、氯化钠,硝酸钠等;
强酸和弱碱形成的盐溶液呈酸性,如:硫酸铜、氯化铵等;
弱酸和强碱形成的盐溶液呈碱性,如:碳酸钠、碳酸钾等。
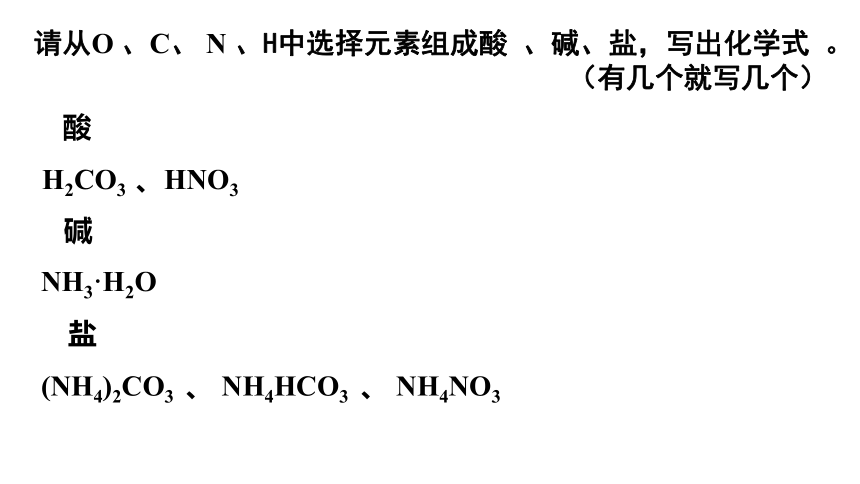
请从O 、C、 N 、H中选择元素组成酸 、碱、盐,写出化学式 。
(有几个就写几个)
酸
H2CO3 、HNO3
碱
NH3·H2O
盐
(NH4)2CO3 、 NH4HCO3 、 NH4NO3
4、复分解反应
a、什么是复分解反应?
b、复分解反应的发生条件是什么?
c、复分解反应的实质是什么?
a、定义:两种化合物相互交换成分生成另外两种化合物的反应。
AB+CD---AD+CB
特点:复分解反应中元素的化合价不变。
b、复分解反应的发生条件:
一看生成物:生成物中要有沉淀或气体或有水生成。
二看反应物:如果反应物中没有酸,要求反应物均可溶。
c、酸碱盐的溶解性口诀
钾、钠、铵、硝酸盐均可溶(Na+ K+ NH4+ NO3- 溶),
碱溶钾、钠、钡、铵( OH- 溶 K+ Na+ Ba 2+ NH4+ ),
氯化物不溶氯化银 (Cl- 不溶 AgCl ↓? ),
硫酸盐不溶硫酸钡( SO42-不溶BaSO4 ↓? ),
碳酸盐只溶钾、钠、铵(CO32- 只溶 K+ Na+ NH4+ )。
钡餐
微溶物为:
氢氧化钙(Ca(OH)2)
硫酸钙(CaSO4 )
硫酸银(Ag2SO4)
碳酸镁(MgCO3)
香薰石膏
练习:判断下列物质之间能否发生复分解反应
.
(1)NaOH +HCl----
NaOH +HCl==NaCl+H2O
(2)?Na2CO3+HCl----
Na2CO3+2HCl==2NaCl+H2O+CO2↑
?
.
?
(3)NaOH+ FeCl3 ----
3NaOH+ FeCl3 = = Fe(OH)3 ↓+ 3NaCl
(4)CuSO4+BaCO3----
×
?
(5)NaCl +KNO3 ----
×
(6)Na 2SO4+BaCl2 ----
Na 2SO4+BaCl2==BaSO4↓+2NaCl
d、复分解反应的实质:
总是朝着自由移动离子的浓度减少的方向进行。
(1) NaOH +HCl== NaCl+H2O
Na+ + OH- + H+ + Cl- == Na+ + Cl- + H2O
H++OH- == H2O?
(2) ?Na2CO3+2HCl == 2NaCl+H2O+CO2↑
2Na+ + CO32-+2 H+ + 2Cl- == 2Na+ + 2 Cl- + H2O +CO2↑
2H++CO32- == CO2↑+ H2O?
?
(3) HCl+AgNO3==AgCl↓+HNO3
H+ + Cl- + Ag+ + NO3- == H+ + AgCl ↓ +NO3-
Ag++Cl- ==AgCl ↓
(4) Na 2SO4+BaCl2==BaSO4↓+2NaCl
2Na+ +SO42-+Ba2++2Cl- ==BaSO4↓+2Na+ +2Cl-
Ba2++SO42-==BaSO4 ↓
(5) NaCl +KNO3 ----
Na+ + Cl- + K+ + NO3- == Na + + NO3- + Cl- + K+
×
练习:请对照书P127,写出常见的离子方程式。
(1)只生成水 H++OH-==H2O?
(2)产生气体
2H++CO32-==CO2↑+ H2O?, H++HCO3-==CO2↑+ H2O?, NH4++OH-==NH3↑+H2O
(3)生成蓝色沉淀
Cu2++2OH-==Cu(OH)2↓
(4)生成红褐色沉淀
Fe3++3OH-==Fe(OH)3↓
(5)既不溶于水,又不溶于酸的白色沉淀
Ba2++SO42-==BaSO4 ↓ Ag++Cl-==AgCl ↓
二、专题训练
专题1、利用特征离子巧解---离子共存问题
离子共存的条件:
相互间不产生沉淀、气体、水。
隐含条件: 酸性溶液中有 H+
碱性溶液中有 OH-
无色溶液中无 Cu2+(蓝色)、Fe2+ (浅绿色)、
Fe3+ (黄色)、MnO4- (紫红色)
练习
1、下列各组内的离子,在溶液中能大量共存的( )??
NH4+、SO42-、NO3- 、OH- B.Ca2+、H+、NO3- 、CO32-
C. Mg2+、K+、 NO3- 、Cl- D. K+、Na+、Mg2+、OH-
解:A. NH4+、SO42-、NO3- OH- NH4++OH-==NH3↑+H2O
B.Ca2+、H+、NO3- 、CO32- Ca2++CO32-==CaCO3 ↓
D. K+、Na+、Mg2+、OH- Mg2++2OH-==Mg(OH)2?↓?
?
答案 :C
2、下列离子能在pH = 12的水溶液中大量共存的是 ( )
??
A. SO42-、 NO3- 、K+、H+ B. Na+、Cl-、OH-、Al3+
C. Cl-、 NO3-、K+、Na+ D. Ag+、Cl-、CO32-、K+
解:A. SO42-、 NO3- 、K+、H+ OH- H++OH- == H2O?
B.Na+、Cl-、OH-、 Al3+ 、 OH- Al3++3OH-== Al (OH)3↓
C.Cl-、 NO3-、K+、Na+ 、 OH-
D.Ag+、Cl-、CO32-、K+ 、 OH-
Ag++Cl- ==AgCl ↓ 、 2Ag++ CO32- ==Ag 2CO3 ↓
2Ag++ OH- ==Ag 2O ↓ +H2O
? ?
答案:C
?
3、下列离子能在水溶液中大量共存的一组是( )
? A. Fe3+、K+、NO3-、OH- B. H+、Na+、HCO3-、Cl-
C. Ba2+、NH4+、Cl-、SO42- D. Na+、K+、NO3-、SO42-
解:A. Fe3+、K+、NO3-、OH- Fe3++3OH-==Fe(OH)3↓
B. H+、Na+、HCO3-、Cl- H+ +HCO3- ==CO2↑+ H2O?
C. Ba2+、NH4+、Cl-、SO42- Ba2++SO42-==BaSO4 ↓
答案:D
专题2、除杂题
除杂原则: 不增——不增加新的杂质
不减——被提纯的物质不能减少
易分——操作简便,易于分离。
除杂方法
利用杂质中的特征离子,将杂质转化为水、气体或沉淀。沉淀可以用过滤的方法除去。
1、除去NaCl溶液中混有的Na2CO3
解: NaCl(Na2CO3)
↓ H+
CO2↑+ H2O?
Na2CO3+ 2H+ == 2NaCl+H2O+CO2↑
适量稀HCl
1、除去NaCl溶液中混有的Na2CO3
或: NaCl(Na2CO3)
↓ Ca2+/ Ba2+
CaCO3 ↓/ BaCO3 ↓
Na2CO3+ Cl- == NaCl + CO3 ↓
适量Ca Cl2溶液或适量Ba Cl2 溶液, 过滤
2、除去NaOH溶液中混有的Na2CO3
NaOH(Na2CO3)
↓ Ca2+/ Ba2+
CaCO3 ↓/ BaCO3 ↓
Na2CO3+ OH- == NaOH + CO3 ↓
适量Ca (OH)2溶液或适量Ba (OH)2 溶液, 过滤
(3)NaNO3(Na2SO4)
适量Ba(NO3)2溶液,过滤
(4)KCl(FeCl3)
适量KOH溶液,过滤
(5) K2SO4(K2CO3)
适量H2SO4溶液
专题3:两两反应
?例:Zn 、 CuO 、NaOH溶液 、稀H2SO4 、
MgCl2 溶液,两两之间能发生的反应有几个?
解:需要知道酸、碱、盐、单质、金属氧化物、
非金属氧化物的性质和它们之间的反应关系。
图中短线“——”表示相连的两类物质能在一定条件下发生反应,请将酸、碱、盐、活泼金属、金属氧化物、非金属氧化物、酸碱指示剂分别填入7个圆圈内。
酸
碱
盐
指示剂
活泼金属
金属氧化物
非金属氧化物
酸
H+
酸碱
指示剂
金属
金属
氧化物
盐
碱
OH-
非金属
氧化物
金属
中和反应
水
盐
解题技巧:从前往后划线
?
Zn CuO H2SO4 NaOH Mg Cl2
Zn + H2SO4
CuO + H2SO4
H2SO4 + NaOH
NaOH + Mg Cl2
?
Fe MgO HCl Ca(OH )2 Cu SO4
Fe + HCl
Fe + Cu SO4
MgO + HCl
HCl + Ca(OH )2
Ca(OH )2 + Cu SO4
?
Fe CO2 HCl NaOH Cu (NO3)2
Fe + HCl
Fe + Cu (NO3)2
CO2 + NaOH
HCl + NaOH
NaOH + Cu (NO3)2
专题4、鉴别题
1、鉴别出NaOH、H2SO4、NaCl 三种溶液?
解:先看物质的类别 ,分别属于酸、碱、盐 。
方法1 : 取样,紫色石蕊试液
方法2 : 取样,无色酚酞试液
无色酚酞
A
B
C
装入C试管内的
液体是NaOH
A
B
装入A试管内的 液体是NaCl
装入B试管内的液体是H2SO4
2、鉴别出HCl 、 NaOH 、 Ca(OH)2三种溶液
解:取样, HCl 、 NaOH 、 Ca(OH)2,
先用无色酚酞或者紫色石蕊试液 ,区分出酸碱,
? NaOH 、 Ca(OH)2
↓+ CO2/ CO32-
CaCO3 ↓
Ca(OH)2 + CO2== CaCO3 ↓+ H2O?
Ca(OH)2 + Na2CO3 == CaCO3 ↓+ 2NaOH
或 K2CO3 KOH
3、只用一种试剂区别Na2CO3 、 Ba(OH)2、NaCl 三种溶液
解:取样 Na2CO3 Ba(OH)2 NaCl
↓ + H+ ↓+ SO4 2-
CO2 ↑ Ba SO4 ↓
2H++CO32-==CO2↑+ H2O
Ba2++SO42-==BaSO4 ↓
取样,加入稀硫酸,有气泡产生的是碳酸钠,有沉淀产生的是 氢氧化钡,无现象的是氯化钠溶液。
4、只用一种试剂区别
HCl 、NaOH 、 CuSO4、MgCl2 四种溶液
解:看颜色,蓝色溶液是硫酸铜,硫酸铜作为已知试剂,取样检验余下三种溶液, 硫酸铜检验出氢氧化钠溶液,氢氧化钠溶液检验出氯化镁溶液。
CuSO4 HCl 、 NaOH 、 MgCl2
Cu2++2OH- ==Cu(OH)2↓ 蓝色沉淀
Mg2++2OH-==Mg(OH)2?↓ ? 白色沉淀
5、不用任何试剂,区别
Na2CO3 、Ba(OH)2 、 Na2SO4 、 HNO3四种溶液
?
解: 取样
Na2CO3 Ba(OH)2 Na2SO4 HNO3
↓ ↑ ↓↓ ↓ ↑
Ba2++CO32-==BaCO3↓
Ba2++SO42-==BaSO4 ↓
2H++CO32-==CO2↑+ H2O
1 2 3 4
6、不用任何试剂,鉴别
NaOH FeCl3 Ba Cl2 HNO3四种溶液
?
解: 取样
NaOH FeCl3 Ba Cl2 HNO3
黄色
Fe3++3OH-==Fe(OH)3↓
Fe(OH)3+3HNO3 == Fe(NO3)3+3 H2O
(红褐色沉淀溶解)
专题5 :常见的盐的典型例题
1、侯德榜制纯碱原理
NaCl+NH3+H2O+CO2===NaHCO3↓+NH4Cl
△
2NaHCO3==== Na2CO3+ H2O+CO2↑
高温
CaCO3==== CaO+CO2↑
CaO+H2O ==== Ca(OH)2
? △
2NH4Cl +Ca(OH)2====2NH3↑+CaCl2+2H2O
1、向食盐水中先通入氨气,再通入二氧化碳的原因?
氨气易溶于水呈碱性,二氧化碳能溶于水呈酸性,促进二氧化碳被氨盐水的吸收。
2、为什么是碳酸氢钠析出,不是氯化铵析出?
常温下,碳酸氢钠的溶解度较小,生成的碳酸氢钠溶解不了,以晶体的形式析出。
NaCl+NH3+H2O+CO2===NaHCO3↓+NH4Cl
58.5 84 53.5
36g 51.7g 32.9g
20°C时 S(NaCl)= 36g
S(NaHCO3 ) = 9.6g
S(NH4Cl)= 37.2g
例:纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl
△
②2NaHCO3==== Na2CO3+ H2O+CO2↑
△
③2NH4Cl +X====2NH3↑+CaCl2+2H2O
根据以上信息回答下列问题。
(1)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:_____▲_
解(1)增大二氧化碳的溶解度,促进二氧化碳的吸收。
(2)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:
一是“索尔维法”。即在氯化铵溶液中加入物质X ▲ (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;
二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的 ▲ ,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用。
△
2NH4Cl + Ca ====2NH3↑+CaCl2+2H2O
? △
NH4++ OH- === NH3↑+H2O
(铵态氮肥和熟石灰、草木灰不能混合使用的原因?)
(2)答案 : Ca(OH)2 溶解度
2、食盐是一种重要的化工原料。请回答下列问题。
⑴请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
⑵由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 ▲ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有 ▲ (用化学式表示)。
?
解:Ca2++CO32-==CaCO3 ↓ Mg2++2OH-==Mg(OH)2?↓
Ba2++SO42-==BaSO4 ↓
?Na Cl(MgCl2、 CaCl2、 Na2SO4)
↓+过量NaOH溶液 ↓+过量Na2CO3 溶液 +过量BaCl2溶液
Mg(OH)2 CaCO3 BaSO4 ↓
+过量Na2CO3 溶液
↓
Ba2++CO32-==BaCO3 ↓ BaCO3
①加入过量NaOH溶液
② 过量Na2CO3 溶液
③ 过量BaCl2溶液
要点:过量BaCl2溶液在过量Na2CO3 溶液之前加入。
加入顺序:①③② 或:③① ② 或③② ①
过滤,得到滤液:NaOH Na2CO3 NaCl 溶液
过滤,得到滤液:NaOH Na2CO3 NaCl 溶液
↓+ H+ ↓+ H+
H2O? CO2↑+ H2O?
向滤液中加入稀盐酸,直到不再产生气泡,得到纯净的氯化钠溶液。
答案: ① BaCl2+ Na2CO3 == BaCO3↓ + 2Na Cl
② Na2CO3、NaOH
3 、 硫酸铜
某工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1) “酸浸”步骤需加热。写出该步骤发生反应的化学方程式______________________
(2) 操作I的名称是 _________,经操作I分离所得溶液中含有的微粒有 ______________(填微粒符号)和H2O。
(3)过量试剂X与操作I分离所得溶液发生反应,写出相关的化学方程式:__________
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中________________,用水洗涤固体2-3次,干燥得到铜粉。
(1) “酸浸”步骤需加热。写出该步骤发生反应的化学方程式______________________
解 : △
(1) CuO + H2SO4 == CuSO4 + H2O?
(2) 操作I的名称是 _________,经操作I分离所得溶液中含有的微粒有 ______________(填微粒符号)和H2O。
解 : (2) 过滤 Cu2 +、H+ 、 SO42-
(3)过量试剂X与操作I分离所得溶液发生反应,写出相关的化学方程式:__________
解:(3) Fe + H2SO4 == Fe SO4 + H2?↑
Fe + CuSO4 == Fe SO4 + Cu
解:
(4) 过量的稀硫酸或稀盐酸或硫酸铜溶液, 过滤
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中________________,用水洗涤固体2-3次,干燥得到铜粉。
4、碳酸钙
从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
(1)反应池I中用硝酸不用稀硫酸的主要原因是______________。
(2)反应池II中加入氨水的目的是______________ 。
(3)反应池III用生成碳酸钙的化学方程式是______________。
(4)过滤II中所得滤液在农业生产中的一种用途是________ ______。
(1)反应池I中用硝酸不用稀硫酸的主要原因是______________
解:(1) 大理石和稀硫酸反应生成的硫酸钙微溶,覆盖在石灰石表面,反应逐渐停止。
(2)反应池II中加入氨水的目的是______________ 。
解:(2) Fe2O3 + 3 HNO3=== Fe(NO3) 3 + 3H2O
NH3·H2O ? NH4++ OH-
Fe3++3OH-==Fe(OH)3↓
中和多余的硝酸,生成氢氧化铁。
(3)反应池III用生成碳酸钙的化学方程式是______________。
(4)过滤II中所得滤液在农业生产中的一种用途是________ 。
解:(3) CaCO3 + 2 HNO3 == Ca(NO3)2 + + H2O+CO2↑
(NH4)2CO3+ Ca(NO3)2 == CaCO3 ↓ +2 NH4NO3
?
(4) 氮肥
干冰放入滴有酚酞的澄清石灰水中,观察溶液的pH和电导率的变化
看视频探根源
Ca(OH)2 +CO2 == CaCO3 ↓ +H2O
CaCO3 +CO2 +H2O == Ca(HCO3)2
《第7章 应用广泛的酸、碱、盐》
----从离子视角复习酸碱盐
化学
一、理清几个概念
1、酸
(1)什么是酸?
(2)溶液酸性的强弱和什么有关?
(3)如何简单区分强酸和弱酸?
(4)酸性溶液和酸的溶液是一回事吗?
酸:a 、定义:电离时生成的阳离子全部是氢离子
的化合物。
b、组成:酸——H+ + 酸根离子(SO42-、
CO32- 、 NO3- 、 Cl- 、 S2-)
c、酸性的强弱和溶液中氢离子(H+)的浓度有关,
氢离子浓度越大,酸性越强。
d、酸溶于水,氢离子完全电离出来的是强酸。
如:硫酸、盐酸、硝酸等
H2SO4=2H++SO42-
酸溶于水,部分电离出氢离子的是弱酸。
如:碳酸 H2CO3?H++HCO3-;HCO3- ?H++CO32-。
e 、酸的溶液一定是酸性的,但酸性溶液不一定是酸的溶液。
例:硫酸氢钠(NaHSO4= Na++H++SO42- )、硫酸铵等。
2、碱
(1) 什么是碱?
(2) 碱性的强弱和什么有关?
(3) 你知道哪些强碱和弱碱?
(4) 碱性溶液和碱的溶液是一回事吗?
碱:a 、定义:电离时生成的阴离子全部是氢氧根离子的化合物。
b、组成:碱——OH- +金属阳离子(或铵根离子)
c、氢氧化钠、氢氧化钾等是强碱,氨水、氢氧化铜等是弱碱。
氨气溶到水中:NH3 +H2O ? NH3·H2O ? NH4++ OH-,
氨水中存在的微粒: NH3·H2O 、NH4+ 、OH- 、NH3 、 H2O 等。
d、碱的溶液一定呈碱性,碱性溶液不一定是碱的溶液。
例:纯碱(Na2CO3) 、草木灰的主要成分(K2CO3)、
小苏打 ( NaHCO3 )都是盐 , 但溶液呈碱性。
3、盐
(1)什么是盐?
(2)盐的溶液都是中性吗?
(3)如何判断盐溶液的酸碱性?
a 、盐 :定义:电离时生成金属离子(或铵根离子)和酸根离子的
化合物。
b、组成: 盐—酸根离子+金属离子(或铵根离子)
c、盐的溶液不一定显中性,一般来说,
强酸和强碱形成的盐溶液呈中性,如:硫酸钠、
氯化钾、氯化钠,硝酸钠等;
强酸和弱碱形成的盐溶液呈酸性,如:硫酸铜、氯化铵等;
弱酸和强碱形成的盐溶液呈碱性,如:碳酸钠、碳酸钾等。
请从O 、C、 N 、H中选择元素组成酸 、碱、盐,写出化学式 。
(有几个就写几个)
酸
H2CO3 、HNO3
碱
NH3·H2O
盐
(NH4)2CO3 、 NH4HCO3 、 NH4NO3
4、复分解反应
a、什么是复分解反应?
b、复分解反应的发生条件是什么?
c、复分解反应的实质是什么?
a、定义:两种化合物相互交换成分生成另外两种化合物的反应。
AB+CD---AD+CB
特点:复分解反应中元素的化合价不变。
b、复分解反应的发生条件:
一看生成物:生成物中要有沉淀或气体或有水生成。
二看反应物:如果反应物中没有酸,要求反应物均可溶。
c、酸碱盐的溶解性口诀
钾、钠、铵、硝酸盐均可溶(Na+ K+ NH4+ NO3- 溶),
碱溶钾、钠、钡、铵( OH- 溶 K+ Na+ Ba 2+ NH4+ ),
氯化物不溶氯化银 (Cl- 不溶 AgCl ↓? ),
硫酸盐不溶硫酸钡( SO42-不溶BaSO4 ↓? ),
碳酸盐只溶钾、钠、铵(CO32- 只溶 K+ Na+ NH4+ )。
钡餐
微溶物为:
氢氧化钙(Ca(OH)2)
硫酸钙(CaSO4 )
硫酸银(Ag2SO4)
碳酸镁(MgCO3)
香薰石膏
练习:判断下列物质之间能否发生复分解反应
.
(1)NaOH +HCl----
NaOH +HCl==NaCl+H2O
(2)?Na2CO3+HCl----
Na2CO3+2HCl==2NaCl+H2O+CO2↑
?
.
?
(3)NaOH+ FeCl3 ----
3NaOH+ FeCl3 = = Fe(OH)3 ↓+ 3NaCl
(4)CuSO4+BaCO3----
×
?
(5)NaCl +KNO3 ----
×
(6)Na 2SO4+BaCl2 ----
Na 2SO4+BaCl2==BaSO4↓+2NaCl
d、复分解反应的实质:
总是朝着自由移动离子的浓度减少的方向进行。
(1) NaOH +HCl== NaCl+H2O
Na+ + OH- + H+ + Cl- == Na+ + Cl- + H2O
H++OH- == H2O?
(2) ?Na2CO3+2HCl == 2NaCl+H2O+CO2↑
2Na+ + CO32-+2 H+ + 2Cl- == 2Na+ + 2 Cl- + H2O +CO2↑
2H++CO32- == CO2↑+ H2O?
?
(3) HCl+AgNO3==AgCl↓+HNO3
H+ + Cl- + Ag+ + NO3- == H+ + AgCl ↓ +NO3-
Ag++Cl- ==AgCl ↓
(4) Na 2SO4+BaCl2==BaSO4↓+2NaCl
2Na+ +SO42-+Ba2++2Cl- ==BaSO4↓+2Na+ +2Cl-
Ba2++SO42-==BaSO4 ↓
(5) NaCl +KNO3 ----
Na+ + Cl- + K+ + NO3- == Na + + NO3- + Cl- + K+
×
练习:请对照书P127,写出常见的离子方程式。
(1)只生成水 H++OH-==H2O?
(2)产生气体
2H++CO32-==CO2↑+ H2O?, H++HCO3-==CO2↑+ H2O?, NH4++OH-==NH3↑+H2O
(3)生成蓝色沉淀
Cu2++2OH-==Cu(OH)2↓
(4)生成红褐色沉淀
Fe3++3OH-==Fe(OH)3↓
(5)既不溶于水,又不溶于酸的白色沉淀
Ba2++SO42-==BaSO4 ↓ Ag++Cl-==AgCl ↓
二、专题训练
专题1、利用特征离子巧解---离子共存问题
离子共存的条件:
相互间不产生沉淀、气体、水。
隐含条件: 酸性溶液中有 H+
碱性溶液中有 OH-
无色溶液中无 Cu2+(蓝色)、Fe2+ (浅绿色)、
Fe3+ (黄色)、MnO4- (紫红色)
练习
1、下列各组内的离子,在溶液中能大量共存的( )??
NH4+、SO42-、NO3- 、OH- B.Ca2+、H+、NO3- 、CO32-
C. Mg2+、K+、 NO3- 、Cl- D. K+、Na+、Mg2+、OH-
解:A. NH4+、SO42-、NO3- OH- NH4++OH-==NH3↑+H2O
B.Ca2+、H+、NO3- 、CO32- Ca2++CO32-==CaCO3 ↓
D. K+、Na+、Mg2+、OH- Mg2++2OH-==Mg(OH)2?↓?
?
答案 :C
2、下列离子能在pH = 12的水溶液中大量共存的是 ( )
??
A. SO42-、 NO3- 、K+、H+ B. Na+、Cl-、OH-、Al3+
C. Cl-、 NO3-、K+、Na+ D. Ag+、Cl-、CO32-、K+
解:A. SO42-、 NO3- 、K+、H+ OH- H++OH- == H2O?
B.Na+、Cl-、OH-、 Al3+ 、 OH- Al3++3OH-== Al (OH)3↓
C.Cl-、 NO3-、K+、Na+ 、 OH-
D.Ag+、Cl-、CO32-、K+ 、 OH-
Ag++Cl- ==AgCl ↓ 、 2Ag++ CO32- ==Ag 2CO3 ↓
2Ag++ OH- ==Ag 2O ↓ +H2O
? ?
答案:C
?
3、下列离子能在水溶液中大量共存的一组是( )
? A. Fe3+、K+、NO3-、OH- B. H+、Na+、HCO3-、Cl-
C. Ba2+、NH4+、Cl-、SO42- D. Na+、K+、NO3-、SO42-
解:A. Fe3+、K+、NO3-、OH- Fe3++3OH-==Fe(OH)3↓
B. H+、Na+、HCO3-、Cl- H+ +HCO3- ==CO2↑+ H2O?
C. Ba2+、NH4+、Cl-、SO42- Ba2++SO42-==BaSO4 ↓
答案:D
专题2、除杂题
除杂原则: 不增——不增加新的杂质
不减——被提纯的物质不能减少
易分——操作简便,易于分离。
除杂方法
利用杂质中的特征离子,将杂质转化为水、气体或沉淀。沉淀可以用过滤的方法除去。
1、除去NaCl溶液中混有的Na2CO3
解: NaCl(Na2CO3)
↓ H+
CO2↑+ H2O?
Na2CO3+ 2H+ == 2NaCl+H2O+CO2↑
适量稀HCl
1、除去NaCl溶液中混有的Na2CO3
或: NaCl(Na2CO3)
↓ Ca2+/ Ba2+
CaCO3 ↓/ BaCO3 ↓
Na2CO3+ Cl- == NaCl + CO3 ↓
适量Ca Cl2溶液或适量Ba Cl2 溶液, 过滤
2、除去NaOH溶液中混有的Na2CO3
NaOH(Na2CO3)
↓ Ca2+/ Ba2+
CaCO3 ↓/ BaCO3 ↓
Na2CO3+ OH- == NaOH + CO3 ↓
适量Ca (OH)2溶液或适量Ba (OH)2 溶液, 过滤
(3)NaNO3(Na2SO4)
适量Ba(NO3)2溶液,过滤
(4)KCl(FeCl3)
适量KOH溶液,过滤
(5) K2SO4(K2CO3)
适量H2SO4溶液
专题3:两两反应
?例:Zn 、 CuO 、NaOH溶液 、稀H2SO4 、
MgCl2 溶液,两两之间能发生的反应有几个?
解:需要知道酸、碱、盐、单质、金属氧化物、
非金属氧化物的性质和它们之间的反应关系。
图中短线“——”表示相连的两类物质能在一定条件下发生反应,请将酸、碱、盐、活泼金属、金属氧化物、非金属氧化物、酸碱指示剂分别填入7个圆圈内。
酸
碱
盐
指示剂
活泼金属
金属氧化物
非金属氧化物
酸
H+
酸碱
指示剂
金属
金属
氧化物
盐
碱
OH-
非金属
氧化物
金属
中和反应
水
盐
解题技巧:从前往后划线
?
Zn CuO H2SO4 NaOH Mg Cl2
Zn + H2SO4
CuO + H2SO4
H2SO4 + NaOH
NaOH + Mg Cl2
?
Fe MgO HCl Ca(OH )2 Cu SO4
Fe + HCl
Fe + Cu SO4
MgO + HCl
HCl + Ca(OH )2
Ca(OH )2 + Cu SO4
?
Fe CO2 HCl NaOH Cu (NO3)2
Fe + HCl
Fe + Cu (NO3)2
CO2 + NaOH
HCl + NaOH
NaOH + Cu (NO3)2
专题4、鉴别题
1、鉴别出NaOH、H2SO4、NaCl 三种溶液?
解:先看物质的类别 ,分别属于酸、碱、盐 。
方法1 : 取样,紫色石蕊试液
方法2 : 取样,无色酚酞试液
无色酚酞
A
B
C
装入C试管内的
液体是NaOH
A
B
装入A试管内的 液体是NaCl
装入B试管内的液体是H2SO4
2、鉴别出HCl 、 NaOH 、 Ca(OH)2三种溶液
解:取样, HCl 、 NaOH 、 Ca(OH)2,
先用无色酚酞或者紫色石蕊试液 ,区分出酸碱,
? NaOH 、 Ca(OH)2
↓+ CO2/ CO32-
CaCO3 ↓
Ca(OH)2 + CO2== CaCO3 ↓+ H2O?
Ca(OH)2 + Na2CO3 == CaCO3 ↓+ 2NaOH
或 K2CO3 KOH
3、只用一种试剂区别Na2CO3 、 Ba(OH)2、NaCl 三种溶液
解:取样 Na2CO3 Ba(OH)2 NaCl
↓ + H+ ↓+ SO4 2-
CO2 ↑ Ba SO4 ↓
2H++CO32-==CO2↑+ H2O
Ba2++SO42-==BaSO4 ↓
取样,加入稀硫酸,有气泡产生的是碳酸钠,有沉淀产生的是 氢氧化钡,无现象的是氯化钠溶液。
4、只用一种试剂区别
HCl 、NaOH 、 CuSO4、MgCl2 四种溶液
解:看颜色,蓝色溶液是硫酸铜,硫酸铜作为已知试剂,取样检验余下三种溶液, 硫酸铜检验出氢氧化钠溶液,氢氧化钠溶液检验出氯化镁溶液。
CuSO4 HCl 、 NaOH 、 MgCl2
Cu2++2OH- ==Cu(OH)2↓ 蓝色沉淀
Mg2++2OH-==Mg(OH)2?↓ ? 白色沉淀
5、不用任何试剂,区别
Na2CO3 、Ba(OH)2 、 Na2SO4 、 HNO3四种溶液
?
解: 取样
Na2CO3 Ba(OH)2 Na2SO4 HNO3
↓ ↑ ↓↓ ↓ ↑
Ba2++CO32-==BaCO3↓
Ba2++SO42-==BaSO4 ↓
2H++CO32-==CO2↑+ H2O
1 2 3 4
6、不用任何试剂,鉴别
NaOH FeCl3 Ba Cl2 HNO3四种溶液
?
解: 取样
NaOH FeCl3 Ba Cl2 HNO3
黄色
Fe3++3OH-==Fe(OH)3↓
Fe(OH)3+3HNO3 == Fe(NO3)3+3 H2O
(红褐色沉淀溶解)
专题5 :常见的盐的典型例题
1、侯德榜制纯碱原理
NaCl+NH3+H2O+CO2===NaHCO3↓+NH4Cl
△
2NaHCO3==== Na2CO3+ H2O+CO2↑
高温
CaCO3==== CaO+CO2↑
CaO+H2O ==== Ca(OH)2
? △
2NH4Cl +Ca(OH)2====2NH3↑+CaCl2+2H2O
1、向食盐水中先通入氨气,再通入二氧化碳的原因?
氨气易溶于水呈碱性,二氧化碳能溶于水呈酸性,促进二氧化碳被氨盐水的吸收。
2、为什么是碳酸氢钠析出,不是氯化铵析出?
常温下,碳酸氢钠的溶解度较小,生成的碳酸氢钠溶解不了,以晶体的形式析出。
NaCl+NH3+H2O+CO2===NaHCO3↓+NH4Cl
58.5 84 53.5
36g 51.7g 32.9g
20°C时 S(NaCl)= 36g
S(NaHCO3 ) = 9.6g
S(NH4Cl)= 37.2g
例:纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl
△
②2NaHCO3==== Na2CO3+ H2O+CO2↑
△
③2NH4Cl +X====2NH3↑+CaCl2+2H2O
根据以上信息回答下列问题。
(1)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:_____▲_
解(1)增大二氧化碳的溶解度,促进二氧化碳的吸收。
(2)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:
一是“索尔维法”。即在氯化铵溶液中加入物质X ▲ (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;
二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的 ▲ ,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用。
△
2NH4Cl + Ca ====2NH3↑+CaCl2+2H2O
? △
NH4++ OH- === NH3↑+H2O
(铵态氮肥和熟石灰、草木灰不能混合使用的原因?)
(2)答案 : Ca(OH)2 溶解度
2、食盐是一种重要的化工原料。请回答下列问题。
⑴请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
⑵由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 ▲ (用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有 ▲ (用化学式表示)。
?
解:Ca2++CO32-==CaCO3 ↓ Mg2++2OH-==Mg(OH)2?↓
Ba2++SO42-==BaSO4 ↓
?Na Cl(MgCl2、 CaCl2、 Na2SO4)
↓+过量NaOH溶液 ↓+过量Na2CO3 溶液 +过量BaCl2溶液
Mg(OH)2 CaCO3 BaSO4 ↓
+过量Na2CO3 溶液
↓
Ba2++CO32-==BaCO3 ↓ BaCO3
①加入过量NaOH溶液
② 过量Na2CO3 溶液
③ 过量BaCl2溶液
要点:过量BaCl2溶液在过量Na2CO3 溶液之前加入。
加入顺序:①③② 或:③① ② 或③② ①
过滤,得到滤液:NaOH Na2CO3 NaCl 溶液
过滤,得到滤液:NaOH Na2CO3 NaCl 溶液
↓+ H+ ↓+ H+
H2O? CO2↑+ H2O?
向滤液中加入稀盐酸,直到不再产生气泡,得到纯净的氯化钠溶液。
答案: ① BaCl2+ Na2CO3 == BaCO3↓ + 2Na Cl
② Na2CO3、NaOH
3 、 硫酸铜
某工厂从含铜废料中回收铜的生产流程如下。(提示:含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水)
(1) “酸浸”步骤需加热。写出该步骤发生反应的化学方程式______________________
(2) 操作I的名称是 _________,经操作I分离所得溶液中含有的微粒有 ______________(填微粒符号)和H2O。
(3)过量试剂X与操作I分离所得溶液发生反应,写出相关的化学方程式:__________
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中________________,用水洗涤固体2-3次,干燥得到铜粉。
(1) “酸浸”步骤需加热。写出该步骤发生反应的化学方程式______________________
解 : △
(1) CuO + H2SO4 == CuSO4 + H2O?
(2) 操作I的名称是 _________,经操作I分离所得溶液中含有的微粒有 ______________(填微粒符号)和H2O。
解 : (2) 过滤 Cu2 +、H+ 、 SO42-
(3)过量试剂X与操作I分离所得溶液发生反应,写出相关的化学方程式:__________
解:(3) Fe + H2SO4 == Fe SO4 + H2?↑
Fe + CuSO4 == Fe SO4 + Cu
解:
(4) 过量的稀硫酸或稀盐酸或硫酸铜溶液, 过滤
(4)请补充完整由固体物质Y得到铜粉的实验方案:向固体物质Y中________________,用水洗涤固体2-3次,干燥得到铜粉。
4、碳酸钙
从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
(1)反应池I中用硝酸不用稀硫酸的主要原因是______________。
(2)反应池II中加入氨水的目的是______________ 。
(3)反应池III用生成碳酸钙的化学方程式是______________。
(4)过滤II中所得滤液在农业生产中的一种用途是________ ______。
(1)反应池I中用硝酸不用稀硫酸的主要原因是______________
解:(1) 大理石和稀硫酸反应生成的硫酸钙微溶,覆盖在石灰石表面,反应逐渐停止。
(2)反应池II中加入氨水的目的是______________ 。
解:(2) Fe2O3 + 3 HNO3=== Fe(NO3) 3 + 3H2O
NH3·H2O ? NH4++ OH-
Fe3++3OH-==Fe(OH)3↓
中和多余的硝酸,生成氢氧化铁。
(3)反应池III用生成碳酸钙的化学方程式是______________。
(4)过滤II中所得滤液在农业生产中的一种用途是________ 。
解:(3) CaCO3 + 2 HNO3 == Ca(NO3)2 + + H2O+CO2↑
(NH4)2CO3+ Ca(NO3)2 == CaCO3 ↓ +2 NH4NO3
?
(4) 氮肥
干冰放入滴有酚酞的澄清石灰水中,观察溶液的pH和电导率的变化
看视频探根源
Ca(OH)2 +CO2 == CaCO3 ↓ +H2O
CaCO3 +CO2 +H2O == Ca(HCO3)2
