人教版高中化学选修2 第一单元 走进化学工业 1.3纯碱的生成 上课课件(共39张ppt)
文档属性
| 名称 | 人教版高中化学选修2 第一单元 走进化学工业 1.3纯碱的生成 上课课件(共39张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 20:39:06 | ||
图片预览










文档简介
(共39张PPT)
美味的食物和漂亮的玻璃有什么共通的部分?
???
导入新课
1.氨碱法生产纯碱
2.联合制碱法
第三节:纯碱的生成
2.了解体验天然碱的生产与化工生产之间的联系及体验技术的发展过程。
1.了解纯碱的生产及发展过程。
3.了解路布兰法,掌握氨碱法(索尔维法)及联合制碱法(侯氏制碱法)。
教学目标
知识与能力
学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对知识进行加工分析,逐步培养独立思考的能力和提高自主学习化学的能力。
在讨论与交流中培养与别人合作的能力,培养团队精神,并且注意加强化学与生活的联系,激发学生学习化学的兴趣,从而提高学化学、爱化学的自觉性。
过程与方法
情感态度与价值观
氨碱法的生产原理。
复杂盐溶液体系中固体物质的结晶、分离和提纯 。
教学重难点
重点
难点
碳酸钠,俗名纯碱,是重要的化学基本产品。
工业中,以纯碱做原料的如下:
制皂
纺织
玻璃
发酵粉
漂染
碳酸钠也广泛应用于生活中。
碳酸钠的分布:
碳酸钠广泛分布在盐碱地和海岸附近的植物中,少量碳酸钠可从植物的灰烬中提取,大量的可从干旱少雨的地表碱湖中获得。
1.从天然碱的形成推测碳酸钠在水中结晶析出的主要影响因素是什么?
根据固体物质在水中溶解度的影响因素,改变温度、结晶水合物的组成及溶剂水的质量等因素,改变碳酸钠在水中溶解情况。从而提高碳酸钠晶体的析出速率和质量。
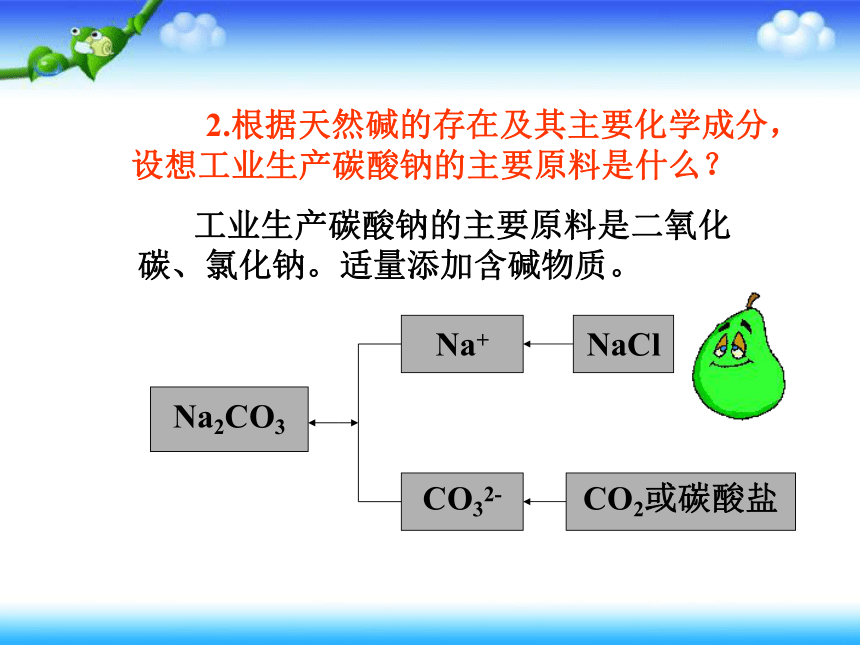
2.根据天然碱的存在及其主要化学成分,设想工业生产碳酸钠的主要原料是什么?
工业生产碳酸钠的主要原料是二氧化碳、氯化钠。适量添加含碱物质。
Na2CO3
Na+
CO32-
NaCl
CO2或碳酸盐
路布兰法工业生产碳酸钠
原理
1.用硫酸将食盐转化成碳酸钠
NaCl+H2SO4 = NaHSO4+HCl↑
120℃
NaCl+NaHSO4 = Na2SO4+HCl↑
600~700℃
2.将硫酸钠与木炭、石灰石一起加热
Na2SO4+2C = Na2S+2CO2↑
1000℃
Na2S+CaCO3 = NaCO3+CaS
1000℃
注:
路布兰法生产纯碱的缺点:原料利用不充分、成本较高、设备腐蚀严重。
一、氨碱法生产纯碱
氨碱法是比利时人索尔维发明的,因此也称索尔维制碱法。
此过程是运用食盐和碳酸钙间接生成的。
1.生成碳酸氢钠和氯化铵
NH3+CO2+H2O=NH4HCO3
NaCl+ NH4HCO3=NaHCO3↓+H2O↑
2.制取碳酸钠
2 NaHCO3 = Na2CO3+CO2↑+H2O↑
△
2ml饱和
NaCl
2ml
NH4HCO3
两支试管混合会出现什么现象?
思考1
现象:
原因:
NH4HCO3+NaCl=NaHCO3+NH4Cl
20℃时,NaHCO3在水中的溶解度为9.6g,很快会析出,形成沉淀。
有沉淀生成。
在氨碱法中加入氨的主要作用是什么?
因为氨气的溶解度很大,一体积水客人吸收700体积氨气。 那么通入的氨气只需要极少的水吸收,基本上可以忽略不计。 所以氯化钠不会析出。
向饱和食盐水中通入氨气,氯化钠为什么不会析出。
思考2
二、联合制氨法
侯德榜(1890-1974),字致本,名启荣,著名化学家,“侯氏制碱法”的创始人。
第三:就是他为发展小化肥工业所做的贡献。
侯德榜一生在化工技术上有三大贡献:
第一:揭开了索尔维制碱法的秘密,并公布于世.
第二:创立了中国人自己的制碱工艺——侯氏制碱法.
1937年,抗日战争爆发,永利碱厂被迫迁往四川,由于当时内地盐价昂贵,用传统的苏尔维法制碱成本太高,无法维持生产,为寻找适应内地条件的制碱工艺,永利公司准备向德国购买新的工艺——察安法的专利,但德国与日本暗中勾结,除了向侯德榜一行高价勒索外,还提出了种种对中国人来说是丧权辱国的条件,为了维护民族尊严,范旭东毅然决定不再与德国人谈判。侯德榜与永利的工程技术人员一道,认真剖析了察安法流程,终于确定了具有自己独立特点的新的制碱工艺,1941年,这种新工艺被命名为“侯氏制碱法”。
背景
(3)2NaHCO3 = Na2CO3+H2O+CO2↑
加热
侯氏制碱法的原理是:
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
侯氏制碱法的原理是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。即复分解反应应有沉淀,气体和难电离的物质生成。
注意
侯氏制碱法
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
反应生成的CO2可以回收再用.从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。
侯氏制碱法的特点是:
生产过程中所需要的氨和二氧化碳都是有合成氨厂提供的,从滤除碳酸氢钠后所得母液中可回收氯化铵。
保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
侯氏制碱法的优点:
联合制碱法与氨碱法的主要区别是什么?
1.联合制碱法又称侯氏制碱法,用于在工业上制取纯碱(Na2CO3)由侯德榜于1943年发明,是世界上广泛采用的制纯碱法。
想一想
2.联合制碱法建立在氨碱法的基础上发展起来的,反应的不同点在于: 在氨碱法的废液中加入氯化钠,并在30~40°C下向废液中通入二氧化碳和氨气,使溶液达到饱和态,然后降温到10°C以下,由于氯化铵在30°C时的溶解度比氯化钠大,而在10°C下比氯化钠溶解度小,以及同离子效应,使氯化铵从母液析出,其母液又可作为下一次制碱的原料,氯化铵也可以作为一种化肥。蒸干得到碳酸钠。
侯氏制碱法主要反应方程式为:
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3 = Na2CO3+H2O+CO2↑
加热
原理不同:
NH3+CO2+H2O=NH4HCO3
NaCl+ NH4HCO3=NaHCO3↓+H2O↑
2 NaHCO3 = Na2CO3+CO2↑+H2O↑
△
氨碱法:
所谓“联合制碱法”中的“联合”,指该法将合成氨工业与制碱工业组合在一起,利用了生产氨时的副产品CO2,革除了用石灰石分解来生产,简化了生产设备。此外,联合制碱法也避免了生产氨碱法中用处不大的副产物氯化钙,而用可作化肥的氯化铵来回收。
1.氨碱法生产纯碱
2.联合制碱法(侯氏制碱法)
路布兰法工业生产碳酸钠
课堂小结
1.设计以纯碱、生石灰和水为原料生产烧碱的实验方案,写出有关的化学方程式。
CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3+2NaOH
课堂练习
2.为了检验纯碱的质量(可能含有少量小苏打),取少量样品进行试验,可以采用的方法是( )
A.加热后通入澄清石灰水,观察现象。
B.滴加盐酸。
C.溶于水中,滴加少量BaCl2溶液,观察现象。
D.溶于水中,滴加少量澄清石灰水,观察现象。
C
3. 按照绿色化学的原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。根据氨碱法总反应方程式:
CaCO3+2NaCl→CaCl2+NaCO3
计算该反应的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)是多少?并思考侯氏制碱法的原子利用率有何变化?
答案:0.49
提高
4.工业上常用氨碱法制碳酸钠,但却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A
A.KHCO3溶解度较大
B.KHCO3溶解度较小
C.K2CO3溶解度较大
D.K2CO3溶解度较大
美味的食物和漂亮的玻璃有什么共通的部分?
???
导入新课
1.氨碱法生产纯碱
2.联合制碱法
第三节:纯碱的生成
2.了解体验天然碱的生产与化工生产之间的联系及体验技术的发展过程。
1.了解纯碱的生产及发展过程。
3.了解路布兰法,掌握氨碱法(索尔维法)及联合制碱法(侯氏制碱法)。
教学目标
知识与能力
学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对知识进行加工分析,逐步培养独立思考的能力和提高自主学习化学的能力。
在讨论与交流中培养与别人合作的能力,培养团队精神,并且注意加强化学与生活的联系,激发学生学习化学的兴趣,从而提高学化学、爱化学的自觉性。
过程与方法
情感态度与价值观
氨碱法的生产原理。
复杂盐溶液体系中固体物质的结晶、分离和提纯 。
教学重难点
重点
难点
碳酸钠,俗名纯碱,是重要的化学基本产品。
工业中,以纯碱做原料的如下:
制皂
纺织
玻璃
发酵粉
漂染
碳酸钠也广泛应用于生活中。
碳酸钠的分布:
碳酸钠广泛分布在盐碱地和海岸附近的植物中,少量碳酸钠可从植物的灰烬中提取,大量的可从干旱少雨的地表碱湖中获得。
1.从天然碱的形成推测碳酸钠在水中结晶析出的主要影响因素是什么?
根据固体物质在水中溶解度的影响因素,改变温度、结晶水合物的组成及溶剂水的质量等因素,改变碳酸钠在水中溶解情况。从而提高碳酸钠晶体的析出速率和质量。
2.根据天然碱的存在及其主要化学成分,设想工业生产碳酸钠的主要原料是什么?
工业生产碳酸钠的主要原料是二氧化碳、氯化钠。适量添加含碱物质。
Na2CO3
Na+
CO32-
NaCl
CO2或碳酸盐
路布兰法工业生产碳酸钠
原理
1.用硫酸将食盐转化成碳酸钠
NaCl+H2SO4 = NaHSO4+HCl↑
120℃
NaCl+NaHSO4 = Na2SO4+HCl↑
600~700℃
2.将硫酸钠与木炭、石灰石一起加热
Na2SO4+2C = Na2S+2CO2↑
1000℃
Na2S+CaCO3 = NaCO3+CaS
1000℃
注:
路布兰法生产纯碱的缺点:原料利用不充分、成本较高、设备腐蚀严重。
一、氨碱法生产纯碱
氨碱法是比利时人索尔维发明的,因此也称索尔维制碱法。
此过程是运用食盐和碳酸钙间接生成的。
1.生成碳酸氢钠和氯化铵
NH3+CO2+H2O=NH4HCO3
NaCl+ NH4HCO3=NaHCO3↓+H2O↑
2.制取碳酸钠
2 NaHCO3 = Na2CO3+CO2↑+H2O↑
△
2ml饱和
NaCl
2ml
NH4HCO3
两支试管混合会出现什么现象?
思考1
现象:
原因:
NH4HCO3+NaCl=NaHCO3+NH4Cl
20℃时,NaHCO3在水中的溶解度为9.6g,很快会析出,形成沉淀。
有沉淀生成。
在氨碱法中加入氨的主要作用是什么?
因为氨气的溶解度很大,一体积水客人吸收700体积氨气。 那么通入的氨气只需要极少的水吸收,基本上可以忽略不计。 所以氯化钠不会析出。
向饱和食盐水中通入氨气,氯化钠为什么不会析出。
思考2
二、联合制氨法
侯德榜(1890-1974),字致本,名启荣,著名化学家,“侯氏制碱法”的创始人。
第三:就是他为发展小化肥工业所做的贡献。
侯德榜一生在化工技术上有三大贡献:
第一:揭开了索尔维制碱法的秘密,并公布于世.
第二:创立了中国人自己的制碱工艺——侯氏制碱法.
1937年,抗日战争爆发,永利碱厂被迫迁往四川,由于当时内地盐价昂贵,用传统的苏尔维法制碱成本太高,无法维持生产,为寻找适应内地条件的制碱工艺,永利公司准备向德国购买新的工艺——察安法的专利,但德国与日本暗中勾结,除了向侯德榜一行高价勒索外,还提出了种种对中国人来说是丧权辱国的条件,为了维护民族尊严,范旭东毅然决定不再与德国人谈判。侯德榜与永利的工程技术人员一道,认真剖析了察安法流程,终于确定了具有自己独立特点的新的制碱工艺,1941年,这种新工艺被命名为“侯氏制碱法”。
背景
(3)2NaHCO3 = Na2CO3+H2O+CO2↑
加热
侯氏制碱法的原理是:
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
侯氏制碱法的原理是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。即复分解反应应有沉淀,气体和难电离的物质生成。
注意
侯氏制碱法
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
反应生成的CO2可以回收再用.从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。
侯氏制碱法的特点是:
生产过程中所需要的氨和二氧化碳都是有合成氨厂提供的,从滤除碳酸氢钠后所得母液中可回收氯化铵。
保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
侯氏制碱法的优点:
联合制碱法与氨碱法的主要区别是什么?
1.联合制碱法又称侯氏制碱法,用于在工业上制取纯碱(Na2CO3)由侯德榜于1943年发明,是世界上广泛采用的制纯碱法。
想一想
2.联合制碱法建立在氨碱法的基础上发展起来的,反应的不同点在于: 在氨碱法的废液中加入氯化钠,并在30~40°C下向废液中通入二氧化碳和氨气,使溶液达到饱和态,然后降温到10°C以下,由于氯化铵在30°C时的溶解度比氯化钠大,而在10°C下比氯化钠溶解度小,以及同离子效应,使氯化铵从母液析出,其母液又可作为下一次制碱的原料,氯化铵也可以作为一种化肥。蒸干得到碳酸钠。
侯氏制碱法主要反应方程式为:
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3 = Na2CO3+H2O+CO2↑
加热
原理不同:
NH3+CO2+H2O=NH4HCO3
NaCl+ NH4HCO3=NaHCO3↓+H2O↑
2 NaHCO3 = Na2CO3+CO2↑+H2O↑
△
氨碱法:
所谓“联合制碱法”中的“联合”,指该法将合成氨工业与制碱工业组合在一起,利用了生产氨时的副产品CO2,革除了用石灰石分解来生产,简化了生产设备。此外,联合制碱法也避免了生产氨碱法中用处不大的副产物氯化钙,而用可作化肥的氯化铵来回收。
1.氨碱法生产纯碱
2.联合制碱法(侯氏制碱法)
路布兰法工业生产碳酸钠
课堂小结
1.设计以纯碱、生石灰和水为原料生产烧碱的实验方案,写出有关的化学方程式。
CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3+2NaOH
课堂练习
2.为了检验纯碱的质量(可能含有少量小苏打),取少量样品进行试验,可以采用的方法是( )
A.加热后通入澄清石灰水,观察现象。
B.滴加盐酸。
C.溶于水中,滴加少量BaCl2溶液,观察现象。
D.溶于水中,滴加少量澄清石灰水,观察现象。
C
3. 按照绿色化学的原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。根据氨碱法总反应方程式:
CaCO3+2NaCl→CaCl2+NaCO3
计算该反应的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)是多少?并思考侯氏制碱法的原子利用率有何变化?
答案:0.49
提高
4.工业上常用氨碱法制碳酸钠,但却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A
A.KHCO3溶解度较大
B.KHCO3溶解度较小
C.K2CO3溶解度较大
D.K2CO3溶解度较大
