人教版高中化学选修2 第一单元 走进化学工业 1.1化学生产过程中的基本问题 上课课件(共43张ppt)
文档属性
| 名称 | 人教版高中化学选修2 第一单元 走进化学工业 1.1化学生产过程中的基本问题 上课课件(共43张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-15 00:00:00 | ||
图片预览










文档简介
(共43张PPT)
化学要发展
认识和体会化学和技术的关系
了解有关化工基本问题
新课导入
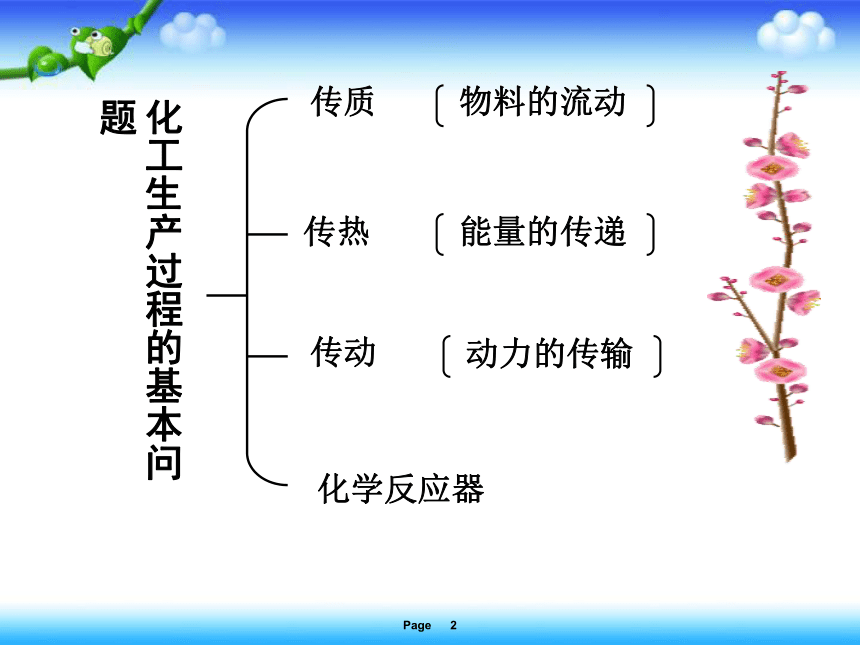
化工生产过程的基本问题
传质
传热
传动
化学反应器
物料的流动
能量的传递
动力的传输
第一节:化学生产过程中
的基本问题
1.依据化学反应原理确定生产过程
2.生产中原料的选择
3.生产中条件的控制
教学目标
知识与能力
了解化学生产过程中的基本问题。
能写出几个化学工业过程。
过程与方法
情感态度与价值观
从反应过程中学习化学性质。
利用教学中的试验探究化学反应过程。
充分发挥学生学习的主动性。
培养学生勤于观察、勤于总结思考的科学态度。
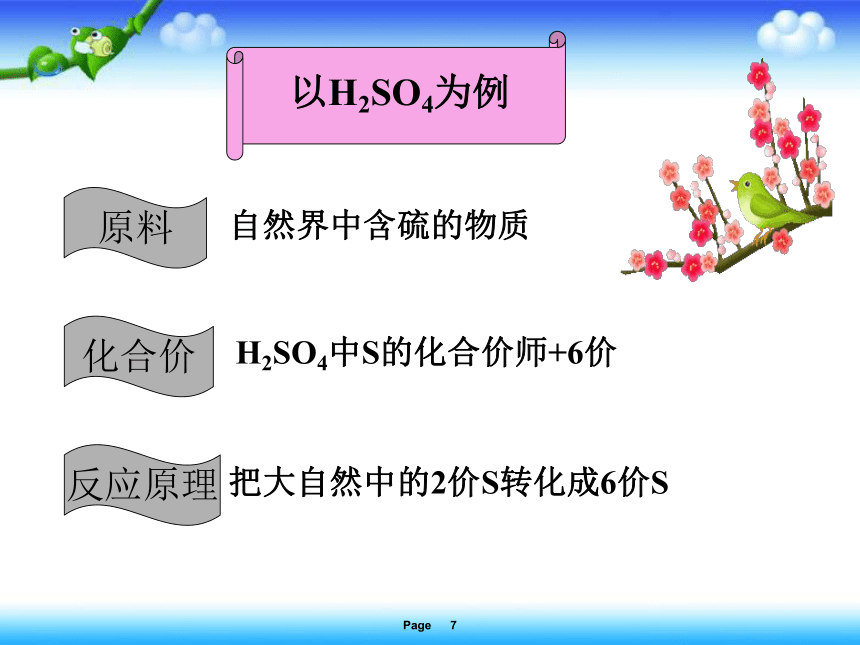
以H2SO4为例
原料
自然界中含硫的物质
化合价
反应原理
H2SO4中S的化合价师+6价
把大自然中的2价S转化成6价S
制硫酸的化学反应原理是什么?
(即把大自然的硫元素转变成+6价的S)
工业上制H2SO4的基本原理:
1.造气(以硫为原料):
S(s)+O2(g)=SO2 △H=-297kJ/mol
3.三氧化硫的吸收(SO3转化成H2SO4):
SO3(g)+H2O(l)= H2SO4(l)
△H= -130.3kJ/mol
2.接触氧化(催化氧化SO2,制成SO3):
SO2(g)+?O2(g) SO3(g)
△H=-98.3kJ/mol
催化剂
SO2+O2
SO2+O2
SO3
反应原理决定反映过程
造气
(制SO3)
SO2
空气
净化、干燥
催化反应室
400~500 ?C
常压、催化剂
吸收塔
稀释室
贮存室
水
发烟硫酸
98%硫酸
98%硫酸
将硫磺或经过粉碎的黄铁矿分别放在专用燃烧炉中利用空气中的O2使其燃烧,得到SO2。
注意
燃烧在沸腾路中进行。
燃烧黄铁矿中出来的炉气中有SO2、O2、N2、水蒸气及杂质砷、硒等化合物和矿尘等。矿尘可是催化剂中毒,水蒸气对设备有不良影响。因此,在进行下一步氧化反应以前,必须对炉气进行净化和干燥处理;而燃烧硫磺制得的炉气除了含有SO2、O2、N2外,杂质较少,不需要经过净化和干燥。
接触氧化中应注意的事项:
★ SO2跟O2是在催化剂表面接触时发生反映的。
★ SO2接触氧化是一个放热反映。
★ SO2的接触氧化也是一个总体积缩小的气体反映。
注意
不同温度下SO2的平衡转化率
温度
/?C 400 450 475 500 525 550 575 600 650 1000
转化率/% 99.2 97.5 95.8 93.5 90.5 85.6 79.9 73.7 58.8 5.0
压强对SO3平衡转化率的影响
压强/MPa
转化率/%
温度
/?C
0.1 0.5 1 10
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
生产中原料的选择
化工生产与科学实验不同。在科学实验中,为了探索某个重要原理或实现某个重要反应,有时不惜花费大量时间和资金。而化工生产则必须在遵循科学原理、实际某个反应的基础上,着重考虑综合经济效益,即要求最大限度地提高劳动生产率、降低成本、保护生态环境,为国民经济各部门提供质优价廉的化工产品,以满足不同需求。
生产中原料的选择
依据化学反应原理
3.原料
4.能源
2.厂址的选择
5.工厂用水的供应能力
6.贮存
7.运输
8.预处理成本
9.环境保护
是否接近
原料供应地
交通运输
是否方便
水源是否充足
土地供应
是否充足
能源是否充
足且价廉
能否达到环境
保护的要求
是否有市场要求
厂址的选择
仪器
产地
配件
耗材
化工
机电
价格
模具
原料
能量
硫酸生产过程中消耗大量的能量。开动机器设备需电能,维持接触氧化适宜的温度(400 ?C-500?C)就需要热能。
怎样充分利用反应中的能量?
想一想
由于硫酸生产过程中三个化学反应都是放热反映,可以充分利用这些反应放出来的热能,以降低生产成本。
在沸腾炉旁设置“废热”锅炉,产生蒸汽来发电;在接触室中设热交换装置,利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2,使其达到适宜反映的温度。
生产中条件的控制
化学平衡:如果外界环境不发生变化,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度将不再发生改变,反应体系处于化学平衡状态。
名词解释
改变反应条件(浓度、温度、压强等)可以使化学平衡状态发生改变,原有的化学平衡被破坏,建立新的化学反应平衡,这一过程叫做平衡的移动。
若条件发生改变,化学反应又会有什么不同?
想一想
继续解答……
生产过程中,SO2的催化氧化反应在什么温度和压强条件下,生成SO3的效率最高?
在工艺生产中,温度为400 ?C-500?C操作时,反应速率和SO2的转化速率都比较理想。而增大气体压强,SO2的平衡转化率提高的并不多,因此在常压下,降低设备对压强的要求。
举一反三
依据化学平衡原理,解释SO2的催化氧化反应中降低温度和增大压强有利于提高转化率?
生产中三废的处理
1.尾气的吸收
二氧化硫是化学工业排放物中常见的有害物质,硫酸生产的含有少量SO2
SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2 +H2O
2.污水的处理
不同化工生产过程产生的污水,是所含的杂质不同,除进行一般处理外,还要根据不同杂质的性质,运用不同的处理方法。
生产过程中的污水,含有硫酸等杂质,可以用石灰乳中和处理。
Ga(OH)2+H2SO4=GaSO4+2H2O
3.废渣的利用
未反应的原料或生产过程中产生的固体废渣,可进行综合利用。
如:黄铁矿矿渣一般可作为制造水泥的原料或用于制砖。含铁品位高的矿渣,经处理后可以炼铁
能量的充分利用
硫酸生产过程中要消耗大量的能量。
开动机器设备(矿石粉碎机、运输装置、鼓风机、泵等)需要电能,维持接触氧化适宜的温度(400?C-500?C)就需要热能。
接触法制硫酸的“三个三”
三个阶段:
造气
接触氧化
SO3的吸收
课堂小结
2.三个反应:
⑴ 4FeS2+11O2 =2Fe2O3+8SO2
或S(s)+O2(g)=SO2(g)
⑵ 2SO2+O2 =2SO3
⑶ SO3(g)+H2O(l)=H2SO4
3.三种设备:
①沸腾炉
②接触室
③吸收塔
硫酸工业综合效益
1.环境保护和综合利用原料
㈠尾气的处理
㈡污水处理
㈢废渣的利用
㈣能量的再利用
2.厂址的选择
①硫酸的运费较高,所以硫酸厂靠近消费中心比靠近原料产地更有利。
②硫酸厂不应建在人口密集的居民区和环保要求高的地区。
含硫制品
硫酸厂用接触法制硫酸的生产过程中,在煅烧黄铁矿时损失硫5%(质量分数);在SO2 的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3为0.6%(质量分数)。现有含FeS2 95%的黄铁矿(杂质不含硫元素)100t,问可制得98%的浓硫酸多少 ?
课堂练习
关系式为FeS2-2H2SO4.
题中反应有:
①4FeS2+11O2 =2Fe2O3+8SO2;
②2SO2+O2 = 2SO3;
③SO3+H2O=H2SO4
1202×98 82.532t xt.98%
实际用于生成H2SO4的FeS2的质量为:
100×95%×(1-0.6%)×92%×(1-5%)=82.532(t)
设可制得98%的H2SO4为xt,
x=142.55,
即可制得98%的浓流酸142.55吨。
有: FeS2 -2H2SO4
为什么化工生产硫酸选用的材料是硫磺,而不是黄铁矿?
早期生产中以黄铁矿为原料:
4FeS2+11O2=2Fe2O3+8SO2
由于生稀罕过程中废弃物太多,处理成本高。
化学要发展
认识和体会化学和技术的关系
了解有关化工基本问题
新课导入
化工生产过程的基本问题
传质
传热
传动
化学反应器
物料的流动
能量的传递
动力的传输
第一节:化学生产过程中
的基本问题
1.依据化学反应原理确定生产过程
2.生产中原料的选择
3.生产中条件的控制
教学目标
知识与能力
了解化学生产过程中的基本问题。
能写出几个化学工业过程。
过程与方法
情感态度与价值观
从反应过程中学习化学性质。
利用教学中的试验探究化学反应过程。
充分发挥学生学习的主动性。
培养学生勤于观察、勤于总结思考的科学态度。
以H2SO4为例
原料
自然界中含硫的物质
化合价
反应原理
H2SO4中S的化合价师+6价
把大自然中的2价S转化成6价S
制硫酸的化学反应原理是什么?
(即把大自然的硫元素转变成+6价的S)
工业上制H2SO4的基本原理:
1.造气(以硫为原料):
S(s)+O2(g)=SO2 △H=-297kJ/mol
3.三氧化硫的吸收(SO3转化成H2SO4):
SO3(g)+H2O(l)= H2SO4(l)
△H= -130.3kJ/mol
2.接触氧化(催化氧化SO2,制成SO3):
SO2(g)+?O2(g) SO3(g)
△H=-98.3kJ/mol
催化剂
SO2+O2
SO2+O2
SO3
反应原理决定反映过程
造气
(制SO3)
SO2
空气
净化、干燥
催化反应室
400~500 ?C
常压、催化剂
吸收塔
稀释室
贮存室
水
发烟硫酸
98%硫酸
98%硫酸
将硫磺或经过粉碎的黄铁矿分别放在专用燃烧炉中利用空气中的O2使其燃烧,得到SO2。
注意
燃烧在沸腾路中进行。
燃烧黄铁矿中出来的炉气中有SO2、O2、N2、水蒸气及杂质砷、硒等化合物和矿尘等。矿尘可是催化剂中毒,水蒸气对设备有不良影响。因此,在进行下一步氧化反应以前,必须对炉气进行净化和干燥处理;而燃烧硫磺制得的炉气除了含有SO2、O2、N2外,杂质较少,不需要经过净化和干燥。
接触氧化中应注意的事项:
★ SO2跟O2是在催化剂表面接触时发生反映的。
★ SO2接触氧化是一个放热反映。
★ SO2的接触氧化也是一个总体积缩小的气体反映。
注意
不同温度下SO2的平衡转化率
温度
/?C 400 450 475 500 525 550 575 600 650 1000
转化率/% 99.2 97.5 95.8 93.5 90.5 85.6 79.9 73.7 58.8 5.0
压强对SO3平衡转化率的影响
压强/MPa
转化率/%
温度
/?C
0.1 0.5 1 10
400 99.2 99.6 99.7 99.9
500 93.5 96.9 97.8 99.3
600 73.7 85.8 89.5 96.4
生产中原料的选择
化工生产与科学实验不同。在科学实验中,为了探索某个重要原理或实现某个重要反应,有时不惜花费大量时间和资金。而化工生产则必须在遵循科学原理、实际某个反应的基础上,着重考虑综合经济效益,即要求最大限度地提高劳动生产率、降低成本、保护生态环境,为国民经济各部门提供质优价廉的化工产品,以满足不同需求。
生产中原料的选择
依据化学反应原理
3.原料
4.能源
2.厂址的选择
5.工厂用水的供应能力
6.贮存
7.运输
8.预处理成本
9.环境保护
是否接近
原料供应地
交通运输
是否方便
水源是否充足
土地供应
是否充足
能源是否充
足且价廉
能否达到环境
保护的要求
是否有市场要求
厂址的选择
仪器
产地
配件
耗材
化工
机电
价格
模具
原料
能量
硫酸生产过程中消耗大量的能量。开动机器设备需电能,维持接触氧化适宜的温度(400 ?C-500?C)就需要热能。
怎样充分利用反应中的能量?
想一想
由于硫酸生产过程中三个化学反应都是放热反映,可以充分利用这些反应放出来的热能,以降低生产成本。
在沸腾炉旁设置“废热”锅炉,产生蒸汽来发电;在接触室中设热交换装置,利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2,使其达到适宜反映的温度。
生产中条件的控制
化学平衡:如果外界环境不发生变化,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度将不再发生改变,反应体系处于化学平衡状态。
名词解释
改变反应条件(浓度、温度、压强等)可以使化学平衡状态发生改变,原有的化学平衡被破坏,建立新的化学反应平衡,这一过程叫做平衡的移动。
若条件发生改变,化学反应又会有什么不同?
想一想
继续解答……
生产过程中,SO2的催化氧化反应在什么温度和压强条件下,生成SO3的效率最高?
在工艺生产中,温度为400 ?C-500?C操作时,反应速率和SO2的转化速率都比较理想。而增大气体压强,SO2的平衡转化率提高的并不多,因此在常压下,降低设备对压强的要求。
举一反三
依据化学平衡原理,解释SO2的催化氧化反应中降低温度和增大压强有利于提高转化率?
生产中三废的处理
1.尾气的吸收
二氧化硫是化学工业排放物中常见的有害物质,硫酸生产的含有少量SO2
SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2 +H2O
2.污水的处理
不同化工生产过程产生的污水,是所含的杂质不同,除进行一般处理外,还要根据不同杂质的性质,运用不同的处理方法。
生产过程中的污水,含有硫酸等杂质,可以用石灰乳中和处理。
Ga(OH)2+H2SO4=GaSO4+2H2O
3.废渣的利用
未反应的原料或生产过程中产生的固体废渣,可进行综合利用。
如:黄铁矿矿渣一般可作为制造水泥的原料或用于制砖。含铁品位高的矿渣,经处理后可以炼铁
能量的充分利用
硫酸生产过程中要消耗大量的能量。
开动机器设备(矿石粉碎机、运输装置、鼓风机、泵等)需要电能,维持接触氧化适宜的温度(400?C-500?C)就需要热能。
接触法制硫酸的“三个三”
三个阶段:
造气
接触氧化
SO3的吸收
课堂小结
2.三个反应:
⑴ 4FeS2+11O2 =2Fe2O3+8SO2
或S(s)+O2(g)=SO2(g)
⑵ 2SO2+O2 =2SO3
⑶ SO3(g)+H2O(l)=H2SO4
3.三种设备:
①沸腾炉
②接触室
③吸收塔
硫酸工业综合效益
1.环境保护和综合利用原料
㈠尾气的处理
㈡污水处理
㈢废渣的利用
㈣能量的再利用
2.厂址的选择
①硫酸的运费较高,所以硫酸厂靠近消费中心比靠近原料产地更有利。
②硫酸厂不应建在人口密集的居民区和环保要求高的地区。
含硫制品
硫酸厂用接触法制硫酸的生产过程中,在煅烧黄铁矿时损失硫5%(质量分数);在SO2 的催化氧化时有92%的二氧化硫转化为三氧化硫;在吸收塔中损失SO3为0.6%(质量分数)。现有含FeS2 95%的黄铁矿(杂质不含硫元素)100t,问可制得98%的浓硫酸多少 ?
课堂练习
关系式为FeS2-2H2SO4.
题中反应有:
①4FeS2+11O2 =2Fe2O3+8SO2;
②2SO2+O2 = 2SO3;
③SO3+H2O=H2SO4
1202×98 82.532t xt.98%
实际用于生成H2SO4的FeS2的质量为:
100×95%×(1-0.6%)×92%×(1-5%)=82.532(t)
设可制得98%的H2SO4为xt,
x=142.55,
即可制得98%的浓流酸142.55吨。
有: FeS2 -2H2SO4
为什么化工生产硫酸选用的材料是硫磺,而不是黄铁矿?
早期生产中以黄铁矿为原料:
4FeS2+11O2=2Fe2O3+8SO2
由于生稀罕过程中废弃物太多,处理成本高。
