第2章 微粒的模型与符号 复习(课件 49张ppt)
文档属性
| 名称 | 第2章 微粒的模型与符号 复习(课件 49张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-04-14 20:32:42 | ||
图片预览








文档简介
(共49张PPT)
第二章 微粒的模型和符号
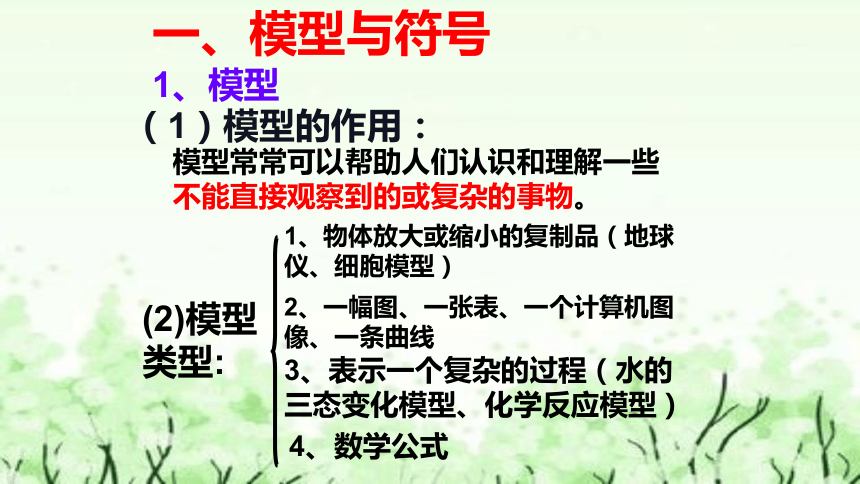
一、模型与符号
1、模型
(1)模型的作用:
模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
(2)模型类型:
1、物体放大或缩小的复制品(地球仪、细胞模型)
2、一幅图、一张表、一个计算机图像、一条曲线
3、表示一个复杂的过程(水的三态变化模型、化学反应模型)
4、数学公式
分析电流表符号可以得出结论:
2、用符号可避免由于事物外形不同而引起的混乱。
分析时间符号可以得出结论:
3、用符号可以避免由于表达事物的文字语言不同而引起的混乱。
二、符号
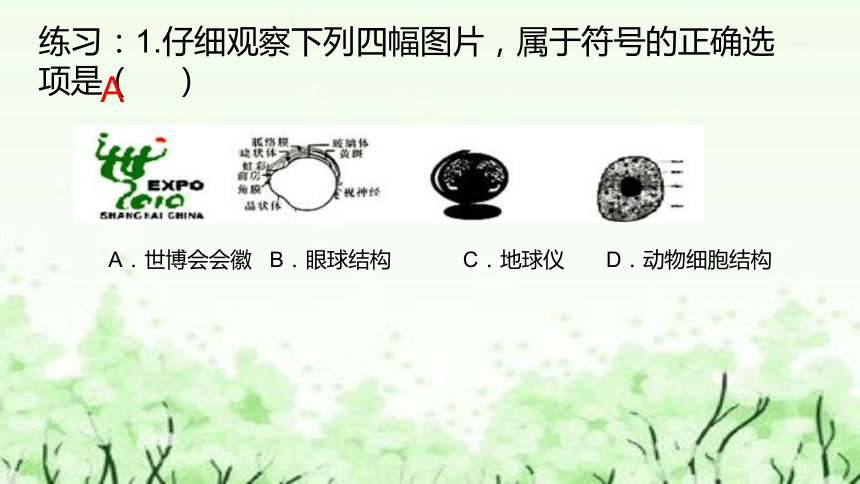
练习:1.仔细观察下列四幅图片,属于符号的正确选项是( )
A.世博会会徽 B.眼球结构 C.地球仪 D.动物细胞结构
A
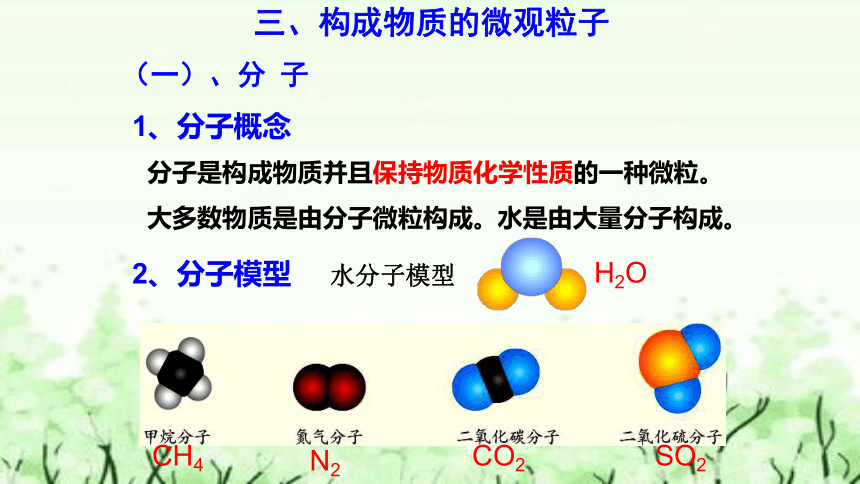
三、构成物质的微观粒子
(一)、分 子
分子是构成物质并且保持物质化学性质的一种微粒。
1、分子概念
2、分子模型
大多数物质是由分子微粒构成。
水分子模型
水是由大量分子构成。
CO2
N2
H2O
CH4
SO2
4、由分子构成的物质,分子是保持物质
化学性质的最小微粒。
3、在化学变化中,分子可再分,而原子
不能再分,即原子是化学变化中的最
小微粒。
1、分子是由原子构成的
2、化学变化的实质是分子分裂成原子,
原子重新组合构成新的分子
2.能保持氧气化学性质的微粒是( )
A.氧元素 B.氧原子 C.氧离子 D.氧分子
3. 表示氧原子,用“ ”表示氢原子,则保持水的化学性质的粒子是 ( )
A. B. C. D.
D
C
(二)、原子
1、原子概念
原子是化学变化中的最小微粒。
2、原子结构模型的发展史
①道尔顿原子模型(1803年)
实心球模型
②汤姆生原子模型(1904年)
③卢瑟福原子模型(1911年)
行星绕太阳模型
西瓜模型
④玻尔原子模型(1913年)
分层模型
⑤电子云模型(1927年—1935年)
电子云模型
4.发现原子中存在电子的科学家是( )
A. 卢瑟福 B. 汤姆森 C.波尔 D.牛顿
5.依据卢瑟福的原子行星模型理论,在原子中绕核高速旋转的是( )
A.核子 B.电子
C.质子 D.中子
B
B
3.粒子的大小与质量
分子和原子都有一定的质量和体积。
原子的体积很小,半径一般在10-10米数量级。
原子的质量也很小,一般在10-26千克数量级。
不同种类的原子质量不同,体积也不同。
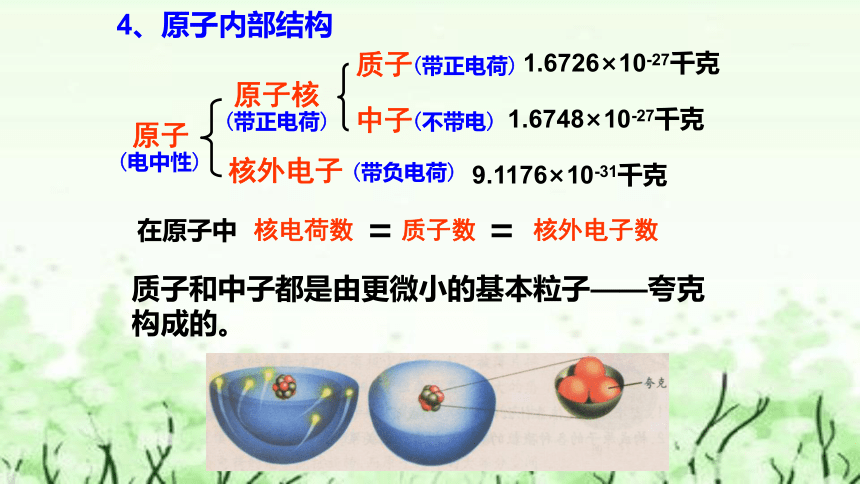
4、原子内部结构
原子
核外电子
原子核
中子
质子
(带正电荷)
(带正电荷)
(带负电荷)
(不带电)
(电中性)
1.6726×10-27千克
1.6748×10-27千克
9.1176×10-31千克
核电荷数
核外电子数
质子数
在原子中
=
=
质子和中子都是由更微小的基本粒子——夸克
构成的。
6.铁原子有26个质子,30个中子,其核外电子总数为 ( )
A.26 B.30
C.56 D.4
7.决定元素种类的是( )
A.质子数 B.中子数
C.电子数 D.中子数和核外电子数
8.1992年,我国科学家首次发现了汞元素的一种新原子,这种汞原子的相对原子质量为208,核电荷数为80,这种汞原子的核外电子数为( )
A.80 B.128 C.208 D.288
A
A
A
5、元素和同位素
1、元素的定义:具有相同核电荷数(即质子数)的同一类原子总称为元素。
2、同位素原子:
(1)概念:同类元素中质子数相同而中子数不相同的原子称为同位素原子.
(三)、离子
1、离子概念
把带电的原子(或原子团)叫离子。
2、离子分类
带负电的原子或原子团。
离子
阳离子:
阴离子:
带正电的原子或原子团。
例:钠离子 Na+
例:氯离子 Cl-
Cu2+
CO32-
象SO42-在化学反应里作为一个整体参加,好象一个原子一样,这样的原子集团叫原子团。
4、原子与离子的比较
原 子 离 子
概 念
带电的原子或原子团
化学变化中的最小微粒
区 别
不带电荷,呈电中性
带电荷,可分阳离子和阴离子
联 系
核电荷数相同的原子和离子属于同一种元素;离子和原子互相可以通过得失电子转化。
3、离子符号书写
元素符号
右 上 角
表示离子所带的电荷数
Ca2+中2表示钙离子带两个单位正电荷
OH-
SO42-
NO3-
CO32-
HCO3-
NH4+
核电荷数
核外电子数
质子数
在离子中
=
≠
四、组成物质的成分——元素
1、元素概念
把具有相同核电荷数(即质子数)的同一类原子总称为元素。
2、元素与原子的比较
元 素 原 子
概 念
区 别
范 围
具有相同核电荷数(质子数)的同一类原子的总称
化学变化中的最小微粒
只讲种类,不讲个数。
即讲种类,又讲个数。
描述物质的宏观组成
描述物质的微观结构
四、物质构成、组成、分类
原子
分子
物质
元素
构成
构
成
构
成
组成
同一类原子
得失电子
微观粒子(即讲种类、又讲个数)
宏观概念(只讲种类、不讲个数)
离子
得失电子
构
成
3、相互关系
4、元素分类
金属元素、
非金属元素:
(稀有元素)
5、元素分布
①地壳中元素:
Fe
Al
O
Si
②人体中元素:
O
C
H
③海水中元素:
O
H
Cl
Na
Mg
④有机物中元素:
O
C
H
5、元素符号
国际上统一采用的表示各种元素的符号。
①.定义
②.书写
A、通常用该元素拉丁文的第一个字母的大写来表示。
B、当两种元素的第一个字母相同时,可写上该元素
名称的第二个字母(小写)以示区别。
(1)表示一种元素(宏观)。
(2)表示这种元素的1个原子(微观)。
(3)由原子直接构成的物质,还可以表示这种物质
(宏观)。
③.意义
Cu
Ca
C
碳
钙
铜
例:铝 Al
①表示铝元素
②表示一个铝原子
③金属铝
元素名称 氢 氦 碳 氮 氧 氟 氖 钠
元素符号
元素名称 镁 铝 硅 磷 硫 氯 氩 钾
元素符号
元素名称 钙 锰 铁 铜 锌 银 碘 钡
元素符号
常见 的 元 素
H
He
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Mn
Fe
Cu
Zn
Ag
I
Ba
是科学家根据元素原子的核电荷数由小到大给元素所编的序列号。即:
原子序数=核电荷数=质子数
___个A族(主族)
___个B族(副族)
___个VIII族
___个0族
有 个横行(称为周期)
即:有____个周期
有 个纵列(称为族)
分为___大类
元素周期表
7
4
7
7
1
1
7
18
元素周期表
的结构特点:
1、元素按______________________顺序,
从左到右排列;
2、同周期,从左到右,由_____元素逐渐到
_______元素,最后是_________元素;
金属
非金属
稀有气体
核电荷数(质子数)由小到大
由此可推测:元素的性质等会发生____性变化。
周期
3、同主族元素,它们的化学性质很______。
相似
元素的排布规律:
9.图3是元素周期表中硫元素的信息示意图,对图中信息理解错误的是 ( )
A.原子序数 B.元素名称
C.元素符号 D.中子数
D
单质:由同种元素组成的纯净物
氧气
臭氧
氢气
化合物:由不同种元素组成的纯净物
水
双氧水
甲烷
甲烷
二氧化碳
一氧化碳
乙炔
(1)单质
金属单质
非金属单质
直接用
元素符
号表示
稀有气体
固态
(除碘外)
液态、气态:
多数为双原子分子,如:
氯气、氢气、氧气、氮气、溴 、碘 臭氧
Cl2 H2 O2 N2 Br2 I2 O3
五、写法:
练一练
根据以上规则写出下列物质的化学式:
氦气、氖气、氩气
氧气、氮气、液氯 氢气 溴 碘
臭氧
金属铝 金属铜 金刚石 红磷
He
Ne
Ar
O2
N2
Cl2
O3
Al
Cu
C
P
H2
I2
Br2
<1>先按照一定顺序写出组成化合物的所有元素符号
元素符号顺序
氧元素
另一元素
+
(氧在右)
氢元素
另一元素
+
(氢在左)
CH4 、NH3除外
非金属元素
金属元素
+
(金属元素在左)
如:一氧化碳 CO
如:水 H2O
如:氯化钾 KCl
如果是离子构成的化合物,其化学式用
离子最简整数比表示。如:氯化铜CuCl2
2、化合物化学式的写法
(二)、化合物化学式的写法
①排序:
排元素符号的顺序
左正右负
Al
O
Al
O
②标价:
③交叉约简:
标出元素的化合价
+3
-2
④检验:
元素化合价的代数和等于零
Al
O
+3
-2
3
2
(+3)
(- 2)
+
=
2
3
0
最简整数比
×
×
Al
O
3
2
一般从右到左读 “某化某” 或 “几某化几某”
读一读
SO2 SO3
CO2 CO
P2O5 Al2O3
H2O H2O2
一般从右到左读“某化某”或“几某化几某”
3、化学式读法:
二氧化硫
三氧化硫
二氧化碳
一氧化碳
五氧化二磷
三氧化二铝
水
过氧化氢
写出下列物质的化学式或名称。
物质名称 化学式 物质名称 化学式
五氧化二氮 四氯化碳
CuS 一氧化二氮
三氧化二铁
一氧化氮
硫化铜
N2O5
Fe2O3
NO
氯化银
氧化钙
CCl4
N2O
AgCl
CaO
4、化学式的意义
①.表示一种物质
②.表示该物质的元素组成
③.表示该物质的一个分子
④.表示该物质的一个分子构成
⑤.表示该物质的相对分子质量
例:化学式
CO2表示
什么意义?
10.下列同学对“SO2”的认识中,不正确的是 ( )
A. B. C. D.
B
六、化合价的含义
1、含义:各种元素在相互化合时,原子之间都有固定的化合数目,用化合价表示这种性质。
3、化合价的种类:有正价和负价之分。
2、化合价的表示方法:在元素符号正上方用带“+”“-”的小数字表示。
例:铁的化合价为+3价表示为 。
+3
Fe
常见元素化合价记忆口诀
钾钠银氢+1价,
氟氯溴碘-1价,
钙镁钡锌+2价,
通常氧硫-2价,
金属铝铁+3价,
氮磷最低-3价,
还有其他可变价。
化合价的一般规律
(1)单质里元素的化合价为 。
零
(2)、在任何化合物中所有元素化合价的代数和为零。
(3)常见的化合物中氢总是显 ____ 价, 氧总是显 ____ 价。
+1
-2
(4)金属元素常显 ____ 价。
正
(5)非金属元素跟氧化合时常显 ____ 价,
跟氢化合时常显 _____价。
正
负
注:不是一种物质,它不能独立存在
(2)常见的原子团和化合价
OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
PO4 磷酸根 NH4 铵根
-1
-1
-2
-3
-2
+1
6、原子团 (1)含义:由多个原子构成,在化学反应中作为一个整体的集团
看图:探究原子团的化合价有什么规律?
原子团 离子符号 电荷 化合价
氢氧根 OH- -1 -1
硝酸根 NO3- -1
碳酸氢根 HCO3- -1
铵根 NH4+ +1
硫酸根 SO42- -2
碳酸根 CO32- -2
亚硫酸根 SO32- -2
磷酸根 PO43- -3
-1
-1
+1
-2
-2
-2
-3
11.食品添加剂溴酸钾(KBrO3)会致癌,其中溴元素(Br)的化合价为 ( )
A.+1 B.+3 C.+5 D.无法确定
12.硒是抗衰老元素,且能抑制癌细胞生长。“北大富硒康”中含有硒酸根离子(SeO42-)则在硒酸根离子中硒元素的化合价为 ( )
A、―2价 B、―4价 C、+4价 D、+6价
C
D
六、元素符号周围数字的意义
数字位置 数字的意义 实际例子
元素符号
前 面
元素符号
右 下 角
元素符号
右 上 角
元素符号
上 方
表示单独的微粒的个数
2H表示2个氢原子
表示每个分子(原子团)中某原子的个数
H2中2表示一个氢分子由2个氢原子构成
表示离子所带的电荷数
Ca2+中2表示钙离子带两个单位正电荷
表示元素的化合价
+2 -2
CaO
表示钙元素的化合价为+2价
13. 2N Fe 5P K 3Ca表示什么意义?
这些符号中,哪几个只表示微粒意义,
不表示宏观意义?
答: 2N表示________;Fe表示___________
5P表示 ________; K表示____________
3Ca表示________;
14.用符号与数字表达含义:
5个铝原子________; 1个氧原子_________;
氧元素___________; 3个银原子_________;
4个氟原子________; 金属钡___________.
氩气____________; 氯气_____________.
练习:
Ba
2个氮原子
铁元素或一个铁原子
5个磷原子
钾元素或一个钾原子或钾这种物质。
3个钙原子
5Al
O
O
3Ag
4F
Ar
Cl2
①“2” ,
②“3” ,
③“4” ,
④“5” ,
一个碳酸根离子带两个单位的负电荷
一个碳酸根离子中有三个氧原子
碳酸根中碳元素的化合价为+4价
5个碳酸根离子
17.符号5CO32- 中各数字表示的意义?
+4
16、下列化学符号正确的是( )
A.1个——氧化碳分子:Co B.2个碳酸根离子:2CO32-
C.3个亚铁离子:3Fe3+ D.4个氢原子:2H2
B
18.指出下列符号中“2”表示的意义
2SO3
MgO
+2
3SO4
2-
七、如何求相对原子质量?
1、定义:某原子的质量与碳原子的1/12进行比较,所得比值就是相对原子质量。
相对原子质量
=
某原子的质量
一个碳12原子的质量
×12
19.若碳原子的质量为a克,A原子的质量为b克,则A原子的相对原子质量为( )
A. B. C. D.
A
4、计算物质中某一元素的质量分数。
根据化学式计算
3、计算组成物质的各元素的质量比
1、计算相对分子质量
例:化合物AxBy,
A的相对原子质量为a,
B的相对原子质量为b
2、计算分子中各原子的个数比
AxBy相对分子质量=A相对原子质量×A原子个数+B相对原子质量×B原子个数=a×x+b×y
A、B原子个数比=x:y
A % =——— ———
xa
ax+by
xA
AxBy
×100%=
×100%
m元素 =m物质 ×元素%
A:B=(A原子的相对原子质量× A原子个数): (B原子的相对原子质量×B原子个数)=ax:by
20.苹果中富含苹果酸,具有增强消化,降低有害胆固醇等作用,苹果酸的分子式为C?H?O?,请计算:
(1)苹果酸的相对分子质量是_______;
(2)苹果酸中碳、氢、氧三种元素的质量比是_______;(最简整数比)
(3)13.4 g苹果酸中含C元素质量多少克?(写出计算过程,答案精确到0.1 g)
134
24:3:40
苹果酸中碳元素的质量分数为×100%,则13.4g苹果酸中含C元素的质量为13.4 g×(×100%)=4.8 g。
21.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟疾药物之一。回答下列问题:
(1)一个青蒿素分子中含有__________个原子。
(2)青蒿素中的氢元素与氧元素的质量比是_______________。
(3)14.1克青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
42
11:40
(3)解:设需要磺胺的质量为x,
解得:x=21.5g
第二章 微粒的模型和符号
一、模型与符号
1、模型
(1)模型的作用:
模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
(2)模型类型:
1、物体放大或缩小的复制品(地球仪、细胞模型)
2、一幅图、一张表、一个计算机图像、一条曲线
3、表示一个复杂的过程(水的三态变化模型、化学反应模型)
4、数学公式
分析电流表符号可以得出结论:
2、用符号可避免由于事物外形不同而引起的混乱。
分析时间符号可以得出结论:
3、用符号可以避免由于表达事物的文字语言不同而引起的混乱。
二、符号
练习:1.仔细观察下列四幅图片,属于符号的正确选项是( )
A.世博会会徽 B.眼球结构 C.地球仪 D.动物细胞结构
A
三、构成物质的微观粒子
(一)、分 子
分子是构成物质并且保持物质化学性质的一种微粒。
1、分子概念
2、分子模型
大多数物质是由分子微粒构成。
水分子模型
水是由大量分子构成。
CO2
N2
H2O
CH4
SO2
4、由分子构成的物质,分子是保持物质
化学性质的最小微粒。
3、在化学变化中,分子可再分,而原子
不能再分,即原子是化学变化中的最
小微粒。
1、分子是由原子构成的
2、化学变化的实质是分子分裂成原子,
原子重新组合构成新的分子
2.能保持氧气化学性质的微粒是( )
A.氧元素 B.氧原子 C.氧离子 D.氧分子
3. 表示氧原子,用“ ”表示氢原子,则保持水的化学性质的粒子是 ( )
A. B. C. D.
D
C
(二)、原子
1、原子概念
原子是化学变化中的最小微粒。
2、原子结构模型的发展史
①道尔顿原子模型(1803年)
实心球模型
②汤姆生原子模型(1904年)
③卢瑟福原子模型(1911年)
行星绕太阳模型
西瓜模型
④玻尔原子模型(1913年)
分层模型
⑤电子云模型(1927年—1935年)
电子云模型
4.发现原子中存在电子的科学家是( )
A. 卢瑟福 B. 汤姆森 C.波尔 D.牛顿
5.依据卢瑟福的原子行星模型理论,在原子中绕核高速旋转的是( )
A.核子 B.电子
C.质子 D.中子
B
B
3.粒子的大小与质量
分子和原子都有一定的质量和体积。
原子的体积很小,半径一般在10-10米数量级。
原子的质量也很小,一般在10-26千克数量级。
不同种类的原子质量不同,体积也不同。
4、原子内部结构
原子
核外电子
原子核
中子
质子
(带正电荷)
(带正电荷)
(带负电荷)
(不带电)
(电中性)
1.6726×10-27千克
1.6748×10-27千克
9.1176×10-31千克
核电荷数
核外电子数
质子数
在原子中
=
=
质子和中子都是由更微小的基本粒子——夸克
构成的。
6.铁原子有26个质子,30个中子,其核外电子总数为 ( )
A.26 B.30
C.56 D.4
7.决定元素种类的是( )
A.质子数 B.中子数
C.电子数 D.中子数和核外电子数
8.1992年,我国科学家首次发现了汞元素的一种新原子,这种汞原子的相对原子质量为208,核电荷数为80,这种汞原子的核外电子数为( )
A.80 B.128 C.208 D.288
A
A
A
5、元素和同位素
1、元素的定义:具有相同核电荷数(即质子数)的同一类原子总称为元素。
2、同位素原子:
(1)概念:同类元素中质子数相同而中子数不相同的原子称为同位素原子.
(三)、离子
1、离子概念
把带电的原子(或原子团)叫离子。
2、离子分类
带负电的原子或原子团。
离子
阳离子:
阴离子:
带正电的原子或原子团。
例:钠离子 Na+
例:氯离子 Cl-
Cu2+
CO32-
象SO42-在化学反应里作为一个整体参加,好象一个原子一样,这样的原子集团叫原子团。
4、原子与离子的比较
原 子 离 子
概 念
带电的原子或原子团
化学变化中的最小微粒
区 别
不带电荷,呈电中性
带电荷,可分阳离子和阴离子
联 系
核电荷数相同的原子和离子属于同一种元素;离子和原子互相可以通过得失电子转化。
3、离子符号书写
元素符号
右 上 角
表示离子所带的电荷数
Ca2+中2表示钙离子带两个单位正电荷
OH-
SO42-
NO3-
CO32-
HCO3-
NH4+
核电荷数
核外电子数
质子数
在离子中
=
≠
四、组成物质的成分——元素
1、元素概念
把具有相同核电荷数(即质子数)的同一类原子总称为元素。
2、元素与原子的比较
元 素 原 子
概 念
区 别
范 围
具有相同核电荷数(质子数)的同一类原子的总称
化学变化中的最小微粒
只讲种类,不讲个数。
即讲种类,又讲个数。
描述物质的宏观组成
描述物质的微观结构
四、物质构成、组成、分类
原子
分子
物质
元素
构成
构
成
构
成
组成
同一类原子
得失电子
微观粒子(即讲种类、又讲个数)
宏观概念(只讲种类、不讲个数)
离子
得失电子
构
成
3、相互关系
4、元素分类
金属元素、
非金属元素:
(稀有元素)
5、元素分布
①地壳中元素:
Fe
Al
O
Si
②人体中元素:
O
C
H
③海水中元素:
O
H
Cl
Na
Mg
④有机物中元素:
O
C
H
5、元素符号
国际上统一采用的表示各种元素的符号。
①.定义
②.书写
A、通常用该元素拉丁文的第一个字母的大写来表示。
B、当两种元素的第一个字母相同时,可写上该元素
名称的第二个字母(小写)以示区别。
(1)表示一种元素(宏观)。
(2)表示这种元素的1个原子(微观)。
(3)由原子直接构成的物质,还可以表示这种物质
(宏观)。
③.意义
Cu
Ca
C
碳
钙
铜
例:铝 Al
①表示铝元素
②表示一个铝原子
③金属铝
元素名称 氢 氦 碳 氮 氧 氟 氖 钠
元素符号
元素名称 镁 铝 硅 磷 硫 氯 氩 钾
元素符号
元素名称 钙 锰 铁 铜 锌 银 碘 钡
元素符号
常见 的 元 素
H
He
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Mn
Fe
Cu
Zn
Ag
I
Ba
是科学家根据元素原子的核电荷数由小到大给元素所编的序列号。即:
原子序数=核电荷数=质子数
___个A族(主族)
___个B族(副族)
___个VIII族
___个0族
有 个横行(称为周期)
即:有____个周期
有 个纵列(称为族)
分为___大类
元素周期表
7
4
7
7
1
1
7
18
元素周期表
的结构特点:
1、元素按______________________顺序,
从左到右排列;
2、同周期,从左到右,由_____元素逐渐到
_______元素,最后是_________元素;
金属
非金属
稀有气体
核电荷数(质子数)由小到大
由此可推测:元素的性质等会发生____性变化。
周期
3、同主族元素,它们的化学性质很______。
相似
元素的排布规律:
9.图3是元素周期表中硫元素的信息示意图,对图中信息理解错误的是 ( )
A.原子序数 B.元素名称
C.元素符号 D.中子数
D
单质:由同种元素组成的纯净物
氧气
臭氧
氢气
化合物:由不同种元素组成的纯净物
水
双氧水
甲烷
甲烷
二氧化碳
一氧化碳
乙炔
(1)单质
金属单质
非金属单质
直接用
元素符
号表示
稀有气体
固态
(除碘外)
液态、气态:
多数为双原子分子,如:
氯气、氢气、氧气、氮气、溴 、碘 臭氧
Cl2 H2 O2 N2 Br2 I2 O3
五、写法:
练一练
根据以上规则写出下列物质的化学式:
氦气、氖气、氩气
氧气、氮气、液氯 氢气 溴 碘
臭氧
金属铝 金属铜 金刚石 红磷
He
Ne
Ar
O2
N2
Cl2
O3
Al
Cu
C
P
H2
I2
Br2
<1>先按照一定顺序写出组成化合物的所有元素符号
元素符号顺序
氧元素
另一元素
+
(氧在右)
氢元素
另一元素
+
(氢在左)
CH4 、NH3除外
非金属元素
金属元素
+
(金属元素在左)
如:一氧化碳 CO
如:水 H2O
如:氯化钾 KCl
如果是离子构成的化合物,其化学式用
离子最简整数比表示。如:氯化铜CuCl2
2、化合物化学式的写法
(二)、化合物化学式的写法
①排序:
排元素符号的顺序
左正右负
Al
O
Al
O
②标价:
③交叉约简:
标出元素的化合价
+3
-2
④检验:
元素化合价的代数和等于零
Al
O
+3
-2
3
2
(+3)
(- 2)
+
=
2
3
0
最简整数比
×
×
Al
O
3
2
一般从右到左读 “某化某” 或 “几某化几某”
读一读
SO2 SO3
CO2 CO
P2O5 Al2O3
H2O H2O2
一般从右到左读“某化某”或“几某化几某”
3、化学式读法:
二氧化硫
三氧化硫
二氧化碳
一氧化碳
五氧化二磷
三氧化二铝
水
过氧化氢
写出下列物质的化学式或名称。
物质名称 化学式 物质名称 化学式
五氧化二氮 四氯化碳
CuS 一氧化二氮
三氧化二铁
一氧化氮
硫化铜
N2O5
Fe2O3
NO
氯化银
氧化钙
CCl4
N2O
AgCl
CaO
4、化学式的意义
①.表示一种物质
②.表示该物质的元素组成
③.表示该物质的一个分子
④.表示该物质的一个分子构成
⑤.表示该物质的相对分子质量
例:化学式
CO2表示
什么意义?
10.下列同学对“SO2”的认识中,不正确的是 ( )
A. B. C. D.
B
六、化合价的含义
1、含义:各种元素在相互化合时,原子之间都有固定的化合数目,用化合价表示这种性质。
3、化合价的种类:有正价和负价之分。
2、化合价的表示方法:在元素符号正上方用带“+”“-”的小数字表示。
例:铁的化合价为+3价表示为 。
+3
Fe
常见元素化合价记忆口诀
钾钠银氢+1价,
氟氯溴碘-1价,
钙镁钡锌+2价,
通常氧硫-2价,
金属铝铁+3价,
氮磷最低-3价,
还有其他可变价。
化合价的一般规律
(1)单质里元素的化合价为 。
零
(2)、在任何化合物中所有元素化合价的代数和为零。
(3)常见的化合物中氢总是显 ____ 价, 氧总是显 ____ 价。
+1
-2
(4)金属元素常显 ____ 价。
正
(5)非金属元素跟氧化合时常显 ____ 价,
跟氢化合时常显 _____价。
正
负
注:不是一种物质,它不能独立存在
(2)常见的原子团和化合价
OH 氢氧根 NO3 硝酸根
CO3 碳酸根 SO4 硫酸根
PO4 磷酸根 NH4 铵根
-1
-1
-2
-3
-2
+1
6、原子团 (1)含义:由多个原子构成,在化学反应中作为一个整体的集团
看图:探究原子团的化合价有什么规律?
原子团 离子符号 电荷 化合价
氢氧根 OH- -1 -1
硝酸根 NO3- -1
碳酸氢根 HCO3- -1
铵根 NH4+ +1
硫酸根 SO42- -2
碳酸根 CO32- -2
亚硫酸根 SO32- -2
磷酸根 PO43- -3
-1
-1
+1
-2
-2
-2
-3
11.食品添加剂溴酸钾(KBrO3)会致癌,其中溴元素(Br)的化合价为 ( )
A.+1 B.+3 C.+5 D.无法确定
12.硒是抗衰老元素,且能抑制癌细胞生长。“北大富硒康”中含有硒酸根离子(SeO42-)则在硒酸根离子中硒元素的化合价为 ( )
A、―2价 B、―4价 C、+4价 D、+6价
C
D
六、元素符号周围数字的意义
数字位置 数字的意义 实际例子
元素符号
前 面
元素符号
右 下 角
元素符号
右 上 角
元素符号
上 方
表示单独的微粒的个数
2H表示2个氢原子
表示每个分子(原子团)中某原子的个数
H2中2表示一个氢分子由2个氢原子构成
表示离子所带的电荷数
Ca2+中2表示钙离子带两个单位正电荷
表示元素的化合价
+2 -2
CaO
表示钙元素的化合价为+2价
13. 2N Fe 5P K 3Ca表示什么意义?
这些符号中,哪几个只表示微粒意义,
不表示宏观意义?
答: 2N表示________;Fe表示___________
5P表示 ________; K表示____________
3Ca表示________;
14.用符号与数字表达含义:
5个铝原子________; 1个氧原子_________;
氧元素___________; 3个银原子_________;
4个氟原子________; 金属钡___________.
氩气____________; 氯气_____________.
练习:
Ba
2个氮原子
铁元素或一个铁原子
5个磷原子
钾元素或一个钾原子或钾这种物质。
3个钙原子
5Al
O
O
3Ag
4F
Ar
Cl2
①“2” ,
②“3” ,
③“4” ,
④“5” ,
一个碳酸根离子带两个单位的负电荷
一个碳酸根离子中有三个氧原子
碳酸根中碳元素的化合价为+4价
5个碳酸根离子
17.符号5CO32- 中各数字表示的意义?
+4
16、下列化学符号正确的是( )
A.1个——氧化碳分子:Co B.2个碳酸根离子:2CO32-
C.3个亚铁离子:3Fe3+ D.4个氢原子:2H2
B
18.指出下列符号中“2”表示的意义
2SO3
MgO
+2
3SO4
2-
七、如何求相对原子质量?
1、定义:某原子的质量与碳原子的1/12进行比较,所得比值就是相对原子质量。
相对原子质量
=
某原子的质量
一个碳12原子的质量
×12
19.若碳原子的质量为a克,A原子的质量为b克,则A原子的相对原子质量为( )
A. B. C. D.
A
4、计算物质中某一元素的质量分数。
根据化学式计算
3、计算组成物质的各元素的质量比
1、计算相对分子质量
例:化合物AxBy,
A的相对原子质量为a,
B的相对原子质量为b
2、计算分子中各原子的个数比
AxBy相对分子质量=A相对原子质量×A原子个数+B相对原子质量×B原子个数=a×x+b×y
A、B原子个数比=x:y
A % =——— ———
xa
ax+by
xA
AxBy
×100%=
×100%
m元素 =m物质 ×元素%
A:B=(A原子的相对原子质量× A原子个数): (B原子的相对原子质量×B原子个数)=ax:by
20.苹果中富含苹果酸,具有增强消化,降低有害胆固醇等作用,苹果酸的分子式为C?H?O?,请计算:
(1)苹果酸的相对分子质量是_______;
(2)苹果酸中碳、氢、氧三种元素的质量比是_______;(最简整数比)
(3)13.4 g苹果酸中含C元素质量多少克?(写出计算过程,答案精确到0.1 g)
134
24:3:40
苹果酸中碳元素的质量分数为×100%,则13.4g苹果酸中含C元素的质量为13.4 g×(×100%)=4.8 g。
21.我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟疾药物之一。回答下列问题:
(1)一个青蒿素分子中含有__________个原子。
(2)青蒿素中的氢元素与氧元素的质量比是_______________。
(3)14.1克青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
42
11:40
(3)解:设需要磺胺的质量为x,
解得:x=21.5g
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
