鲁科版化学必修二1.2《元素周期律和元素周期表》课件 (共58张PPT)
文档属性
| 名称 | 鲁科版化学必修二1.2《元素周期律和元素周期表》课件 (共58张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-30 09:20:36 | ||
图片预览









文档简介
(共58张PPT)
第一章 第二节
元素周期律和元素周期表(1)
高一年级 化学
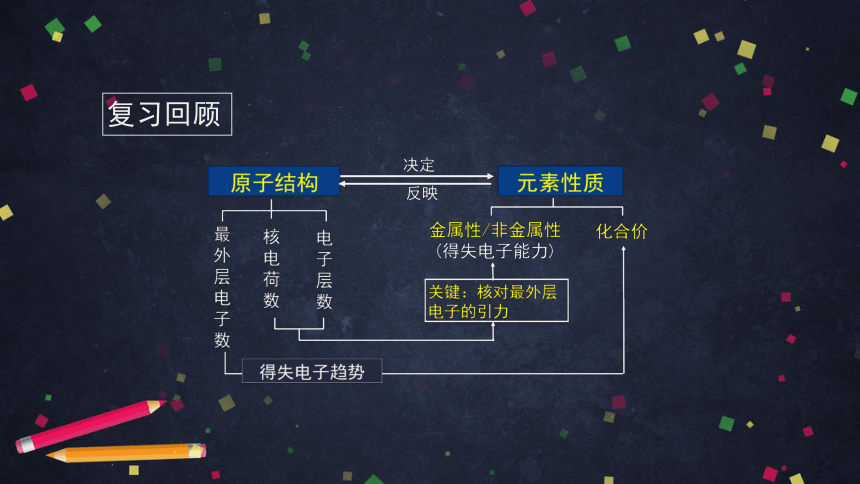
复习回顾
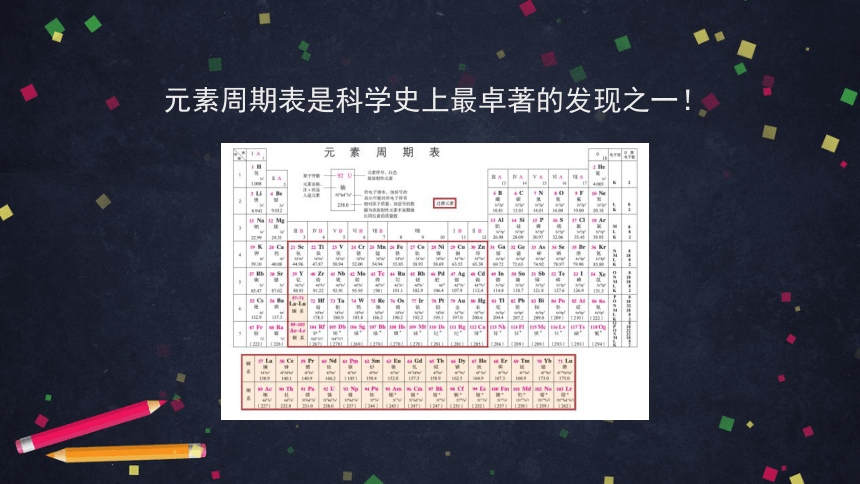
元素周期表是科学史上最卓著的发现之一!
2019年元素周期表诞生150周年——“国际化学元素周期表年”
为什么说“元素周期表是科学史上最卓著的发现之一”?118种元素排列的依据是什么?元素周期表中蕴含着哪些奥秘?
联想质疑
核心任务——探寻不同元素之间的内在联系和变化规律
元素周期律
元素周期律初探
任务:寻找零散的元素信息之间的变化规律?
元素周期律初探
任务:寻找零散的元素信息之间的关联和变化规律
大多同学思路:按初中学过的顺序进行排序
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
发现:核电荷数、相对原子质量递增
课前探索:教材第11页【活动?探究】
请大家打开教材到11页,展示你课前进行数据处理的结果。
1. 变量太多,不知如何确定自变量
处理表格数据时学生困惑
核电荷数
电子层数
最外层电子数
相对原子质量
原子半径
最高化合价
最低化合价
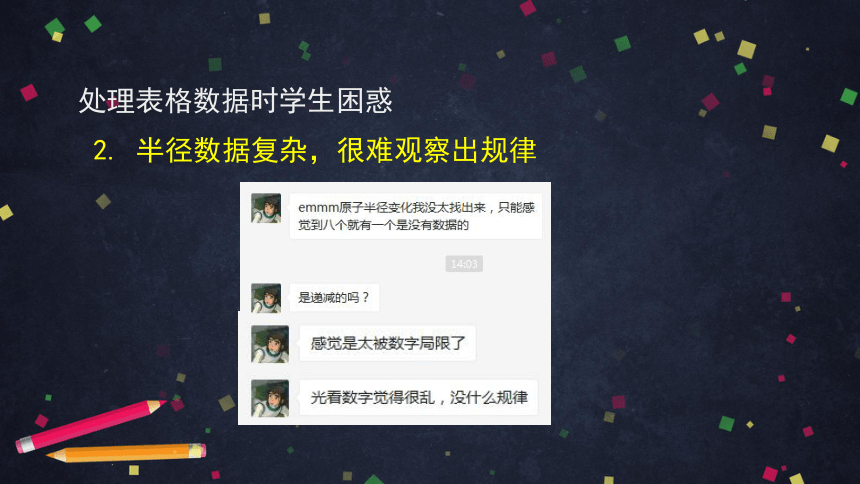
2. 半径数据复杂,很难观察出规律
处理表格数据时学生困惑
举例:随着温度的升高,KNO3的溶解度增大。
方法导引:规律——自变量和因变量的关系
自变量
因变量
方法导引:如何梳理变量关系发现规律?
确定自变量
选取因变量,寻找自变量和因变量的关系
描述
变化规律
发现、表达变化关系
(柱状图、折线图等)
数学中研究函数的思路
评价典型数据分析图
甲同学数据处理:
点评:电子层数并不是引起最外层电子数变化的自变量!
不可盲目寻找变量关系!要关注自变量应是引起因变量发生变化的最根本的量。
乙同学数据处理:
点评:电子层数与原子半径存在关联,但同一自变量下对应多个不同的因变量,说明还有其他因素在影响原子半径,电子层数不是最根本的自变量。
丙同学数据处理:
点评:体现了随着元素种类的变化最外层电子呈现规律性变化
困惑:
横坐标对应的自变量到底是什么?
丙同学数据处理:
周期性变化
核电荷数?
相对原子质量?
寻找自变量
依据:自变量是引起其他量发生变化的最根本的量
寻找自变量
元素的相对
原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的含量的乘积之和
核素的种类
质子数、中子数
核素的含量
原子序数=核电荷数
寻找自变量
核电荷数(质子数)决定元素种类
总结:寻找元素性质变化规律中自变量的方法
自变量是引起其他量发生变化的最根本的量
基于结构决定性质,自变量应为结构变量
以核电荷数为自变量,最外层电子数、化合价、原子半径为因变量
描述规律——最外层电子数变化规律
规律:随着原子序数的递增,原子最外层电子数从1→8周期性变化(1、2号元素除外)。
描述规律——主要化合价(最高价、最低价)变化规律
规律:随着原子序数的递增,元素的最高化合价呈现+1→+7(O、F除外)的周期性变化。
元素的最低化合价呈现从-4→-1的周期性变化。
描述规律——原子半径变化规律
规律:随着原子序数的递增,原子半径由大到小周期性变化 (稀有气体元素原子除外)。
元素周期律
元素的性质随着元素原子序数的递增呈现周期性变化。
周期性的直观表达
周期性排布
周期函数
思考:如何排列这些元素来体现最外层电子排布周期性变化规律?
在排列之中体现最外层电子排布周期性变化规律
思考:如何排列这些元素来体现常见化合价周期性变化规律?
在排列之中体现主要化合价
周期性变化规律
He元素位置
更能体现性质的变化规律
思考:如何排列这些元素来体现原子半径的周期性变化规律?
在排列之中体现原子半径周期性变化规律
在排列中体现周期性变化规律
最外层电子数、原子半径、化合价的周期性变化规律
排布规则
电子层数相同的元素放在同一横行——周期
最外层电子数相同的元素放在同一纵列——族
原子结构角度论证元素周期律
原子结构角度论证元素周期律
质子数
(核电荷数)
核外
电子数
最外层电子
周期性排布
化合价
周期性变化
=
增大
原子半径
电子层数
核电荷数
原子结构角度论证原子半径的周期性变化规律
电子层数相同时,核电荷数越大,原子核对最外层电子的引力越大,原子半径越小。
原子结构角度论证原子半径的周期性变化规律
最外层电子数相同时,电子层数越多,最外层电子离原子核越远,原子半径越大。
原子结构角度论证原子半径的周期性变化规律
原子半径
电子层数
核电荷数
元素原子得失电子能力
发现关联
元素原子得失电子能力是否也存在周期性变化规律呢?
电子层数相同时,核电荷数越大,原子核对最外层电子的引力越大,得电子能力越强,失电子能力越弱。
当最外层电子数相同时,电子层数越多,最外层电子离原子核越远,原子核对最外层电子的引力越小,得电子能力越弱,失电子能力越强。
原子结构角度发现得失电子能力的周期性变化规律
发现规律
元素原子得电子能力从弱→强呈现周期性变化
元素原子失电子能力从强→弱呈现周期性变化
在排列中体现周期性规律
原子核外电子排布周期性变化
原子半径、化合价、得失电子能力的周期性变化
背景:
原子是不可再分的实心球体;
相对原子质量是认识原子结构的唯一数据。
与历史对话:门捷列夫的周期表
与历史对话:门捷列夫的伟大——空位
预言未知元素
现代元素周期表
“元素周期表是科学史上最卓著的发现之一”
原子结构
元素性质
原子核
核外电子
电子层数
最外层电子数
质子
中子
化合价
原子半径
元素在周期表中的位置
原子序数
周期
族
核电荷数
得失电子能力
描述规律
论证规律
寻找
自变量
发现规律
模型化
表达规律
随着原子序数的递增,最外层电子数、化合价、原子半径呈现周期性变化规律
自变量是引起其他量发生变化的最根本的量
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
A.0.080nm B. 0.106nm
C.0.120nm D. 0.070nm
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
最外层电子数相同,电子层数:N < P
原子半径:N < P P原子半径 > 0.075nm
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
电子层数相同,核电荷数:Si < P原子核对最外层电子的引力:Si < P 原子半径:Si > P > S
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
根据以上数据,推测P原子的半径可能是( )
A.0.080nm B. 0.106nm
C.0.120nm D. 0.070nm
B
综合考虑:P原子半径0.102nm ~ 0.111nm
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
+1 +2 +3
电子层数相同,核电荷数减小,原子核对最外层电子的引力减小,原子半径增大
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
O、F没有最高正价
电子层数相同,核电荷数增大,原子核对最外层电子的引力增大,原子半径减小
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
稀有气体的半径测量标准特殊,不具有可比性
稀有气体稳定,通常为0价
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Si、P、Cl
+4 +5 +7
电子层数相同,核电荷数增大,原子核对最外层电子的引力增大,原子半径减小
A
第一章 第二节
元素周期律和元素周期表(1)
高一年级 化学
复习回顾
元素周期表是科学史上最卓著的发现之一!
2019年元素周期表诞生150周年——“国际化学元素周期表年”
为什么说“元素周期表是科学史上最卓著的发现之一”?118种元素排列的依据是什么?元素周期表中蕴含着哪些奥秘?
联想质疑
核心任务——探寻不同元素之间的内在联系和变化规律
元素周期律
元素周期律初探
任务:寻找零散的元素信息之间的变化规律?
元素周期律初探
任务:寻找零散的元素信息之间的关联和变化规律
大多同学思路:按初中学过的顺序进行排序
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
发现:核电荷数、相对原子质量递增
课前探索:教材第11页【活动?探究】
请大家打开教材到11页,展示你课前进行数据处理的结果。
1. 变量太多,不知如何确定自变量
处理表格数据时学生困惑
核电荷数
电子层数
最外层电子数
相对原子质量
原子半径
最高化合价
最低化合价
2. 半径数据复杂,很难观察出规律
处理表格数据时学生困惑
举例:随着温度的升高,KNO3的溶解度增大。
方法导引:规律——自变量和因变量的关系
自变量
因变量
方法导引:如何梳理变量关系发现规律?
确定自变量
选取因变量,寻找自变量和因变量的关系
描述
变化规律
发现、表达变化关系
(柱状图、折线图等)
数学中研究函数的思路
评价典型数据分析图
甲同学数据处理:
点评:电子层数并不是引起最外层电子数变化的自变量!
不可盲目寻找变量关系!要关注自变量应是引起因变量发生变化的最根本的量。
乙同学数据处理:
点评:电子层数与原子半径存在关联,但同一自变量下对应多个不同的因变量,说明还有其他因素在影响原子半径,电子层数不是最根本的自变量。
丙同学数据处理:
点评:体现了随着元素种类的变化最外层电子呈现规律性变化
困惑:
横坐标对应的自变量到底是什么?
丙同学数据处理:
周期性变化
核电荷数?
相对原子质量?
寻找自变量
依据:自变量是引起其他量发生变化的最根本的量
寻找自变量
元素的相对
原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的含量的乘积之和
核素的种类
质子数、中子数
核素的含量
原子序数=核电荷数
寻找自变量
核电荷数(质子数)决定元素种类
总结:寻找元素性质变化规律中自变量的方法
自变量是引起其他量发生变化的最根本的量
基于结构决定性质,自变量应为结构变量
以核电荷数为自变量,最外层电子数、化合价、原子半径为因变量
描述规律——最外层电子数变化规律
规律:随着原子序数的递增,原子最外层电子数从1→8周期性变化(1、2号元素除外)。
描述规律——主要化合价(最高价、最低价)变化规律
规律:随着原子序数的递增,元素的最高化合价呈现+1→+7(O、F除外)的周期性变化。
元素的最低化合价呈现从-4→-1的周期性变化。
描述规律——原子半径变化规律
规律:随着原子序数的递增,原子半径由大到小周期性变化 (稀有气体元素原子除外)。
元素周期律
元素的性质随着元素原子序数的递增呈现周期性变化。
周期性的直观表达
周期性排布
周期函数
思考:如何排列这些元素来体现最外层电子排布周期性变化规律?
在排列之中体现最外层电子排布周期性变化规律
思考:如何排列这些元素来体现常见化合价周期性变化规律?
在排列之中体现主要化合价
周期性变化规律
He元素位置
更能体现性质的变化规律
思考:如何排列这些元素来体现原子半径的周期性变化规律?
在排列之中体现原子半径周期性变化规律
在排列中体现周期性变化规律
最外层电子数、原子半径、化合价的周期性变化规律
排布规则
电子层数相同的元素放在同一横行——周期
最外层电子数相同的元素放在同一纵列——族
原子结构角度论证元素周期律
原子结构角度论证元素周期律
质子数
(核电荷数)
核外
电子数
最外层电子
周期性排布
化合价
周期性变化
=
增大
原子半径
电子层数
核电荷数
原子结构角度论证原子半径的周期性变化规律
电子层数相同时,核电荷数越大,原子核对最外层电子的引力越大,原子半径越小。
原子结构角度论证原子半径的周期性变化规律
最外层电子数相同时,电子层数越多,最外层电子离原子核越远,原子半径越大。
原子结构角度论证原子半径的周期性变化规律
原子半径
电子层数
核电荷数
元素原子得失电子能力
发现关联
元素原子得失电子能力是否也存在周期性变化规律呢?
电子层数相同时,核电荷数越大,原子核对最外层电子的引力越大,得电子能力越强,失电子能力越弱。
当最外层电子数相同时,电子层数越多,最外层电子离原子核越远,原子核对最外层电子的引力越小,得电子能力越弱,失电子能力越强。
原子结构角度发现得失电子能力的周期性变化规律
发现规律
元素原子得电子能力从弱→强呈现周期性变化
元素原子失电子能力从强→弱呈现周期性变化
在排列中体现周期性规律
原子核外电子排布周期性变化
原子半径、化合价、得失电子能力的周期性变化
背景:
原子是不可再分的实心球体;
相对原子质量是认识原子结构的唯一数据。
与历史对话:门捷列夫的周期表
与历史对话:门捷列夫的伟大——空位
预言未知元素
现代元素周期表
“元素周期表是科学史上最卓著的发现之一”
原子结构
元素性质
原子核
核外电子
电子层数
最外层电子数
质子
中子
化合价
原子半径
元素在周期表中的位置
原子序数
周期
族
核电荷数
得失电子能力
描述规律
论证规律
寻找
自变量
发现规律
模型化
表达规律
随着原子序数的递增,最外层电子数、化合价、原子半径呈现周期性变化规律
自变量是引起其他量发生变化的最根本的量
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
A.0.080nm B. 0.106nm
C.0.120nm D. 0.070nm
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
最外层电子数相同,电子层数:N < P
原子半径:N < P P原子半径 > 0.075nm
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
根据以上数据,推测P原子的半径可能是( )
电子层数相同,核电荷数:Si < P
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
例题:已知下列元素的原子半径:
元素 N S O Si
原子半径(nm) 0.075 0.102 0.073 0.111
根据以上数据,推测P原子的半径可能是( )
A.0.080nm B. 0.106nm
C.0.120nm D. 0.070nm
B
综合考虑:P原子半径0.102nm ~ 0.111nm
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
+1 +2 +3
电子层数相同,核电荷数减小,原子核对最外层电子的引力减小,原子半径增大
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
O、F没有最高正价
电子层数相同,核电荷数增大,原子核对最外层电子的引力增大,原子半径减小
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Cl、P、Si
稀有气体的半径测量标准特殊,不具有可比性
稀有气体稳定,通常为0价
A
例题:下列各组元素,原子半径依次增大,最高正价依次降低的是( )
A.Al、Mg、Na B. N、O、F
C.Ar、Cl、S D. Si、P、Cl
+4 +5 +7
电子层数相同,核电荷数增大,原子核对最外层电子的引力增大,原子半径减小
A
