鲁科版化学高一必修二第一章第二节元素周期律和元素周期表课件(38张ppt)
文档属性
| 名称 | 鲁科版化学高一必修二第一章第二节元素周期律和元素周期表课件(38张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-04 00:00:00 | ||
图片预览






文档简介
(共38张PPT)
第一章 第二节
元素周期律和元素周期表(2)
高一年级 化学
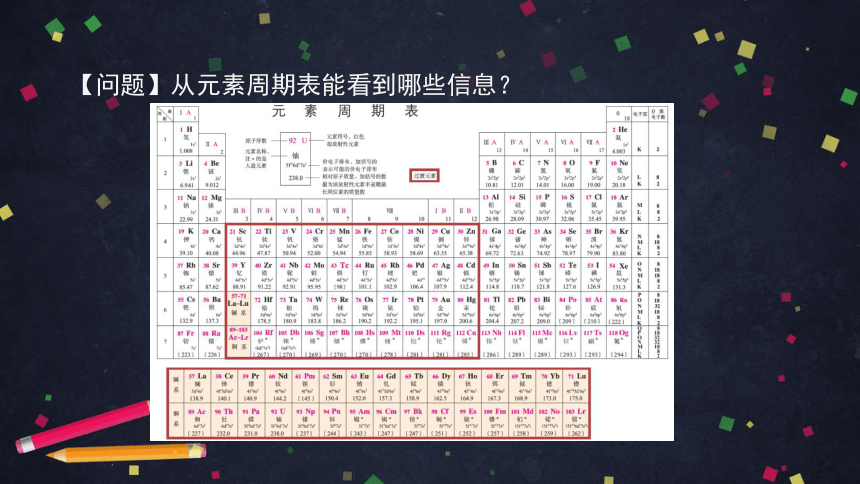
【问题】从元素周期表能看到哪些信息?
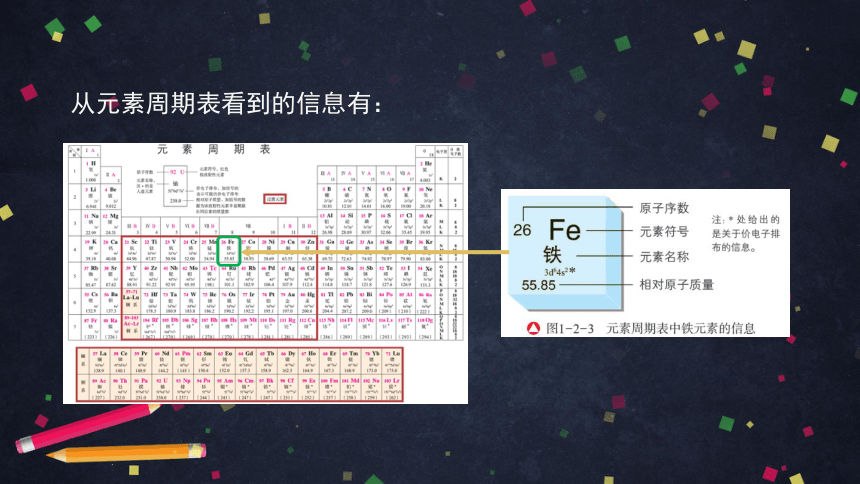
从元素周期表看到的信息有:
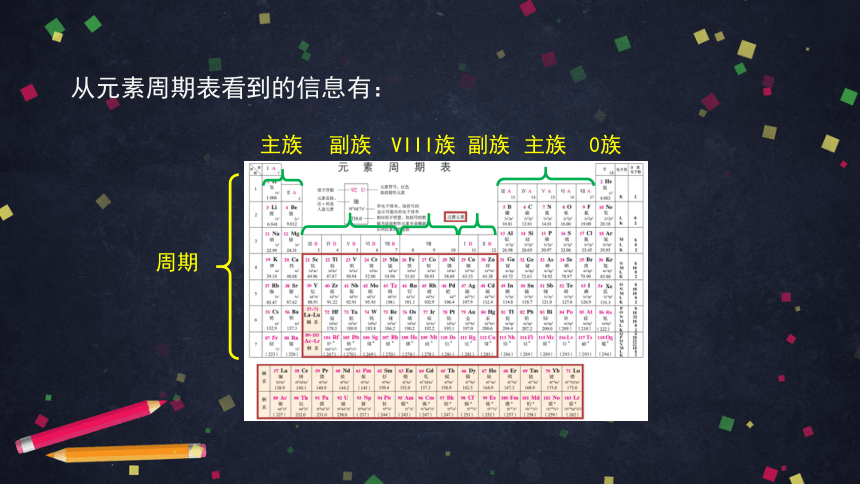
从元素周期表看到的信息有:
周期
主族
主族
副族
副族
VIII族
0族
【问题】元素周期表共有多少个周期?每个周期有多少种元素?
周期
短周期
长周期
第1周期:2种元素
第2周期:8种元素
第3周期:8种元素
第4周期:18种元素
第5周期:18种元素
第6周期:32种元素
第7周期:32种元素
【小结】元素周期表的周期:
【追问】元素周期表为什么有7个周期?每个周期的元素种数,又与什么相关?
原子核外电子的分层排布
每个电子层所能容纳的电子数
【问题】请找出钠元素在元素周期表中的位置,思考钠元素为什么排在这个位置?
第三周期
IA族
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
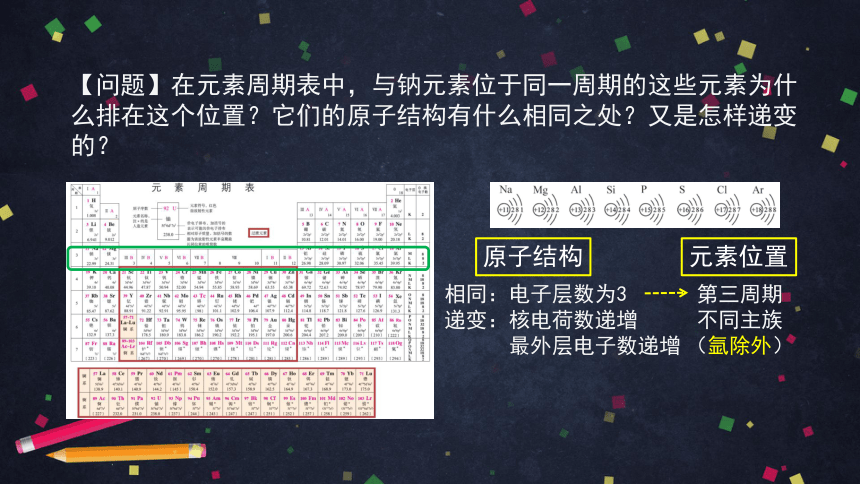
【问题】在元素周期表中,与钠元素位于同一周期的这些元素为什么排在这个位置?它们的原子结构有什么相同之处?又是怎样递变的?
相同:电子层数为3
递变:核电荷数递增
最外层电子数递增
第三周期
不同主族
(氩除外)
原子结构
元素位置
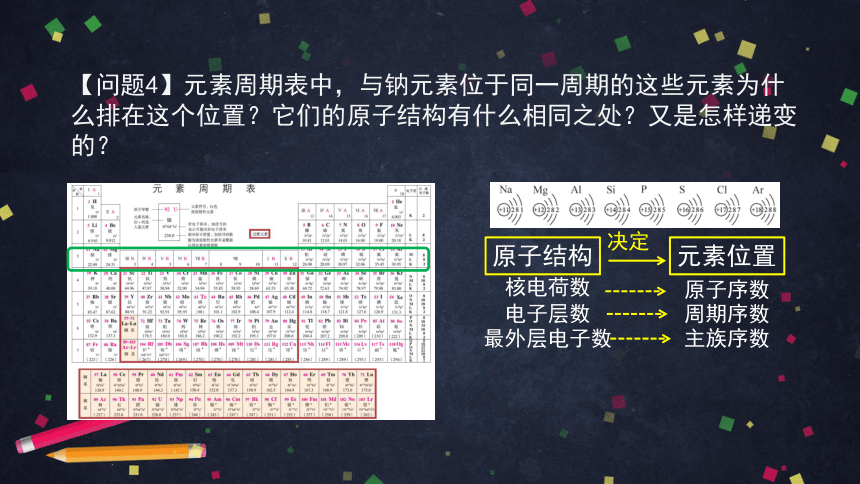
【问题4】元素周期表中,与钠元素位于同一周期的这些元素为什么排在这个位置?它们的原子结构有什么相同之处?又是怎样递变的?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】请以第三周期为例,分析排在同一周期的元素(稀有气体除外),它们的性质是如何递变的?
第三周期元素:电子层数相同,从左到右
核电荷数逐渐增多,原子核对最外层电子的引力逐渐增大
原子半径逐渐减小,原子的失电子能力逐渐减弱,得电子能力逐渐增强
同时,最外层电子数逐渐增多
元素最高化合价,等于最外层电子数,逐渐升高
元素最低化合价的绝对值,等于8-最外层电子数,逐渐降低
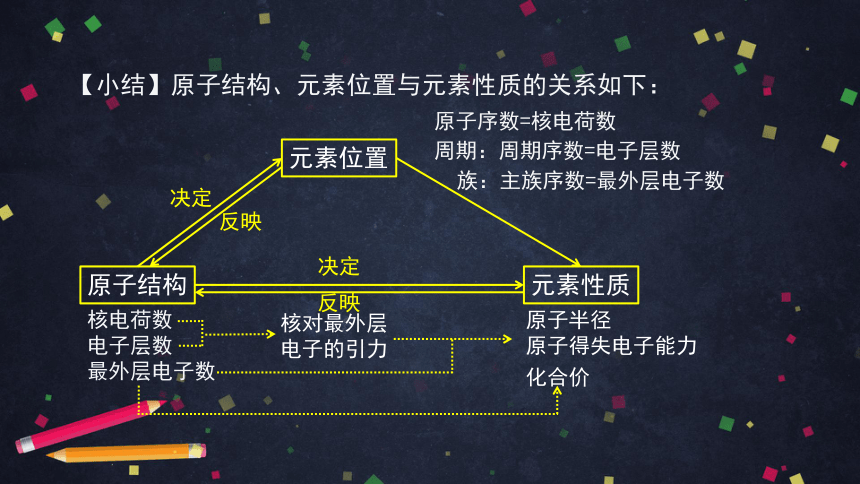
【小结】原子结构、元素位置与元素性质的关系如下:
核电荷数
电子层数
最外层电子数
元素位置
原子结构
元素性质
原子半径
原子得失电子能力
决定
决定
族:主族序数=最外层电子数
周期:周期序数=电子层数
化合价
核对最外层电子的引力
原子序数=核电荷数
反映
反映
【问题】元素周期表有哪些族?如何表示?
VIII族
包含3个纵列(第8、9、10纵列)
第四周期第VIII族
0族
元素周期表中的族:
主族:IA、IIA
(7个)
元素周期表中的族:
IIIA、IVA、VA
VIA、VIIA
碱金属元素
锂(Li)
钠(Na)
钾(K)
铷(Rb)
铯(Cs)
钫(Fr)
卤族元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
砹(At)
碱土金属元素:IIA族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等元素。
金属元素 锂 钠 钾 钙 锶 钡 铜
焰色
深红 黄 浅紫 砖红 洋红 黄绿 蓝绿
副族(7个): IIIB、IVB、
VB、VIB、VIIB
元素周期表中的族:
IB、IIB
过渡元素:元素周期表第3 ~ 12列(副族和Ⅷ族)中的元素。
镧系元素:第6周期IIIB族,57号镧(La) ~ 71号镥(Lu),共15种
锕系元素:第7周期IIIB族,89号锕(Ac) ~ 103号铹(Lr),共15种
【小结】元素周期表的族:
族
主族:IA、IIA、IIIA、IVA、VA、VIA、VIIA
7个
副族:IIIB、IVB、VB、VIB、VIIB、IB、IIB
7个
VIII族:包含3个纵列(第8、9、10纵列)
0族:稀有气体元素
18纵列,16个族
【问题】锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)等碱金属元素为什么排在周期表的这个位置?与原子结构有什么关系?
相同:最外层电子数为1
递变:核电荷数递增
电子层数递增
IA族
周期序数递增
原子结构
元素位置
【问题】锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)等碱金属元素为什么排在周期表的这个位置?与原子结构有什么关系?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等卤族元素为什么排在周期表的这个位置?与原子结构有什么关系?
相同:最外层电子数为7
递变:核电荷数递增
电子层数递增
VIIA族
周期数递增
原子结构
元素位置
【问题】氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等卤族元素为什么排在周期表的这个位置?与原子结构有什么关系?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】请以碱金属元素和卤族元素为例,分析排在同一主族的元素,它们的性质有什么相似性?又是如何递变的?
元素周期表IA族
最外层电子数为1
最高化合价为+1价
原子的失电子能力强
元素周期表VIIA族
最外层电子数为7
最高化合价为+7价(氟除外)
最低化合价为-1价
原子的得电子能力强
碱金属元素相似性
卤族元素相似性
【问题】请以碱金属元素和卤族元素为例,分析排在同一主族的元素,它们的性质有什么相似性?又是如何递变的?
同主族元素:从上到下核电荷数增多,电子层数增多
核对最外层电子的引力减小原子半径增大
碱金属元素:从上到下,原子的失电子能力逐渐增强
卤族元素:从上到下,原子的得电子能力逐渐减弱
递变性
现代元素周期表的编排原则:
把电子层数相同的元素按核电荷数递增的顺序从左到右排成一个周期
把不同周期中最外层电子数相同的元素按电子层数递增的顺序从上到下排成一个族
【总结】
元素周期表是元素周期律的外在表现形式。那么,不同形式的元素周期表,又能给我们传递元素之间怎样的规律呢?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些元素周期表的优点和不足是什么?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些周期表的优点和不足是什么?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些周期表的优点和不足是什么?
不同形式的元素周期表体现了人们对原子结构的认识。
【练习】请你说出元素名称
第二周期VIA族
第三周期IIIA族
氧
铝
【练习】请你说出元素在元素周期表中的位置
C
Ca
第二周期IVA族
第四周期IIA族
【挑战自我】请说出34号元素的元素名称和元素在元素周期表中的位置
每一周期
稀有气体元素在元素周期表中的原子序数为:
第一周期:2
第二周期:10
第三周期:18
第四周期:36
第五周期:54
第六周期:86
第七周期:118
第一步:比大小,定周期:
第四周期
第二步:求差值,定族数
∵原子序数相差:36-34=2
∴纵列序数:18-2=16 即VIA族
【练习】请说出34号元素的元素名称和元素在元素周期表中的位置
碲,第四周期VIA族
元素周期表是一个化学知识宝库。我们不仅可以从元素周期表中直接获得元素的名称、元素符号、相对原子质量、电子层结构等信息,还可以根据元素在元素周期表中的位置认识其性质以及寻找新元素及其化合物。
第一章 第二节
元素周期律和元素周期表(2)
高一年级 化学
【问题】从元素周期表能看到哪些信息?
从元素周期表看到的信息有:
从元素周期表看到的信息有:
周期
主族
主族
副族
副族
VIII族
0族
【问题】元素周期表共有多少个周期?每个周期有多少种元素?
周期
短周期
长周期
第1周期:2种元素
第2周期:8种元素
第3周期:8种元素
第4周期:18种元素
第5周期:18种元素
第6周期:32种元素
第7周期:32种元素
【小结】元素周期表的周期:
【追问】元素周期表为什么有7个周期?每个周期的元素种数,又与什么相关?
原子核外电子的分层排布
每个电子层所能容纳的电子数
【问题】请找出钠元素在元素周期表中的位置,思考钠元素为什么排在这个位置?
第三周期
IA族
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】在元素周期表中,与钠元素位于同一周期的这些元素为什么排在这个位置?它们的原子结构有什么相同之处?又是怎样递变的?
相同:电子层数为3
递变:核电荷数递增
最外层电子数递增
第三周期
不同主族
(氩除外)
原子结构
元素位置
【问题4】元素周期表中,与钠元素位于同一周期的这些元素为什么排在这个位置?它们的原子结构有什么相同之处?又是怎样递变的?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】请以第三周期为例,分析排在同一周期的元素(稀有气体除外),它们的性质是如何递变的?
第三周期元素:电子层数相同,从左到右
核电荷数逐渐增多,原子核对最外层电子的引力逐渐增大
原子半径逐渐减小,原子的失电子能力逐渐减弱,得电子能力逐渐增强
同时,最外层电子数逐渐增多
元素最高化合价,等于最外层电子数,逐渐升高
元素最低化合价的绝对值,等于8-最外层电子数,逐渐降低
【小结】原子结构、元素位置与元素性质的关系如下:
核电荷数
电子层数
最外层电子数
元素位置
原子结构
元素性质
原子半径
原子得失电子能力
决定
决定
族:主族序数=最外层电子数
周期:周期序数=电子层数
化合价
核对最外层电子的引力
原子序数=核电荷数
反映
反映
【问题】元素周期表有哪些族?如何表示?
VIII族
包含3个纵列(第8、9、10纵列)
第四周期第VIII族
0族
元素周期表中的族:
主族:IA、IIA
(7个)
元素周期表中的族:
IIIA、IVA、VA
VIA、VIIA
碱金属元素
锂(Li)
钠(Na)
钾(K)
铷(Rb)
铯(Cs)
钫(Fr)
卤族元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
砹(At)
碱土金属元素:IIA族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等元素。
金属元素 锂 钠 钾 钙 锶 钡 铜
焰色
深红 黄 浅紫 砖红 洋红 黄绿 蓝绿
副族(7个): IIIB、IVB、
VB、VIB、VIIB
元素周期表中的族:
IB、IIB
过渡元素:元素周期表第3 ~ 12列(副族和Ⅷ族)中的元素。
镧系元素:第6周期IIIB族,57号镧(La) ~ 71号镥(Lu),共15种
锕系元素:第7周期IIIB族,89号锕(Ac) ~ 103号铹(Lr),共15种
【小结】元素周期表的族:
族
主族:IA、IIA、IIIA、IVA、VA、VIA、VIIA
7个
副族:IIIB、IVB、VB、VIB、VIIB、IB、IIB
7个
VIII族:包含3个纵列(第8、9、10纵列)
0族:稀有气体元素
18纵列,16个族
【问题】锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)等碱金属元素为什么排在周期表的这个位置?与原子结构有什么关系?
相同:最外层电子数为1
递变:核电荷数递增
电子层数递增
IA族
周期序数递增
原子结构
元素位置
【问题】锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)等碱金属元素为什么排在周期表的这个位置?与原子结构有什么关系?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等卤族元素为什么排在周期表的这个位置?与原子结构有什么关系?
相同:最外层电子数为7
递变:核电荷数递增
电子层数递增
VIIA族
周期数递增
原子结构
元素位置
【问题】氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)等卤族元素为什么排在周期表的这个位置?与原子结构有什么关系?
原子结构
元素位置
核电荷数
电子层数
最外层电子数
周期序数
决定
主族序数
原子序数
【问题】请以碱金属元素和卤族元素为例,分析排在同一主族的元素,它们的性质有什么相似性?又是如何递变的?
元素周期表IA族
最外层电子数为1
最高化合价为+1价
原子的失电子能力强
元素周期表VIIA族
最外层电子数为7
最高化合价为+7价(氟除外)
最低化合价为-1价
原子的得电子能力强
碱金属元素相似性
卤族元素相似性
【问题】请以碱金属元素和卤族元素为例,分析排在同一主族的元素,它们的性质有什么相似性?又是如何递变的?
同主族元素:从上到下核电荷数增多,电子层数增多
核对最外层电子的引力减小原子半径增大
碱金属元素:从上到下,原子的失电子能力逐渐增强
卤族元素:从上到下,原子的得电子能力逐渐减弱
递变性
现代元素周期表的编排原则:
把电子层数相同的元素按核电荷数递增的顺序从左到右排成一个周期
把不同周期中最外层电子数相同的元素按电子层数递增的顺序从上到下排成一个族
【总结】
元素周期表是元素周期律的外在表现形式。那么,不同形式的元素周期表,又能给我们传递元素之间怎样的规律呢?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些元素周期表的优点和不足是什么?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些周期表的优点和不足是什么?
【问题】观察不同形式的元素周期表,分析它们的编排原则是什么?这些周期表的优点和不足是什么?
不同形式的元素周期表体现了人们对原子结构的认识。
【练习】请你说出元素名称
第二周期VIA族
第三周期IIIA族
氧
铝
【练习】请你说出元素在元素周期表中的位置
C
Ca
第二周期IVA族
第四周期IIA族
【挑战自我】请说出34号元素的元素名称和元素在元素周期表中的位置
每一周期
稀有气体元素在元素周期表中的原子序数为:
第一周期:2
第二周期:10
第三周期:18
第四周期:36
第五周期:54
第六周期:86
第七周期:118
第一步:比大小,定周期:
第四周期
第二步:求差值,定族数
∵原子序数相差:36-34=2
∴纵列序数:18-2=16 即VIA族
【练习】请说出34号元素的元素名称和元素在元素周期表中的位置
碲,第四周期VIA族
元素周期表是一个化学知识宝库。我们不仅可以从元素周期表中直接获得元素的名称、元素符号、相对原子质量、电子层结构等信息,还可以根据元素在元素周期表中的位置认识其性质以及寻找新元素及其化合物。
