鲁科版高中化学必修二第二章第1节 化学键与化学反应 课件(共27张PPT)
文档属性
| 名称 | 鲁科版高中化学必修二第二章第1节 化学键与化学反应 课件(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 00:00:00 | ||
图片预览




文档简介
课件27张PPT。第一节 化学键与化学反应制备新物质提供能量铜矿石汽油 在所有化学反应中,不仅有物质变化,还伴随能量的变化。
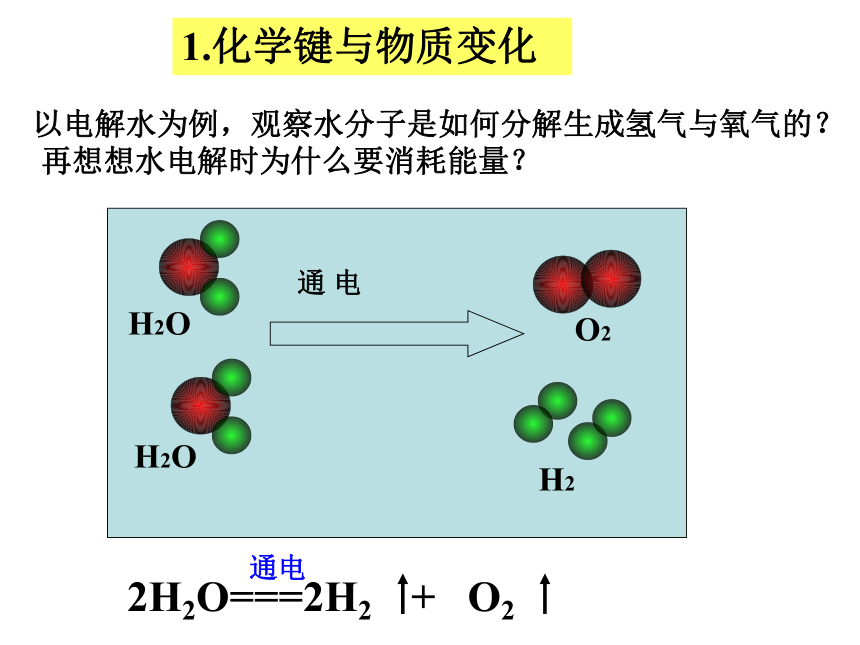
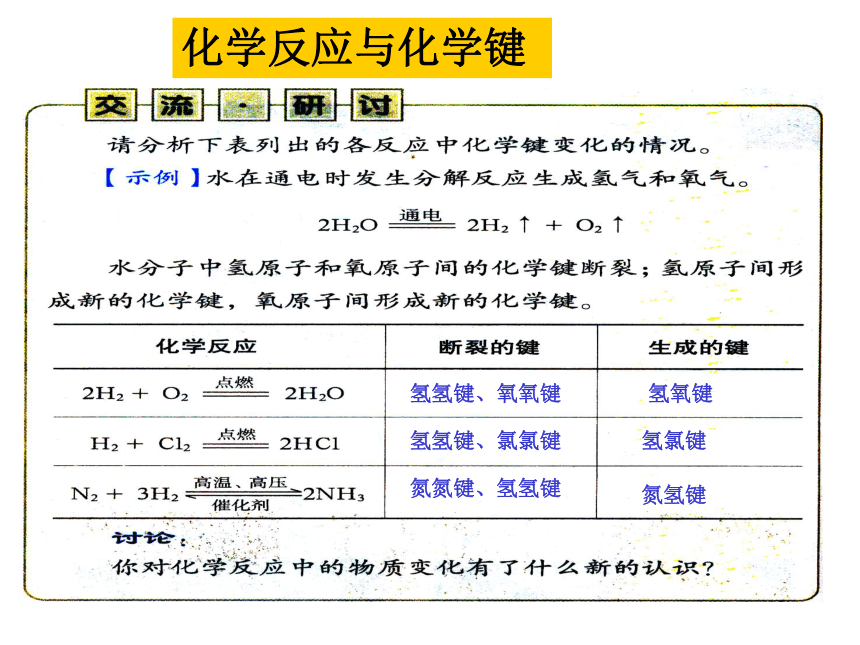
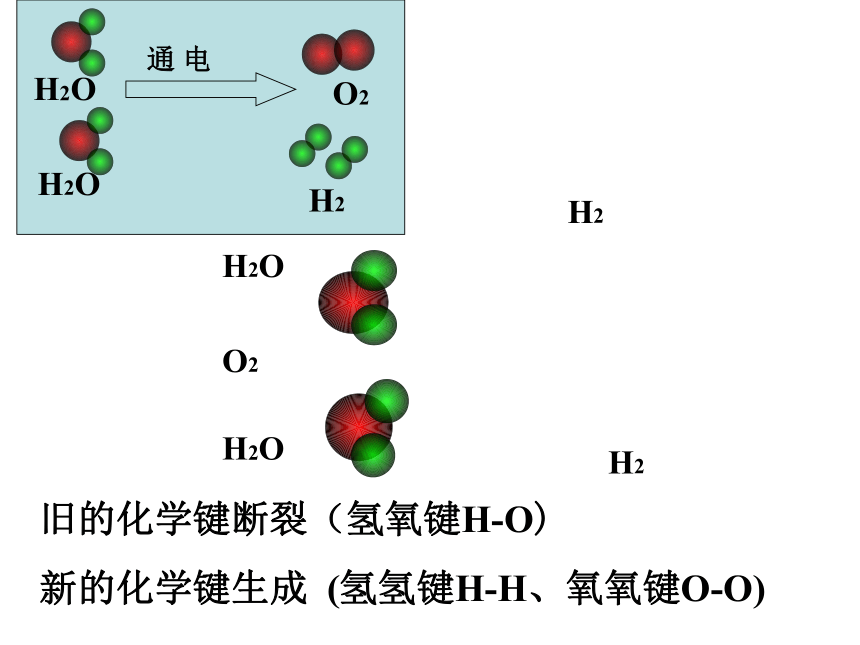
思考:化学反应中为什么会有物质的变化?1.化学键与物质变化 以电解水为例,观察水分子是如何分解生成氢气与氧气的?再想想水电解时为什么要消耗能量?化 学 键分子内相邻原子间的强相互作用①是直接相邻的原子②是强烈的相互作用③相互作用既包括吸引也包括排斥H2O注:稀有气体分子中不存在化学键。氢氢键、氧氧键氢氧键氢氢键、氯氯键氢氯键氮氮键、氢氢键氮氢键化学反应与化学键化学反应的实质:从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。NaCl 溶于水是化学反应吗?NaCl == Na+ + Cl-不是H2OH2OH2H2O2旧的化学键断裂(氢氧键H-O)
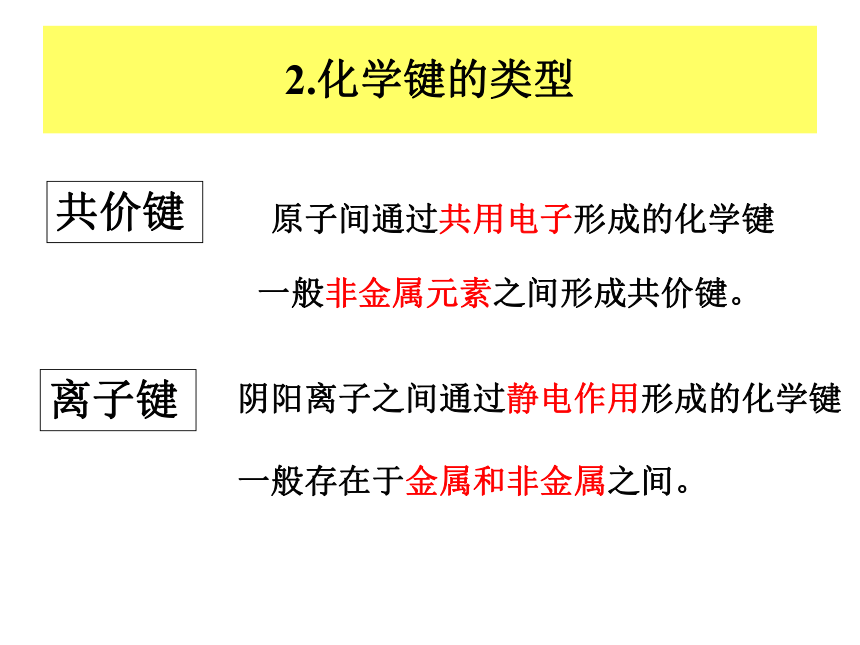
新的化学键生成 (氢氢键H-H、氧氧键O-O)2.化学键的类型共价键离子键原子间通过共用电子形成的化学键一般非金属元素之间形成共价键。阴阳离子之间通过静电作用形成的化学键一般存在于金属和非金属之间。原子之间通过共用电子形成的化学键共价键成键元素:非金属元素和非金属元素+177821HCl 请运用你所学的知识判断下列哪些物质中存在共价键?
NaF CH4 H2O CaO
H2 MgCl2 O2 CO 2 共价键成键元素:非金属元素和非金属元素电子式的表示1、电子式的意义:用 表示原子最外层电子
2、离子用离子符号表示HOAlCNF:化合物中电子式的书写练习-+离子键成键元素:
活泼金属元素和活泼非金属元素。阴、阳离子通过静电作用
形成的化学键
NaCl探究2得到一个电子失去一个电子氯化钠的形成 请运用你所学的知识判断下列物质中分别存在哪些类型的化学键?
NaF CH4 H2O CaO KBr
HF BaCl2 O2 CO 2 MgCl2 NaF CaO KBr BaCl2 MgCl2 CH4 H2O HF O2 CO 2 离子键: 共价键: 归纳·比较阴、阳离子通过静电作用形成的化学键
原子间通过共用电子对形成的化学键
阴、阳离子原子静电作用共用电子对活泼金属和活泼非金属非金属和非金属之间原子间共用电子电子的得失 练习离子化合物:含有离子键的化合物一般来说含有金属阳离子(或NH4+)的化合物为离子化合物。如:K2O、CaO、KOH、NaCl、CaSO4、Na2S、NH4Cl等。3.离子化合物和共价化合物【注意】 1.离子化合物含有离子键,也可能同时含共价键 2. 大多数:盐类物质属于离子化合物(但AlCl3例外,属于共价化合物),金属氧化物、强碱均属于离子化合物。注意:
1.共价化合物只含有共价键;含有共价键的化合物不一定是共价化合物,如NaOH、Na2SO4 、NH4Cl等。 2.酸类物质,非金属氧化物、绝大多数的有机化合物均属于共价化合物。共价化合物:只含有共价键的化合物一般来说只含非金属元素的化合物为共价化合物。如:HCl、H2O、CO、SO3、H2SO4等。小 结化学键 离子键
阴阳离子通过静电作用共价键
原子通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键 判断下列化合物是离子化合物还是共价化合物典型例题离子化合物共价化合物CaCl2 SO2H2O Na2O NaOH NH3 CuSO4HCl判断下列物质中含有的化学键类型单质离子键离子键、共价键离
子
化
合
物共价化合物吸收能量释放能量释放能量溶液温度升高溶液温度升高温度降低感受化学反应中的能量变化4、化学键与化学反应中的能量变化化学反应物质变化能量变化实质(旧化学键断裂,
新化学键形成)破坏化学键需要吸收能量,
形成化学键需要释放能量而且,吸收和释放的能量不相等。化学键是相邻原子或离子间强烈的相互作用;为什么化学反应会释放能量或吸收能量?小结反应物 生成物旧化学键断裂新化学键形成吸收能量E(吸 断裂)释放能量E(放 形成)E(吸 断裂)>E(放 形成) 反应吸收能量E(吸 断裂)中和反应
金属与酸
铝热氢氧化钡晶体与氯化铵固体的反应
大多数分解反应
以C、H2、CO为还原剂的氧化还原反应
思考:化学反应中为什么会有物质的变化?1.化学键与物质变化 以电解水为例,观察水分子是如何分解生成氢气与氧气的?再想想水电解时为什么要消耗能量?化 学 键分子内相邻原子间的强相互作用①是直接相邻的原子②是强烈的相互作用③相互作用既包括吸引也包括排斥H2O注:稀有气体分子中不存在化学键。氢氢键、氧氧键氢氧键氢氢键、氯氯键氢氯键氮氮键、氢氢键氮氢键化学反应与化学键化学反应的实质:从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。NaCl 溶于水是化学反应吗?NaCl == Na+ + Cl-不是H2OH2OH2H2O2旧的化学键断裂(氢氧键H-O)
新的化学键生成 (氢氢键H-H、氧氧键O-O)2.化学键的类型共价键离子键原子间通过共用电子形成的化学键一般非金属元素之间形成共价键。阴阳离子之间通过静电作用形成的化学键一般存在于金属和非金属之间。原子之间通过共用电子形成的化学键共价键成键元素:非金属元素和非金属元素+177821HCl 请运用你所学的知识判断下列哪些物质中存在共价键?
NaF CH4 H2O CaO
H2 MgCl2 O2 CO 2 共价键成键元素:非金属元素和非金属元素电子式的表示1、电子式的意义:用 表示原子最外层电子
2、离子用离子符号表示HOAlCNF:化合物中电子式的书写练习-+离子键成键元素:
活泼金属元素和活泼非金属元素。阴、阳离子通过静电作用
形成的化学键
NaCl探究2得到一个电子失去一个电子氯化钠的形成 请运用你所学的知识判断下列物质中分别存在哪些类型的化学键?
NaF CH4 H2O CaO KBr
HF BaCl2 O2 CO 2 MgCl2 NaF CaO KBr BaCl2 MgCl2 CH4 H2O HF O2 CO 2 离子键: 共价键: 归纳·比较阴、阳离子通过静电作用形成的化学键
原子间通过共用电子对形成的化学键
阴、阳离子原子静电作用共用电子对活泼金属和活泼非金属非金属和非金属之间原子间共用电子电子的得失 练习离子化合物:含有离子键的化合物一般来说含有金属阳离子(或NH4+)的化合物为离子化合物。如:K2O、CaO、KOH、NaCl、CaSO4、Na2S、NH4Cl等。3.离子化合物和共价化合物【注意】 1.离子化合物含有离子键,也可能同时含共价键 2. 大多数:盐类物质属于离子化合物(但AlCl3例外,属于共价化合物),金属氧化物、强碱均属于离子化合物。注意:
1.共价化合物只含有共价键;含有共价键的化合物不一定是共价化合物,如NaOH、Na2SO4 、NH4Cl等。 2.酸类物质,非金属氧化物、绝大多数的有机化合物均属于共价化合物。共价化合物:只含有共价键的化合物一般来说只含非金属元素的化合物为共价化合物。如:HCl、H2O、CO、SO3、H2SO4等。小 结化学键 离子键
阴阳离子通过静电作用共价键
原子通过共用电子对化学变化的实质旧键断裂,新键生成共价化合物
只含有共价键离子化合物
含有离子键 判断下列化合物是离子化合物还是共价化合物典型例题离子化合物共价化合物CaCl2 SO2H2O Na2O NaOH NH3 CuSO4HCl判断下列物质中含有的化学键类型单质离子键离子键、共价键离
子
化
合
物共价化合物吸收能量释放能量释放能量溶液温度升高溶液温度升高温度降低感受化学反应中的能量变化4、化学键与化学反应中的能量变化化学反应物质变化能量变化实质(旧化学键断裂,
新化学键形成)破坏化学键需要吸收能量,
形成化学键需要释放能量而且,吸收和释放的能量不相等。化学键是相邻原子或离子间强烈的相互作用;为什么化学反应会释放能量或吸收能量?小结反应物 生成物旧化学键断裂新化学键形成吸收能量E(吸 断裂)释放能量E(放 形成)E(吸 断裂)>E(放 形成) 反应吸收能量E(吸 断裂)
金属与酸
铝热氢氧化钡晶体与氯化铵固体的反应
大多数分解反应
以C、H2、CO为还原剂的氧化还原反应
