鲁科化学必修2第二章1化学键与化学反应(共28张PPT)
文档属性
| 名称 | 鲁科化学必修2第二章1化学键与化学反应(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 10:25:29 | ||
图片预览






文档简介
(共28张PPT)
第2章 化学键 化学反应与能量
第1节 化学键与化学反应
化学·必修2(鲁科版)
学习目标
3. 会判断和区分离子化合物、共价化合物。
2. 知道离子键和共价键的形成过程;了解化学反应
中物质变化的实质。(重点)
1. 了解化学键的含义。
化学反应都具有哪些特征,都遵循哪些基本定律?
两大基本特征:物质变化和能量变化
遵循两大基本定律:质量守恒定律和能量守恒定律
思考
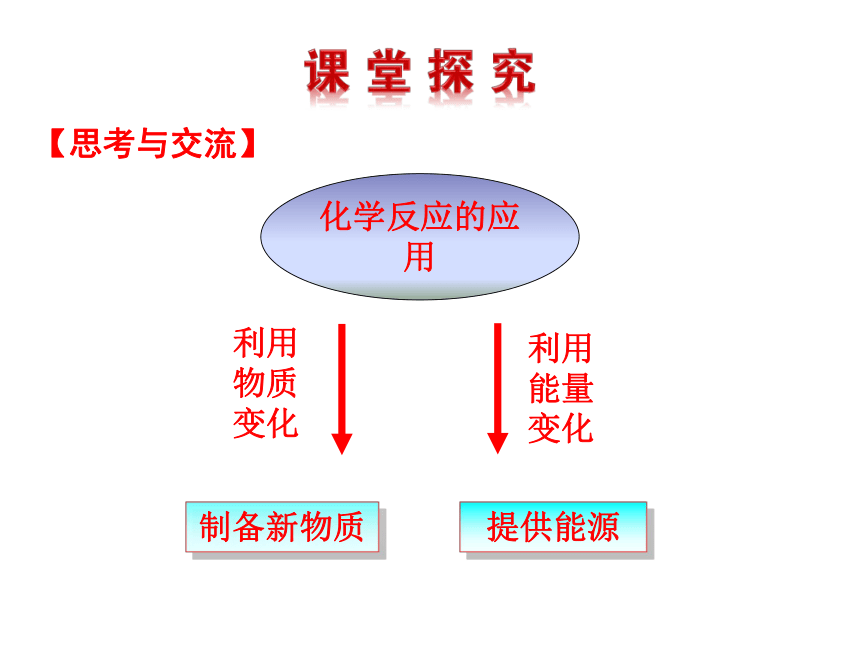
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
【思考与交流】
请同学们认真观察电解水实验
并思考:H2O在通电的情况下会生成H2和O2,如果不通电,水能否分解为H2和O2 ?
观察与思考
结合上述视频,思考水电解时为什么要通电?
原来 ,在水分子中氧原子与氢原子之间存在很强的相互作用,要破坏这种相互作用就要消耗能量,通电正是为水的分解提供能量的。其过程如下:
【思考与交流】
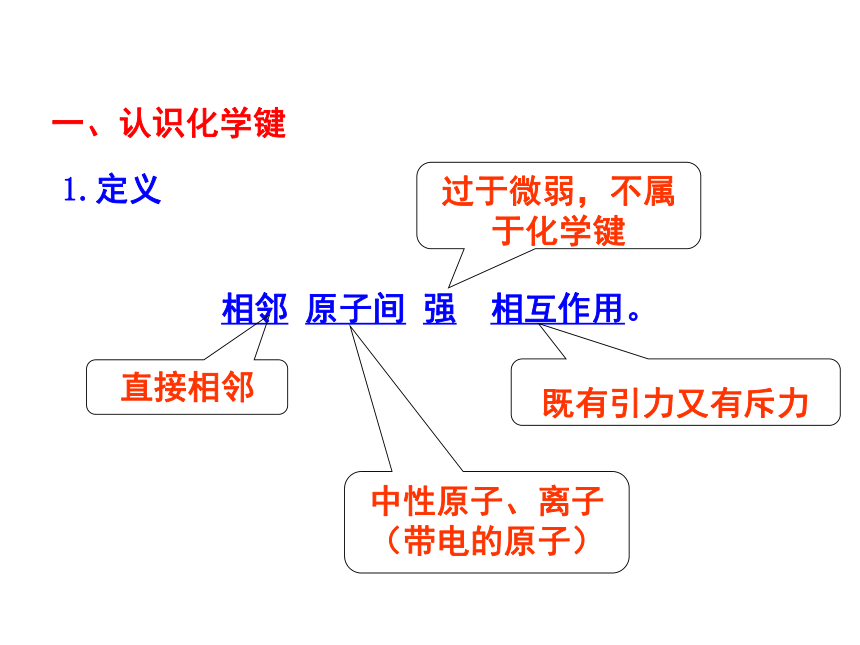
相邻 原子间 强 相互作用。
直接相邻
既有引力又有斥力
一、认识化学键
1.定义
过于微弱,不属于化学键
中性原子、离子
(带电的原子)
2、化学键分类
2、原子间形成离子键、共价键的条件是什么?
想得到一个电子
想失去一个电子
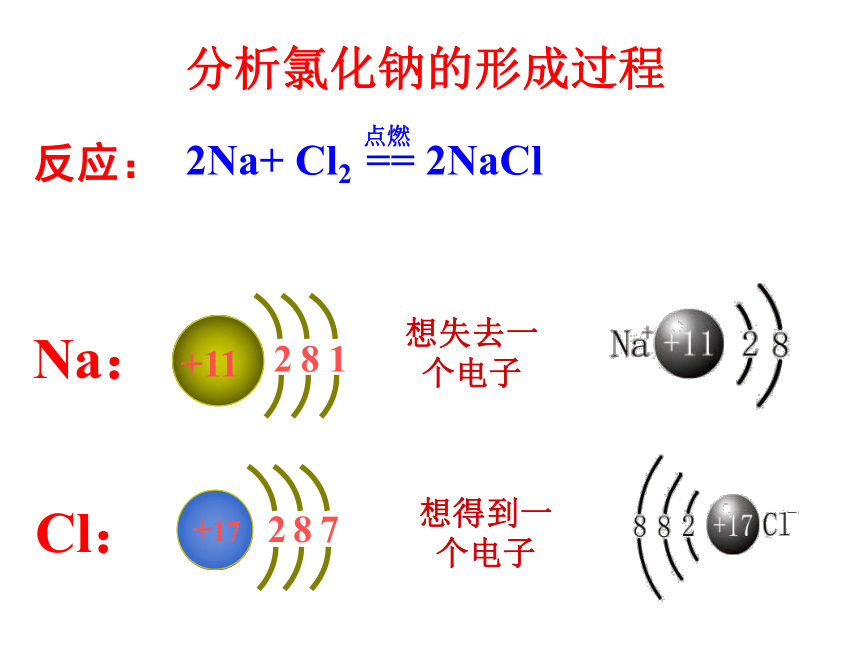
分析氯化钠的形成过程
Na:
Cl:
反应:
电子转移
不稳定
稳定
阳离子
阴离子
(1)定义:阴、阳离子之间通过静电作用形成的化学键
离子键
(2)成键实质:
阴、阳离子
(3)成键微粒:
(阴、阳离子间的)静电作用
(4)成键元素:
活泼金属(或NH4+) 与 活泼非金属之间
引力与斥力的平衡
ⅠA、ⅡA
ⅥA、ⅦA
分析氯化氢的形成过程
★原子之间通过共用电子对所形成的化学键,叫共价键
原子间通过共用电子对
反应:
+
→
(2)成键实质:
(共用电子对与原子核间的)静电作用
原子
(3)成键微粒:
(4)成键元素:
一般,非金属元素的原子之间
(1)定义:原子间通过共用电子形成的化学键。
共价键
共用电子对不存在偏移
共用电子对存在偏移
非极性共价键
极性共价键
极性键:由不同种非金属原子形成的共价键
即A-B型。例如:HCl(H-Cl) H2O(H-O-H)
非极性键:由同种非金属原子形成的共价键即A-A型。例如: H2(H-H) Cl2(Cl-Cl)
根据共用电子对是否存在偏移
离子化合物
含有离子键的化合物
二、离子化合物与共价化合物
共价化合物
只含有共价键的化合物
离子化合物中可能有共价键
化合物
1.离子化合物中一定含有离子键,可能含有共价键。
2.共价化合物中只含有共价键。
3.酸都是共价化合物,强碱都是离子化合物。
4.绝大多数盐是离子化合物,铵盐都是离子化合物。
特别提醒
提示:错,如NH4Cl等铵盐。
提示:错,He、Ne等稀有气体。
(3)在气态单质分子里一定有共价键。
(1)全部由非金属元素组成的化合物一定是共价化合物。
判断下列说法是否正确。
(2)含活泼金属元素的化合物一定是离子化合物。
提示:错,如AlCl3。
【学与用】
破坏旧化学键
形成新化学键
从化学键角度认识化学反应,化学反应中物质变化的实质是什么?
【思考与交流】
实质:
三、化学反应的实质
旧化学键断裂和新化学键形成
有化学键变化就一定发生化学变化吗?
提示:不一定,例如食盐(NaCl)熔化,变成自由移动的Na+和Cl-、HCl溶于水电离成H+和Cl-等,就没有发生化学变化。
【学与用】
静电作用
共用电子对
阴、阳离子
原子
一般活泼金属与活泼非金属
一般同种或不同种非金属原子间
一般通过得失电子
通过共用电子对
最外层电子达到稳定结构
原子间通过共用电子
形成的化学键
阴、阳离子之间通过静电作用形成的化学键
1.离子键与共价键的区别与联系
归纳总结
离子键 共价键
定义
成键微粒
键的实质
形成条件
成键方式
成键原因
含离子键的化合物
只含共价键的化合物
离子键
分子内是共价键
强碱、大多数盐、活泼金属的氧化物
酸、非金属氧化物、非金属的氢化物
熔融或水溶液导电
熔融时不导电、水溶液部分导电
破坏离子键
破坏分子间作用力,不破坏共价键
2.离子化合物与共价化合物的区别
归纳总结
离子化合物 共价化合物
概念
化学键类型
导电性
熔化时破坏
的作用力
实例
一、化学键: 1、定义 2、分类
离子键和共价键
(1)离子键:阴、阳离子之间通过静电作用形成的化学键
(2)共价键:原子间通过共用电子形成的化学键。
二、离子化合物和共价化合物
(1)离子化合物:含有离子键的化合物。
(2)共价化合物:只含有共价键的化合物。
三、化学反应的实质:旧化学键断裂和新化学键形成。
1.下列说法中正确的是( ) A.两个原子或多个原子之间的相互作用叫做化学键 B.阴、阳离子通过静电引力而形成的化学键叫做离子键 C.只有金属元素和非金属元素化合时才能形成离子键 D.大多数的盐、碱和低价金属氧化物中含有离子键
D
2.下列性质中,可以证明其化合物内一定存在离子
键的是( )
A.水溶液能导电
B.由金属和非金属元素的原子构成
C.熔融状态能导电
D.可以溶于水
C
3.判断下列化合物是离子化合物还是共价化合物
离子化合物
共价化合物
CaCl2
SO2
H2O
FeO
NaOH
NH3
CuSO4
HCl
第2章 化学键 化学反应与能量
第1节 化学键与化学反应
化学·必修2(鲁科版)
学习目标
3. 会判断和区分离子化合物、共价化合物。
2. 知道离子键和共价键的形成过程;了解化学反应
中物质变化的实质。(重点)
1. 了解化学键的含义。
化学反应都具有哪些特征,都遵循哪些基本定律?
两大基本特征:物质变化和能量变化
遵循两大基本定律:质量守恒定律和能量守恒定律
思考
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
【思考与交流】
请同学们认真观察电解水实验
并思考:H2O在通电的情况下会生成H2和O2,如果不通电,水能否分解为H2和O2 ?
观察与思考
结合上述视频,思考水电解时为什么要通电?
原来 ,在水分子中氧原子与氢原子之间存在很强的相互作用,要破坏这种相互作用就要消耗能量,通电正是为水的分解提供能量的。其过程如下:
【思考与交流】
相邻 原子间 强 相互作用。
直接相邻
既有引力又有斥力
一、认识化学键
1.定义
过于微弱,不属于化学键
中性原子、离子
(带电的原子)
2、化学键分类
2、原子间形成离子键、共价键的条件是什么?
想得到一个电子
想失去一个电子
分析氯化钠的形成过程
Na:
Cl:
反应:
电子转移
不稳定
稳定
阳离子
阴离子
(1)定义:阴、阳离子之间通过静电作用形成的化学键
离子键
(2)成键实质:
阴、阳离子
(3)成键微粒:
(阴、阳离子间的)静电作用
(4)成键元素:
活泼金属(或NH4+) 与 活泼非金属之间
引力与斥力的平衡
ⅠA、ⅡA
ⅥA、ⅦA
分析氯化氢的形成过程
★原子之间通过共用电子对所形成的化学键,叫共价键
原子间通过共用电子对
反应:
+
→
(2)成键实质:
(共用电子对与原子核间的)静电作用
原子
(3)成键微粒:
(4)成键元素:
一般,非金属元素的原子之间
(1)定义:原子间通过共用电子形成的化学键。
共价键
共用电子对不存在偏移
共用电子对存在偏移
非极性共价键
极性共价键
极性键:由不同种非金属原子形成的共价键
即A-B型。例如:HCl(H-Cl) H2O(H-O-H)
非极性键:由同种非金属原子形成的共价键即A-A型。例如: H2(H-H) Cl2(Cl-Cl)
根据共用电子对是否存在偏移
离子化合物
含有离子键的化合物
二、离子化合物与共价化合物
共价化合物
只含有共价键的化合物
离子化合物中可能有共价键
化合物
1.离子化合物中一定含有离子键,可能含有共价键。
2.共价化合物中只含有共价键。
3.酸都是共价化合物,强碱都是离子化合物。
4.绝大多数盐是离子化合物,铵盐都是离子化合物。
特别提醒
提示:错,如NH4Cl等铵盐。
提示:错,He、Ne等稀有气体。
(3)在气态单质分子里一定有共价键。
(1)全部由非金属元素组成的化合物一定是共价化合物。
判断下列说法是否正确。
(2)含活泼金属元素的化合物一定是离子化合物。
提示:错,如AlCl3。
【学与用】
破坏旧化学键
形成新化学键
从化学键角度认识化学反应,化学反应中物质变化的实质是什么?
【思考与交流】
实质:
三、化学反应的实质
旧化学键断裂和新化学键形成
有化学键变化就一定发生化学变化吗?
提示:不一定,例如食盐(NaCl)熔化,变成自由移动的Na+和Cl-、HCl溶于水电离成H+和Cl-等,就没有发生化学变化。
【学与用】
静电作用
共用电子对
阴、阳离子
原子
一般活泼金属与活泼非金属
一般同种或不同种非金属原子间
一般通过得失电子
通过共用电子对
最外层电子达到稳定结构
原子间通过共用电子
形成的化学键
阴、阳离子之间通过静电作用形成的化学键
1.离子键与共价键的区别与联系
归纳总结
离子键 共价键
定义
成键微粒
键的实质
形成条件
成键方式
成键原因
含离子键的化合物
只含共价键的化合物
离子键
分子内是共价键
强碱、大多数盐、活泼金属的氧化物
酸、非金属氧化物、非金属的氢化物
熔融或水溶液导电
熔融时不导电、水溶液部分导电
破坏离子键
破坏分子间作用力,不破坏共价键
2.离子化合物与共价化合物的区别
归纳总结
离子化合物 共价化合物
概念
化学键类型
导电性
熔化时破坏
的作用力
实例
一、化学键: 1、定义 2、分类
离子键和共价键
(1)离子键:阴、阳离子之间通过静电作用形成的化学键
(2)共价键:原子间通过共用电子形成的化学键。
二、离子化合物和共价化合物
(1)离子化合物:含有离子键的化合物。
(2)共价化合物:只含有共价键的化合物。
三、化学反应的实质:旧化学键断裂和新化学键形成。
1.下列说法中正确的是( ) A.两个原子或多个原子之间的相互作用叫做化学键 B.阴、阳离子通过静电引力而形成的化学键叫做离子键 C.只有金属元素和非金属元素化合时才能形成离子键 D.大多数的盐、碱和低价金属氧化物中含有离子键
D
2.下列性质中,可以证明其化合物内一定存在离子
键的是( )
A.水溶液能导电
B.由金属和非金属元素的原子构成
C.熔融状态能导电
D.可以溶于水
C
3.判断下列化合物是离子化合物还是共价化合物
离子化合物
共价化合物
CaCl2
SO2
H2O
FeO
NaOH
NH3
CuSO4
HCl
