鲁科化学必修2第二章2化学反应的快慢和限度(共18张PPT)
文档属性
| 名称 | 鲁科化学必修2第二章2化学反应的快慢和限度(共18张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 940.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-11 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第二节 化学反应的快慢和限度
知识目标:
1、理解可逆反应的概念
2、理解化学平衡的特征,即“逆、等、动、定、变”,
建立化学平衡的观点,认识化学反应的进行是有一定限度的。
重点:
1、可逆反应的特点
2、化学平衡的概念
3、化学平衡状态的标志
难点:
化学平衡的建立。
第二章 第二节 化学反应的快慢和限度
联想质疑:
我们身边有许多限度问题:比如弹簧拉伸的限度、
资源开发的限度、邮寄包裹时重量尺寸也有一个限度。
许多城市对汽车的行驶流量也提出了限度的问题。
汽油不完全燃烧产生CO。人体吸进含有CO的空气后,
达到一定的限度,将对人体的健康造成危害。
为什么呢?那就来感受一下新课吧?
第二章 第二节 化学反应的快慢和限度
不规则氯化钠
规则氯化钠
质量未变
饱和氯化钠溶液
NaCl(s)
溶解
结晶
Na+(aq) + Cl-(aq)
“动态平衡”
“限度”
第二章 第二节 化学反应的快慢和限度
认为停止:没有更多的固体溶解
提出质疑:有可能一边溶解、一边结晶?
第二章 第二节 化学反应的快慢和限度
问题4:①:2H2+O2=2H2O 2H2O= 2H2+O2
这两个反应是否是可逆反应?
问题5:试写出氮气与氢气合成氨的化学方程式
(注意可逆反应的表达方法与条件)?
看课本分析什么是正反应?什么是逆反应?
第二章 第二节 化学反应的快慢和限度
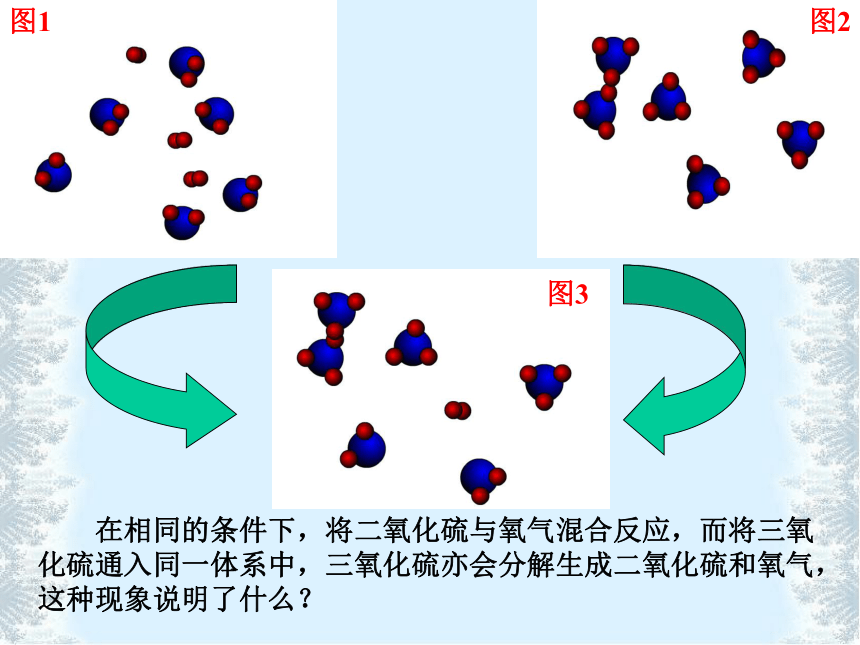
在相同的条件下,将二氧化硫与氧气混合反应,而将三氧化硫通入同一体系中,三氧化硫亦会分解生成二氧化硫和氧气,这种现象说明了什么?
图1
图2
图3
一 、可逆反应
1. 可逆反应的概念在相同条件下,同时向正、
反两个方向进行的反应称为可逆反应 。
2. 可逆反应的特点 ① 反应物和生成物共存;
② 正反应和逆反应共存;
③ 反应不能进行到底。
第二章 第二节 化学反应的快慢和限度
问题6:如何证明2Fe3+ + 2 I- → 2 Fe2+ + I2
是可逆反应?
提出质疑:如何保证测到的物质是可逆反应的结果,
而不是未完全参加反应的结果?请你利用下
列实验用品设计实验证明上述反应为可逆反应。
第二章 第二节 化学反应的快慢和限度
实验用品
0.1mol/L的KI溶液、0.1mol/LFeCl3、
0.1mol/L的FeCl2溶液、0.1mol/L I2
KSCN溶液、CCl4、试管、烧杯
分析表格中的数据回答下列问题:
问题7:正逆反应速率由什么决定?
问题8:各物质浓度的变化说明了什么
问题9:能得到正逆反应的瞬时速率吗?
问题10:用不同物质表示,结论一样吗?
第二章 第二节 化学反应的快慢和限度
二、化学平衡:
讨论:
分析上表,二氧化硫与氧气发生的可逆反应中,发应物
与生成物的浓度发生了哪些变化?
50分钟后,是不是反应停滞,不再反应了?为什么?
第二章 第二节 化学反应的快慢和限度
时间
(min)
物质的量
浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 10 7 5 3.5 2 1 1 1
O2 5 3.5 2.5 1.75 1 0.5 0.5 0.5
SO3 0 3 5 6.5 8 9 9 9
结论:
正反应与逆反应都在进行,只是在同一瞬间,
正反应生成的三氧化硫的物质的量与逆反应消耗的
三氧化硫的物质的量相等,表现在数据上,就是各
组分的浓度不再发生变化。
第二章 第二节 化学反应的快慢和限度
化学平衡状态:
一定条件下的可逆反应里,当反应进行到一定程度,正反应速率等于逆反应速率,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态
此状态特征:
(1)一定条件下的可逆反应 逆
(2)ν正=ν逆≠0 等
(4)反应物和生成物的浓度不再发生变化 定
(3) 平衡 动
第二章 第二节 化学反应的快慢和限度
1.对于可逆反应2SO2+O2?2SO3,在混合气体中充入
一定量 的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中
第二章 第二节 化学反应的快慢和限度
D
2. 在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),
已知反应过程中某一时刻,SO2、O2、SO3的浓度分别
为0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,
可能存在的数据是
A.SO2:0.4mol/L O2:0.2mol/L
B.SO2:0.25mol/L
C.SO2:0.15mol/L SO3:0.15mol/L
D.SO3:0.4mol/L
B
第二章 第二节 化学反应的快慢和限度
3. 在一个固定容积的密闭容器中,可逆反应:
N2+3H2 2NH3,达到平衡的标志是 。
① 反应速率v (N2):v (H2):v (NH3) = 1 : 3 : 2
② 氨气的体积分数不再改变
③ 体系的压强不再发生变化
④单位时间内3 mol H—H断键反应同时2 mol N—H也断键反应
⑤ C(N2)=C(NH3)
⑥ 2 v (N2正)= v (NH3逆)
⑦混合气体的密度不变混合气
⑧混合气体的平均相对分子质量不再改变
第二章 第二节 化学反应的快慢和限度
②③⑥⑧
知识应用:
问题14:Cl2与H2O的反应是可逆反应吗?如何证明?
第二章 第二节 化学反应的快慢和限度
拓展延伸
问题15:打开冰镇啤酒把啤酒倒入玻璃杯,杯中立即泛
起大量气泡,这是为什么?
问题16:秋高气爽,是火灾的多发季节。发生火灾时,
由于不完全燃烧,产生大量的一氧化碳,人体
吸入就会引起血红蛋白中毒而窒息。若你在现场,
你将如何对中毒患者采取急救措施呢?
一氧化碳中毒的主要原因是什么?
第二章 第二节 化学反应的快慢和限度
第二节 化学反应的快慢和限度
知识目标:
1、理解可逆反应的概念
2、理解化学平衡的特征,即“逆、等、动、定、变”,
建立化学平衡的观点,认识化学反应的进行是有一定限度的。
重点:
1、可逆反应的特点
2、化学平衡的概念
3、化学平衡状态的标志
难点:
化学平衡的建立。
第二章 第二节 化学反应的快慢和限度
联想质疑:
我们身边有许多限度问题:比如弹簧拉伸的限度、
资源开发的限度、邮寄包裹时重量尺寸也有一个限度。
许多城市对汽车的行驶流量也提出了限度的问题。
汽油不完全燃烧产生CO。人体吸进含有CO的空气后,
达到一定的限度,将对人体的健康造成危害。
为什么呢?那就来感受一下新课吧?
第二章 第二节 化学反应的快慢和限度
不规则氯化钠
规则氯化钠
质量未变
饱和氯化钠溶液
NaCl(s)
溶解
结晶
Na+(aq) + Cl-(aq)
“动态平衡”
“限度”
第二章 第二节 化学反应的快慢和限度
认为停止:没有更多的固体溶解
提出质疑:有可能一边溶解、一边结晶?
第二章 第二节 化学反应的快慢和限度
问题4:①:2H2+O2=2H2O 2H2O= 2H2+O2
这两个反应是否是可逆反应?
问题5:试写出氮气与氢气合成氨的化学方程式
(注意可逆反应的表达方法与条件)?
看课本分析什么是正反应?什么是逆反应?
第二章 第二节 化学反应的快慢和限度
在相同的条件下,将二氧化硫与氧气混合反应,而将三氧化硫通入同一体系中,三氧化硫亦会分解生成二氧化硫和氧气,这种现象说明了什么?
图1
图2
图3
一 、可逆反应
1. 可逆反应的概念在相同条件下,同时向正、
反两个方向进行的反应称为可逆反应 。
2. 可逆反应的特点 ① 反应物和生成物共存;
② 正反应和逆反应共存;
③ 反应不能进行到底。
第二章 第二节 化学反应的快慢和限度
问题6:如何证明2Fe3+ + 2 I- → 2 Fe2+ + I2
是可逆反应?
提出质疑:如何保证测到的物质是可逆反应的结果,
而不是未完全参加反应的结果?请你利用下
列实验用品设计实验证明上述反应为可逆反应。
第二章 第二节 化学反应的快慢和限度
实验用品
0.1mol/L的KI溶液、0.1mol/LFeCl3、
0.1mol/L的FeCl2溶液、0.1mol/L I2
KSCN溶液、CCl4、试管、烧杯
分析表格中的数据回答下列问题:
问题7:正逆反应速率由什么决定?
问题8:各物质浓度的变化说明了什么
问题9:能得到正逆反应的瞬时速率吗?
问题10:用不同物质表示,结论一样吗?
第二章 第二节 化学反应的快慢和限度
二、化学平衡:
讨论:
分析上表,二氧化硫与氧气发生的可逆反应中,发应物
与生成物的浓度发生了哪些变化?
50分钟后,是不是反应停滞,不再反应了?为什么?
第二章 第二节 化学反应的快慢和限度
时间
(min)
物质的量
浓度(mol/L) 0 10 20 30 40 50 60 70
SO2 10 7 5 3.5 2 1 1 1
O2 5 3.5 2.5 1.75 1 0.5 0.5 0.5
SO3 0 3 5 6.5 8 9 9 9
结论:
正反应与逆反应都在进行,只是在同一瞬间,
正反应生成的三氧化硫的物质的量与逆反应消耗的
三氧化硫的物质的量相等,表现在数据上,就是各
组分的浓度不再发生变化。
第二章 第二节 化学反应的快慢和限度
化学平衡状态:
一定条件下的可逆反应里,当反应进行到一定程度,正反应速率等于逆反应速率,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态
此状态特征:
(1)一定条件下的可逆反应 逆
(2)ν正=ν逆≠0 等
(4)反应物和生成物的浓度不再发生变化 定
(3) 平衡 动
第二章 第二节 化学反应的快慢和限度
1.对于可逆反应2SO2+O2?2SO3,在混合气体中充入
一定量 的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中
第二章 第二节 化学反应的快慢和限度
D
2. 在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),
已知反应过程中某一时刻,SO2、O2、SO3的浓度分别
为0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,
可能存在的数据是
A.SO2:0.4mol/L O2:0.2mol/L
B.SO2:0.25mol/L
C.SO2:0.15mol/L SO3:0.15mol/L
D.SO3:0.4mol/L
B
第二章 第二节 化学反应的快慢和限度
3. 在一个固定容积的密闭容器中,可逆反应:
N2+3H2 2NH3,达到平衡的标志是 。
① 反应速率v (N2):v (H2):v (NH3) = 1 : 3 : 2
② 氨气的体积分数不再改变
③ 体系的压强不再发生变化
④单位时间内3 mol H—H断键反应同时2 mol N—H也断键反应
⑤ C(N2)=C(NH3)
⑥ 2 v (N2正)= v (NH3逆)
⑦混合气体的密度不变混合气
⑧混合气体的平均相对分子质量不再改变
第二章 第二节 化学反应的快慢和限度
②③⑥⑧
知识应用:
问题14:Cl2与H2O的反应是可逆反应吗?如何证明?
第二章 第二节 化学反应的快慢和限度
拓展延伸
问题15:打开冰镇啤酒把啤酒倒入玻璃杯,杯中立即泛
起大量气泡,这是为什么?
问题16:秋高气爽,是火灾的多发季节。发生火灾时,
由于不完全燃烧,产生大量的一氧化碳,人体
吸入就会引起血红蛋白中毒而窒息。若你在现场,
你将如何对中毒患者采取急救措施呢?
一氧化碳中毒的主要原因是什么?
第二章 第二节 化学反应的快慢和限度
