7.2.4酸和碱的反应-课件(共24张PPT)
文档属性
| 名称 | 7.2.4酸和碱的反应-课件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 20:55:52 | ||
图片预览




文档简介
(共24张PPT)
吃碱面时,放点
醋,味道会更美。
被蚊虫叮咬,涂抹弱碱性物质可减轻酸痛。
食用皮蛋时加点
食醋可除去涩味
你明白其中的道理吗?
常见的酸和碱
中和反应
学习目标
1.认识酸和碱之间发生的中和反应。
2.了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用。
3.会根据中和反应时温度变化和酸碱性的变化,判断反映情况
。
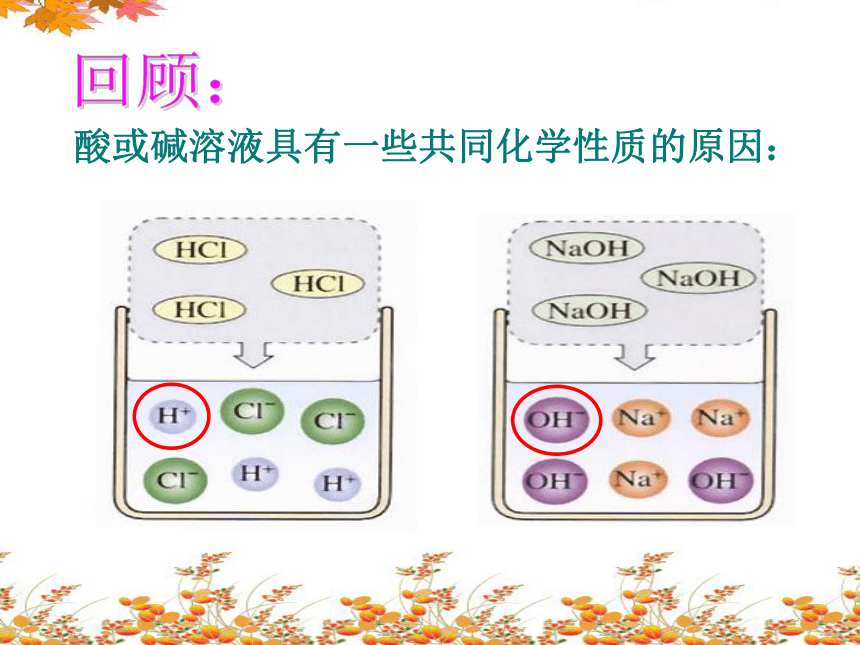
酸或碱溶液具有一些共同化学性质的原因:
回顾:
2.稀盐酸与氢氧化钠溶液混合
实验
1.稀盐酸与氢氧化铜溶液混合
观察到的现象:
得出的结论:
探究一:
酸和碱会发生反应吗?
检验反应物是否明显减少
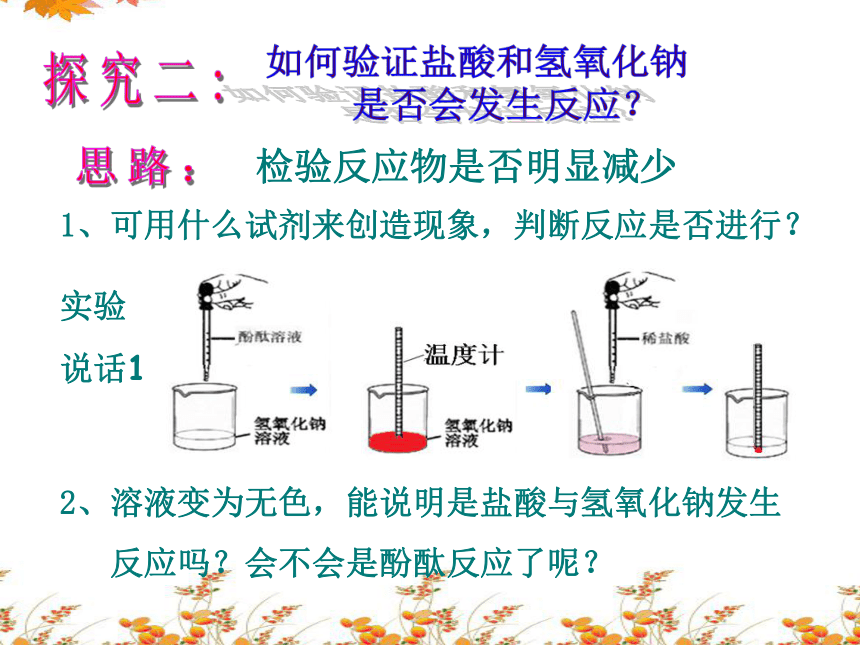
探究二:
如何验证盐酸和氢氧化钠
是否会发生反应?
思路:
实验
说话1
1、可用什么试剂来创造现象,判断反应是否进行?
2、溶液变为无色,能说明是盐酸与氢氧化钠发生
反应吗?会不会是酚酞反应了呢?
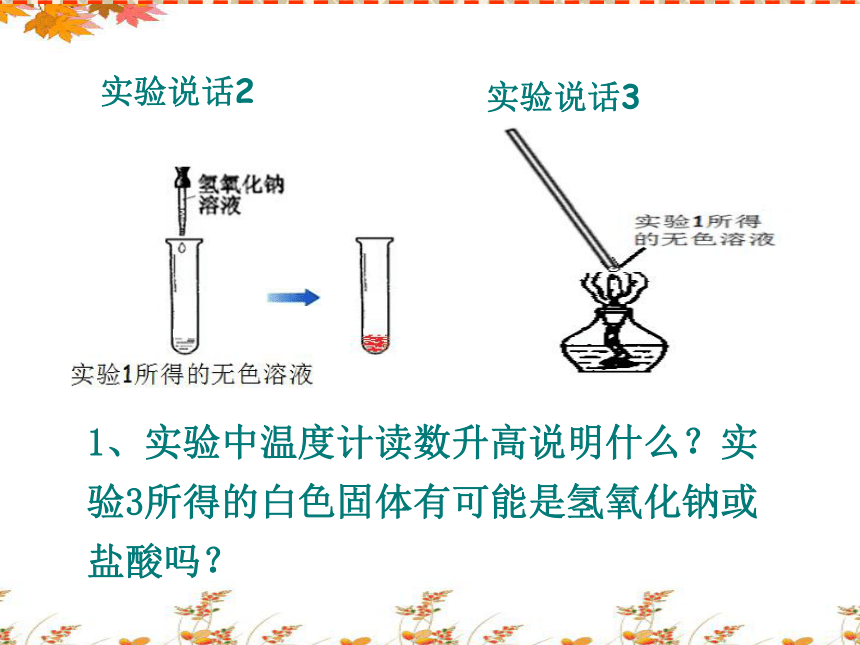
实验说话3
实验说话2
1、实验中温度计读数升高说明什么?实验3所得的白色固体有可能是氢氧化钠或盐酸吗?
OH-
Na+
H+
Cl-
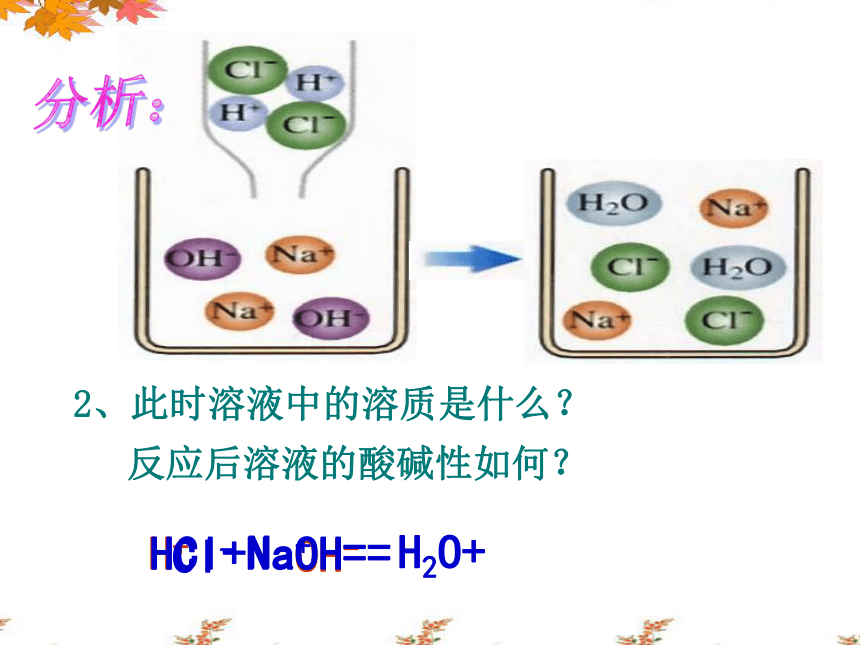
HCl+NaOH==
H2O+
2、此时溶液中的溶质是什么?
分析:
反应后溶液的酸碱性如何?
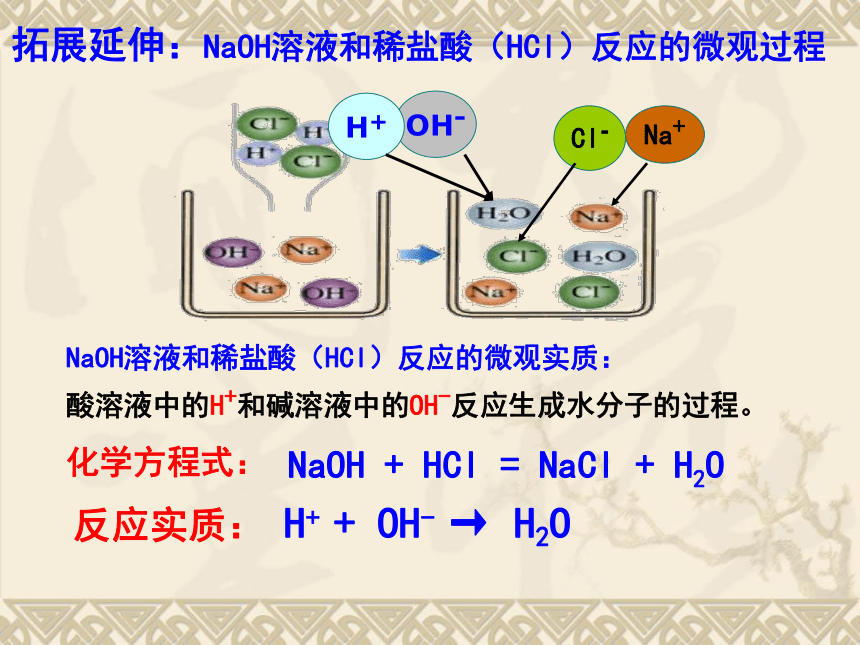
拓展延伸:NaOH溶液和稀盐酸(HCl)反应的微观过程
化学方程式:
NaOH
+
HCl
=
NaCl
+
H2O
反应实质:
H+
+
OH-
→
H2O
酸溶液中的H+和碱溶液中的OH-反应生成水分子的过程。
NaOH溶液和稀盐酸(HCl)反应的微观实质:
OH-
H+
Na+
Cl-
NaOH
+
HCl
=
NaCl
+
H2O
碱
酸
水
盐
金属离子
酸根离子
上页
下页
盐是金属离子(NH+)和酸根
离子组成的化合物
归纳:
中和反应
H+
+
OHˉ=
H2O
1、中和反应是酸与碱作用生成盐和水的
反应。反应过程中放出热量。
2、酸与碱反应的结果是酸和碱各自的特
性都消失···
HCl
+
NaOH
=
NaCl
+
H2O
3、中和反应属于复分解反应
1.写出下列反应的化学方程式。
(1)盐酸(HCl)与氢氧化钙〔Ca(OH)2
〕反应
(2)硫酸(H2SO4)与氢氧化钠(NaOH)反应
(3)硫酸(H2SO4)与氢氧化钡〔
Ba(OH)2
〕反应
2NaOH+H2SO4
=
Na2SO4+2H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
H2SO4
+Ba(OH)2
=
BaSO4↓
+H2O
交流与讨论:
2.下面给出几种盐的化学式,请说明它们可以用哪些酸和碱反应得到。
氯化钾
(KCl)
硝酸钠(NaNO3)
硫酸钙(CaSO4)
交流与讨论:
三、中和反应的实际应用
1、调节土壤的酸碱性
如向酸性土壤中加入熟石灰或施加稀氨水可以使土壤的酸性降低;可用碳酸水改良碱性土壤。
例如,某硝酸(HNO3)
厂附近的土地因工业污染,土壤中含有硝酸,不利于作物的生长,周围的农民为此向土壤中撒适量的熟石灰。
你能用化学方程式表达出它的原理么?
胃乐说明书
[药品名称]
胃乐胶囊
[性状]
本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分]
氢氧化铝[Al(OH)3
]、甘草提取物、白芨、木香等
[药理作用]
中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治]
用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心呕吐,气滞引起的胃腕疼痛。
[用法与用量]
口服,一次2~3粒,一日3次,空腹服用
[规格]
0.4g/粒
[贮藏]
密封,置干燥阴凉处
[包装]
20粒/盒
[有效期]
两年
胶
囊
胃
乐
2、用于医药
试用方程式表示出胃乐胶囊治疗胃酸过多的原理:
Al(OH)3+3HCl
=
AlCl3
+
3H2O
3、处理工厂排放的酸性或碱性废水
或处理实验室里的酸、碱性废液。
H2SO4+2NH3·H2O
=(NH4)2SO4+2H2O
污
水
处
理
有些化工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥——硫酸铵〔(NH4)2SO4
〕,试写出该反应的化学方程式:
(1)洗发时,先用洗发剂(弱碱性)洗净头发,再用护发素(弱酸性)护理,调节头发的酸碱平衡。
4、日常生活
(2)被蚂蚁、蚊子叮咬后,昆虫分泌的酸性物质进入肌肉,使肌肉酸痛,涂上稀氨水或肥皂水等物质可以止痛消肿,你知道其中的道理吗?
归纳整理
1.农业
2.工业
3.医疗
中和反应在实际中的应用
4.生活
中和
反应
定义
实质
应用
课堂小结
练习检测
2.下列关于中和反应的说法错误的是(
)
A.中和反应要放出热量
B.中和反应一定有盐生成
C.中和反应一定有水生成
D.酸碱中和反应完全后溶液的pH=0
3.鱼的味道鲜美,但是剖鱼时不慎弄破鱼胆,胆汁沾在鱼肉上,
便有苦味,产生苦味的是胆汁酸,其pH约为6,且难溶于水。
则在沾有胆汁的地方涂上下列物质可消除苦味的是( )
A.食醋
B.纯碱溶液 C.食盐水 D.自来水
1.在下列反应中,属于中和反应是(
)
A.MgO+2HCl==MgCl2+H2O
B.CO2+Ca(OH)2==CaCO3↓+2H2O
C.2KOH+H2SO4==K2SO4+2H2O
D.Fe
+
H2SO4
=
FeSO4
+
H2↑
B
D
B
(1)能产生气泡的是_____________(填序号)。
(2)能证明C中发生反应的现象是______________。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是_______________________
(2018年北京)4.进行如下微型实验,研究物质的性质。
Cu的活动性排在氢后,所以不与稀盐酸反应。
BD
红色溶液变为无色
(2015北京)5.下列物质常用于改良酸性土壤的是(
)
A.熟石灰
B.烧碱
C.食盐
D大理石
(2018上海)6.向盛有氢氧化钠溶液的烧杯中滴加稀硫酸,对反应前后烧杯中溶液分析错误的是(
)
A.
颜色改变
B.
温度升高
C.
碱性减弱
D.
质量增加
(2019上海)7.25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是(
)
A.
T=25℃
pH=7
B.
T=25℃
1≤pH≤13
C.
T>25℃
pH=14
D.
T>25℃
1A
A
D
1、生成盐和水的反应不一定是中和反应,
中和反应的反应物必须是酸和碱。
提醒:
2、中和反应后所得的溶液不一定是中性的。
课堂小结
吃碱面时,放点
醋,味道会更美。
被蚊虫叮咬,涂抹弱碱性物质可减轻酸痛。
食用皮蛋时加点
食醋可除去涩味
你明白其中的道理吗?
常见的酸和碱
中和反应
学习目标
1.认识酸和碱之间发生的中和反应。
2.了解酸碱性对生命活动和农作物的影响,以及中和反应在实际中的应用。
3.会根据中和反应时温度变化和酸碱性的变化,判断反映情况
。
酸或碱溶液具有一些共同化学性质的原因:
回顾:
2.稀盐酸与氢氧化钠溶液混合
实验
1.稀盐酸与氢氧化铜溶液混合
观察到的现象:
得出的结论:
探究一:
酸和碱会发生反应吗?
检验反应物是否明显减少
探究二:
如何验证盐酸和氢氧化钠
是否会发生反应?
思路:
实验
说话1
1、可用什么试剂来创造现象,判断反应是否进行?
2、溶液变为无色,能说明是盐酸与氢氧化钠发生
反应吗?会不会是酚酞反应了呢?
实验说话3
实验说话2
1、实验中温度计读数升高说明什么?实验3所得的白色固体有可能是氢氧化钠或盐酸吗?
OH-
Na+
H+
Cl-
HCl+NaOH==
H2O+
2、此时溶液中的溶质是什么?
分析:
反应后溶液的酸碱性如何?
拓展延伸:NaOH溶液和稀盐酸(HCl)反应的微观过程
化学方程式:
NaOH
+
HCl
=
NaCl
+
H2O
反应实质:
H+
+
OH-
→
H2O
酸溶液中的H+和碱溶液中的OH-反应生成水分子的过程。
NaOH溶液和稀盐酸(HCl)反应的微观实质:
OH-
H+
Na+
Cl-
NaOH
+
HCl
=
NaCl
+
H2O
碱
酸
水
盐
金属离子
酸根离子
上页
下页
盐是金属离子(NH+)和酸根
离子组成的化合物
归纳:
中和反应
H+
+
OHˉ=
H2O
1、中和反应是酸与碱作用生成盐和水的
反应。反应过程中放出热量。
2、酸与碱反应的结果是酸和碱各自的特
性都消失···
HCl
+
NaOH
=
NaCl
+
H2O
3、中和反应属于复分解反应
1.写出下列反应的化学方程式。
(1)盐酸(HCl)与氢氧化钙〔Ca(OH)2
〕反应
(2)硫酸(H2SO4)与氢氧化钠(NaOH)反应
(3)硫酸(H2SO4)与氢氧化钡〔
Ba(OH)2
〕反应
2NaOH+H2SO4
=
Na2SO4+2H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
H2SO4
+Ba(OH)2
=
BaSO4↓
+H2O
交流与讨论:
2.下面给出几种盐的化学式,请说明它们可以用哪些酸和碱反应得到。
氯化钾
(KCl)
硝酸钠(NaNO3)
硫酸钙(CaSO4)
交流与讨论:
三、中和反应的实际应用
1、调节土壤的酸碱性
如向酸性土壤中加入熟石灰或施加稀氨水可以使土壤的酸性降低;可用碳酸水改良碱性土壤。
例如,某硝酸(HNO3)
厂附近的土地因工业污染,土壤中含有硝酸,不利于作物的生长,周围的农民为此向土壤中撒适量的熟石灰。
你能用化学方程式表达出它的原理么?
胃乐说明书
[药品名称]
胃乐胶囊
[性状]
本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分]
氢氧化铝[Al(OH)3
]、甘草提取物、白芨、木香等
[药理作用]
中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治]
用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心呕吐,气滞引起的胃腕疼痛。
[用法与用量]
口服,一次2~3粒,一日3次,空腹服用
[规格]
0.4g/粒
[贮藏]
密封,置干燥阴凉处
[包装]
20粒/盒
[有效期]
两年
胶
囊
胃
乐
2、用于医药
试用方程式表示出胃乐胶囊治疗胃酸过多的原理:
Al(OH)3+3HCl
=
AlCl3
+
3H2O
3、处理工厂排放的酸性或碱性废水
或处理实验室里的酸、碱性废液。
H2SO4+2NH3·H2O
=(NH4)2SO4+2H2O
污
水
处
理
有些化工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥——硫酸铵〔(NH4)2SO4
〕,试写出该反应的化学方程式:
(1)洗发时,先用洗发剂(弱碱性)洗净头发,再用护发素(弱酸性)护理,调节头发的酸碱平衡。
4、日常生活
(2)被蚂蚁、蚊子叮咬后,昆虫分泌的酸性物质进入肌肉,使肌肉酸痛,涂上稀氨水或肥皂水等物质可以止痛消肿,你知道其中的道理吗?
归纳整理
1.农业
2.工业
3.医疗
中和反应在实际中的应用
4.生活
中和
反应
定义
实质
应用
课堂小结
练习检测
2.下列关于中和反应的说法错误的是(
)
A.中和反应要放出热量
B.中和反应一定有盐生成
C.中和反应一定有水生成
D.酸碱中和反应完全后溶液的pH=0
3.鱼的味道鲜美,但是剖鱼时不慎弄破鱼胆,胆汁沾在鱼肉上,
便有苦味,产生苦味的是胆汁酸,其pH约为6,且难溶于水。
则在沾有胆汁的地方涂上下列物质可消除苦味的是( )
A.食醋
B.纯碱溶液 C.食盐水 D.自来水
1.在下列反应中,属于中和反应是(
)
A.MgO+2HCl==MgCl2+H2O
B.CO2+Ca(OH)2==CaCO3↓+2H2O
C.2KOH+H2SO4==K2SO4+2H2O
D.Fe
+
H2SO4
=
FeSO4
+
H2↑
B
D
B
(1)能产生气泡的是_____________(填序号)。
(2)能证明C中发生反应的现象是______________。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是_______________________
(2018年北京)4.进行如下微型实验,研究物质的性质。
Cu的活动性排在氢后,所以不与稀盐酸反应。
BD
红色溶液变为无色
(2015北京)5.下列物质常用于改良酸性土壤的是(
)
A.熟石灰
B.烧碱
C.食盐
D大理石
(2018上海)6.向盛有氢氧化钠溶液的烧杯中滴加稀硫酸,对反应前后烧杯中溶液分析错误的是(
)
A.
颜色改变
B.
温度升高
C.
碱性减弱
D.
质量增加
(2019上海)7.25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是(
)
A.
T=25℃
pH=7
B.
T=25℃
1≤pH≤13
C.
T>25℃
pH=14
D.
T>25℃
1
A
D
1、生成盐和水的反应不一定是中和反应,
中和反应的反应物必须是酸和碱。
提醒:
2、中和反应后所得的溶液不一定是中性的。
课堂小结
