第7章 应用广泛的酸、碱、盐章节复习第一课时-课件(共34张PPT)
文档属性
| 名称 | 第7章 应用广泛的酸、碱、盐章节复习第一课时-课件(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 496.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 21:02:04 | ||
图片预览








文档简介
(共34张PPT)
第七章
应用广泛的酸、碱、盐
复习课件
0
知识网络
应用广泛的酸碱盐
溶液的酸碱性
几种重要的盐
酸性溶液和碱性溶液:酸碱指示剂
溶液酸碱性的强弱:pH值
常见的酸:盐酸、硫酸
化学肥料:种类及作用
溶液酸碱性与生命活动的关系
常见的酸和碱
常见的碱:氢氧化钠、氢氧化钙
中和反应:酸与碱反应生成盐和水
几种常见的盐:性质及用途
盐:分类及性质
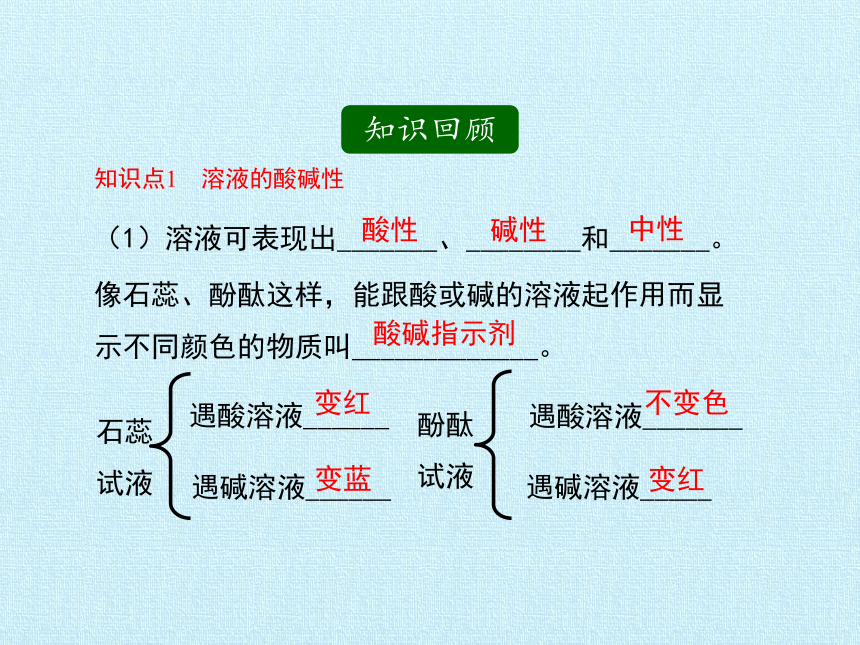
知识回顾
知识点1 溶液的酸碱性
像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。
遇酸溶液______
遇碱溶液______
酚酞试液
遇酸溶液_______
遇碱溶液_____
石蕊试液
酸碱指示剂
变红
变蓝
不变色
变红
(1)溶液可表现出_______、________和_______。
酸性
碱性
中性
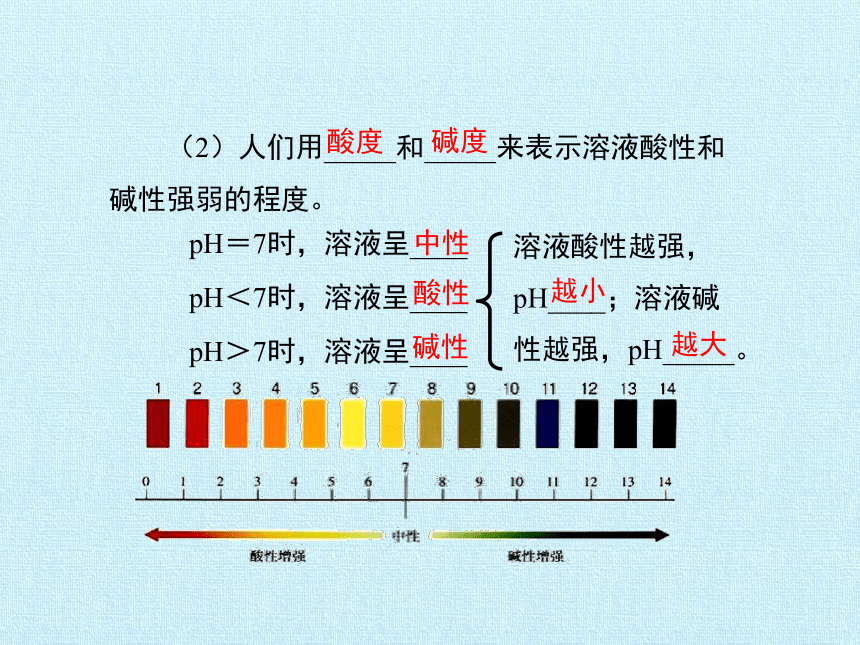
(2)人们用_____和_____来表示溶液酸性和碱性强弱的程度。
pH=7时,溶液呈____
pH<7时,溶液呈____
pH>7时,溶液呈____
溶液酸性越强,pH____;溶液碱性越强,pH_____。
越小
越大
中性
酸性
碱性
酸度
碱度
(3)①健康人的体液pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现__________或__________。
②大多数的农作物适宜在接近______(pH在6.5~7.5之间)的土壤中生长,酸性太强或碱性太强的土壤都不适宜作物的生长。
③雨水一般呈弱酸性(由于空气中的二氧化碳溶解在雨水中),人们一般把pH_______的雨水称为______。
酸中毒
碱中毒
中性
酸雨
小于5.6
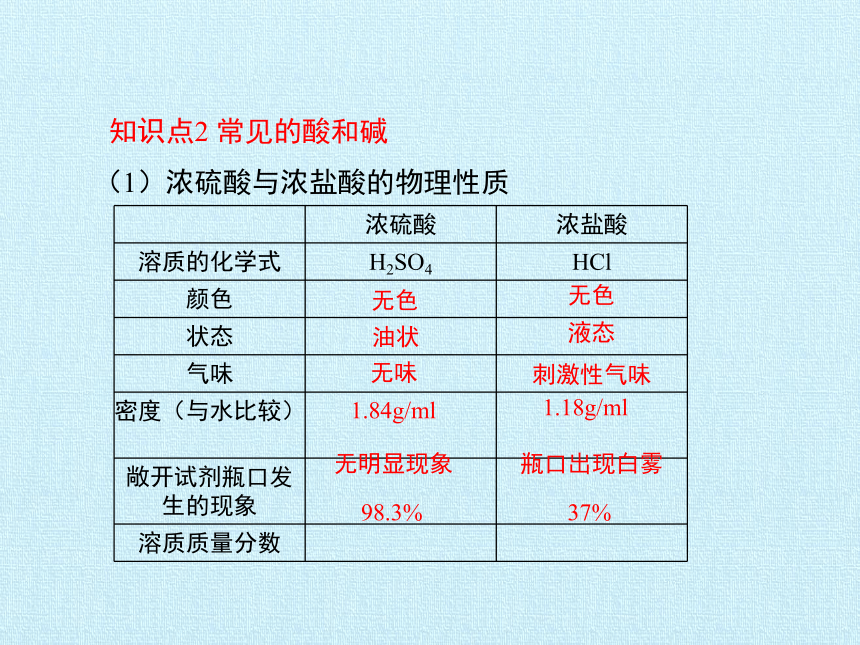
知识点2
常见的酸和碱
(1)浓硫酸与浓盐酸的物理性质
浓硫酸
浓盐酸
溶质的化学式
H2SO4
HCl
颜色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
溶质质量分数
无色
油状
无味
1.84g/ml
无明显现象
无色
液态
刺激性气味
1.18g/ml
瓶口出现白雾
98.3%
37%
实验内容
现象与结论
将镁、锌、铁、铜分别放入稀盐酸、稀硫酸中
稀盐酸、稀硫酸
分别与铁锈作用
稀盐酸与石灰石作用
稀硫酸与稀盐酸的化学性质
除铜外,有气泡产生,反应速率:镁>锌>铁
铁锈溶解,溶液变黄
石灰石溶解,有气泡产生
盐酸、稀硫酸、硝酸和醋酸溶液中都含有大量的___________,所以酸溶液具有相似的化学性质。
氢离子(H+)
金属单质与酸溶液能否发生置换反应,发生反应的剧烈程度,可说明金属活动性强弱。
金属的活动性顺序表:
在金属活动性顺序表中,排在____前面的金属能与稀盐酸(稀硫酸)发生置换反应,排在后面的则不能。
氢
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,沿着烧杯壁缓缓倾倒并用玻璃棒不断搅拌。
注意:①浓硫酸溅到皮肤或衣物上的处理:立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液;②浓硫酸有很强的吸水性,可作为_______。
干燥剂
(2)烧碱溶液、石灰水的化学性质
实验内容
现象与反应的化学方程式
在烧碱溶液中滴加硫酸铜溶液
在石灰水中滴加硫酸铜溶液
有蓝色沉淀生成
CuSO4
+
2NaOH
==
Na2SO4
+
Cu(OH)2↓
有蓝色沉淀生成
CuSO4
+
Ca(OH)2
==
CaSO4
+
Cu(OH)2↓
氢氧化钠、氢氧化钙在水溶液中都能产生
_______________,这使碱溶液具有相似的化学性质。
氢氧根离子(OH--)
CaO+H2O==Ca(OH)2
生石灰变成熟石灰是放热过程。生石灰具有强烈的吸水性,极易跟水反应。生石灰的这一特性可用作_________。
干燥剂
固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而_______。
变质
CuSO4与NaOH、Ca(OH)2反应时,两种化合物互相交换成分,生成两种新的化合物,这类反应称为_____________。
复分解反应
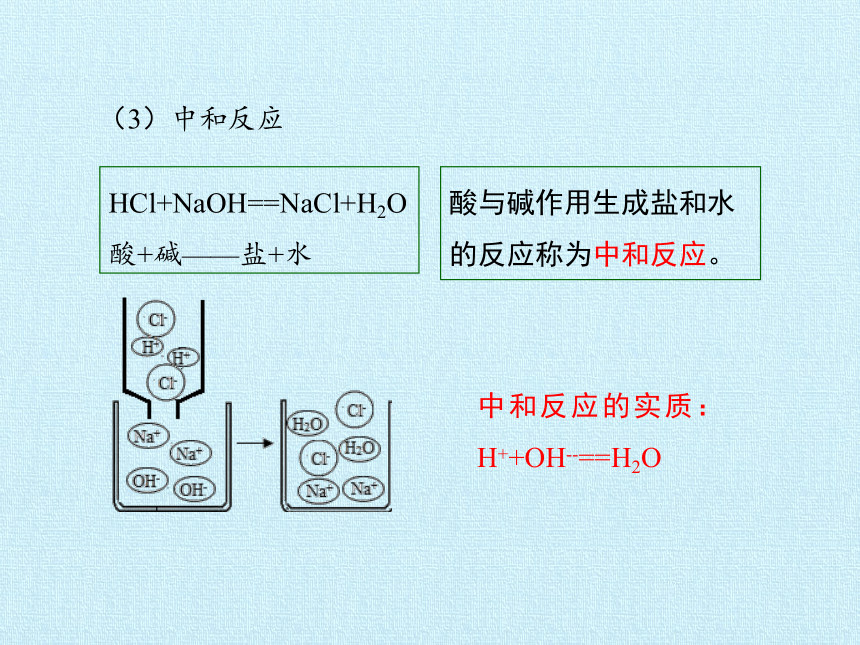
(3)中和反应
HCl+NaOH==NaCl+H2O
酸+碱——盐+水
酸与碱作用生成盐和水的反应称为中和反应。
中和反应的实质:H++OH--==H2O
知识点3
几种重要的盐
(1)盐的分类:依据组成盐的阳离子和酸根的种类进行分类
根据_______的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐)
根据______的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐)
阳离子
酸根
盐的化学性质:
①盐+金属→新盐+新金属,在金属活动性顺序表中,除非常活泼的金属外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中______出来。
如:Zn
+
CuSO4
==
ZnSO4
+
Cu
②某些盐溶液在一定条件下能与酸或碱发生_________如:CuSO4
+
Ca(OH)2
===
Cu(OH)2↓
+
CaSO4
置换
复分解反应
(2)几种常见的盐
名称
俗称
用途
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
无
纯碱
小苏打
无
生产氯气、烧碱,做调味品
玻璃、造纸、纺织和洗涤剂的生产等
焙制糕点、治疗胃酸过多
建筑材料、补钙剂
碳酸钠、碳酸氢钠、碳酸钙与盐酸反应都可生成二氧化碳气体,可依据这些反应进行碳酸盐的检验:
某物质
+HCl
产生气体
变浑浊
CO2
CaCO3
碳酸盐
+Ca(OH)2
(3)化学肥料
定义:通过_________生产的肥料,称作化学肥料。
化学加工
化学肥料的分类:_____、_____、_____、________。
氮肥
磷肥
钾肥
复合肥
铵态氮肥与碱混合加热,都有氨气放出,氨气有__________,能使湿润的红色石蕊试纸____,
这些可用于________________。
注意:氨态氮肥不可与__________________________等碱性物质混用,否则会降低肥效。
刺激性气味
变蓝
铵态氮肥的检验
熟石灰、草木灰(含碳酸钾)
(3)化学肥料
定义:通过_________生产的肥料,称作化学肥料。
化学加工
化学肥料的分类:_____、_____、_____、________。
氮肥
磷肥
钾肥
复合肥
铵态氮肥与碱混合加热,都有氨气放出,氨气有__________,能使湿润的红色石蕊试纸____,
这些可用于________________。
注意:氨态氮肥不可与__________________________等碱性物质混用,否则会降低肥效。
刺激性气味
变蓝
铵态氮肥的检验
熟石灰、草木灰(含碳酸钾)
?类型一 酸碱指示剂
命题角度:考查学生对酸碱指示剂的掌握情况。
例1某同学在晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该生先后所用的无色液体可能是(
)
A.石蕊试液、稀硫酸
B.酚酞试液、“雪碧”饮料
C.NaOH溶液、酚酞试剂
D.CuSO4溶液、NaOH溶液
例题解析
C
【解析】从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,CuSO4溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色。
故选C。
命题角度:考查学生对溶液酸碱度的认识
例2 一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是______,它能使紫色石蕊试液变成______色;
?类型二 pH值
苹果
食物
苹果
葡萄
牛奶
玉米
pH
2.9~3.3
3.5~4.5
6.3~6.6
6.8~8.0
红
(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸
【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色;
(2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水。
玉米
氢氧化铝
Al(OH)3+3HCl═AlCl3+3H2O
(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸
【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色;
(2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水。
玉米
氢氧化铝
Al(OH)3+3HCl═AlCl3+3H2O
命题角度:考查学生对常见酸的知识的掌握情况
例3生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?类型三 常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3+6HCl==2FeCl3+3H2O
有气泡产生
Fe+2HCl==FeCl2+H2↑
命题角度:考查学生对常见酸的知识的掌握情况
例3生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?类型三 常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3+6HCl==2FeCl3+3H2O
有气泡产生
Fe+2HCl==FeCl2+H2↑
【解析】铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,无色溶液变成黄色,反应的化学方程式为:Fe2O3+6HCl==2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应现象是有气泡产生,反应的化学方程式为:Fe+2HCl==FeCl2+H2↑。
命题角度:考查学生对常见碱的知识的掌握情况
例4
氢氧化钠有强烈的________性,所以它的俗名叫苛性钠、火碱或烧碱,氢氧化钠固体曝露在空气中时容易吸收水分而溶解,还易与空气中的____________发生反应而变质,其反应的化学方程式为:___________________________________。
?类型四 常见碱的性质和用途
腐蚀
二氧化碳
CO2+2NaOH==Na2CO3+H2O
【解析】氢氧化钠具有强烈的腐蚀性,易与空气中的二氧化碳反应生成碳酸钠和水而变质,化学方程式是:CO2+2NaOH==Na2CO3+H2O。
故答案为:腐蚀;二氧化碳(CO2);
CO2+2NaOH==Na2CO3+H2O。
命题角度:考查学生对中和反应的掌握情况。
例5下列反应中属于中和反应的是(
)
A.CaO+2HCl==CaCl2+H2O
B.Ca(OH)2+2HCl==CaCl2+2H2O
C.CaCO3+2HCl==CaCl2+H2O+CO2↑
D.2NaOH+CO2==Na2CO3+H2O
?类型五 酸与碱的中和反应
B
【解析】中和反应是酸与碱作用生成盐和水的反应,A.氧化钙与盐酸反应生成氯化钙和水,不是酸与碱的反应,不属于中和反应;B.氢氧化钙与盐酸反应生成氯化钙和水,反应物是酸和碱,生成物是盐和水,属于中和反应;C.碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,不是酸与碱的反应,不属于中和反应;D.氢氧化钠与二氧化碳反应生成氯化钠和水,不是酸与碱的反应,不属于中和反应。
故选B。
命题角度:考查学生对常见盐的知识的掌握情况。
例6下列实验现象描述正确的是(
)
A.氯化铜溶液中加入铁粉后,溶液颜色变为无色。
B.硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成。
C.硫酸铜溶液中滴加氢氧化钾溶液后,有蓝色沉淀生成。
D.酚酞试液中通入二氧化碳变红。
?类型六 常见盐的性质和用途
C
【解析】A.氯化铜加入铁粉会生成氯化亚铁溶液会变成浅绿色,故此选项错误;
B.铵盐遇碱会放出氨气,氨气有刺激性气味,故此选项错误;
C.硫酸铜能与氢氧化钾反应生成氢氧化铜沉淀,氢氧化铜是蓝色沉淀,故此选项正确;
D.酚酞遇碱性溶液会变红,二氧化碳通入到酚酞中不会生成碱,故此选项错误。
故选C。
命题角度:考查学生对化学肥料知识点的掌握情况
例7 下列关于化肥的说法中不正确的是(
)
A.铵盐不能与碱类物质混放或混用。
B.化肥对提高农作物产量具有重要作用,应尽量多施用。
C.复合肥料能同时均匀地供给作物几种养分,肥效高。
D.长期使用硫酸铵、硫酸钾会使土壤酸化、板结。
?类型七 化学肥料
B
【解析】A.铵盐与碱性物质发生酸碱中和反应,而不能混放和混用。故A正确;
B.化肥对提高农作物产量具有重要作用,但应适量施用.故B错误;
C.复合肥料能同时均匀地供给作物几种养分,肥效高.故C正确;
D.长期施用硫酸铵、硫酸钾会使土壤酸化、板结,应施些复合肥.故D正确;
故选B。
谢
谢
第七章
应用广泛的酸、碱、盐
复习课件
0
知识网络
应用广泛的酸碱盐
溶液的酸碱性
几种重要的盐
酸性溶液和碱性溶液:酸碱指示剂
溶液酸碱性的强弱:pH值
常见的酸:盐酸、硫酸
化学肥料:种类及作用
溶液酸碱性与生命活动的关系
常见的酸和碱
常见的碱:氢氧化钠、氢氧化钙
中和反应:酸与碱反应生成盐和水
几种常见的盐:性质及用途
盐:分类及性质
知识回顾
知识点1 溶液的酸碱性
像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。
遇酸溶液______
遇碱溶液______
酚酞试液
遇酸溶液_______
遇碱溶液_____
石蕊试液
酸碱指示剂
变红
变蓝
不变色
变红
(1)溶液可表现出_______、________和_______。
酸性
碱性
中性
(2)人们用_____和_____来表示溶液酸性和碱性强弱的程度。
pH=7时,溶液呈____
pH<7时,溶液呈____
pH>7时,溶液呈____
溶液酸性越强,pH____;溶液碱性越强,pH_____。
越小
越大
中性
酸性
碱性
酸度
碱度
(3)①健康人的体液pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现__________或__________。
②大多数的农作物适宜在接近______(pH在6.5~7.5之间)的土壤中生长,酸性太强或碱性太强的土壤都不适宜作物的生长。
③雨水一般呈弱酸性(由于空气中的二氧化碳溶解在雨水中),人们一般把pH_______的雨水称为______。
酸中毒
碱中毒
中性
酸雨
小于5.6
知识点2
常见的酸和碱
(1)浓硫酸与浓盐酸的物理性质
浓硫酸
浓盐酸
溶质的化学式
H2SO4
HCl
颜色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
溶质质量分数
无色
油状
无味
1.84g/ml
无明显现象
无色
液态
刺激性气味
1.18g/ml
瓶口出现白雾
98.3%
37%
实验内容
现象与结论
将镁、锌、铁、铜分别放入稀盐酸、稀硫酸中
稀盐酸、稀硫酸
分别与铁锈作用
稀盐酸与石灰石作用
稀硫酸与稀盐酸的化学性质
除铜外,有气泡产生,反应速率:镁>锌>铁
铁锈溶解,溶液变黄
石灰石溶解,有气泡产生
盐酸、稀硫酸、硝酸和醋酸溶液中都含有大量的___________,所以酸溶液具有相似的化学性质。
氢离子(H+)
金属单质与酸溶液能否发生置换反应,发生反应的剧烈程度,可说明金属活动性强弱。
金属的活动性顺序表:
在金属活动性顺序表中,排在____前面的金属能与稀盐酸(稀硫酸)发生置换反应,排在后面的则不能。
氢
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,沿着烧杯壁缓缓倾倒并用玻璃棒不断搅拌。
注意:①浓硫酸溅到皮肤或衣物上的处理:立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液;②浓硫酸有很强的吸水性,可作为_______。
干燥剂
(2)烧碱溶液、石灰水的化学性质
实验内容
现象与反应的化学方程式
在烧碱溶液中滴加硫酸铜溶液
在石灰水中滴加硫酸铜溶液
有蓝色沉淀生成
CuSO4
+
2NaOH
==
Na2SO4
+
Cu(OH)2↓
有蓝色沉淀生成
CuSO4
+
Ca(OH)2
==
CaSO4
+
Cu(OH)2↓
氢氧化钠、氢氧化钙在水溶液中都能产生
_______________,这使碱溶液具有相似的化学性质。
氢氧根离子(OH--)
CaO+H2O==Ca(OH)2
生石灰变成熟石灰是放热过程。生石灰具有强烈的吸水性,极易跟水反应。生石灰的这一特性可用作_________。
干燥剂
固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而_______。
变质
CuSO4与NaOH、Ca(OH)2反应时,两种化合物互相交换成分,生成两种新的化合物,这类反应称为_____________。
复分解反应
(3)中和反应
HCl+NaOH==NaCl+H2O
酸+碱——盐+水
酸与碱作用生成盐和水的反应称为中和反应。
中和反应的实质:H++OH--==H2O
知识点3
几种重要的盐
(1)盐的分类:依据组成盐的阳离子和酸根的种类进行分类
根据_______的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。(氯化钠为钠盐)
根据______的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。(氯化钠为盐酸盐)
阳离子
酸根
盐的化学性质:
①盐+金属→新盐+新金属,在金属活动性顺序表中,除非常活泼的金属外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中______出来。
如:Zn
+
CuSO4
==
ZnSO4
+
Cu
②某些盐溶液在一定条件下能与酸或碱发生_________如:CuSO4
+
Ca(OH)2
===
Cu(OH)2↓
+
CaSO4
置换
复分解反应
(2)几种常见的盐
名称
俗称
用途
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
无
纯碱
小苏打
无
生产氯气、烧碱,做调味品
玻璃、造纸、纺织和洗涤剂的生产等
焙制糕点、治疗胃酸过多
建筑材料、补钙剂
碳酸钠、碳酸氢钠、碳酸钙与盐酸反应都可生成二氧化碳气体,可依据这些反应进行碳酸盐的检验:
某物质
+HCl
产生气体
变浑浊
CO2
CaCO3
碳酸盐
+Ca(OH)2
(3)化学肥料
定义:通过_________生产的肥料,称作化学肥料。
化学加工
化学肥料的分类:_____、_____、_____、________。
氮肥
磷肥
钾肥
复合肥
铵态氮肥与碱混合加热,都有氨气放出,氨气有__________,能使湿润的红色石蕊试纸____,
这些可用于________________。
注意:氨态氮肥不可与__________________________等碱性物质混用,否则会降低肥效。
刺激性气味
变蓝
铵态氮肥的检验
熟石灰、草木灰(含碳酸钾)
(3)化学肥料
定义:通过_________生产的肥料,称作化学肥料。
化学加工
化学肥料的分类:_____、_____、_____、________。
氮肥
磷肥
钾肥
复合肥
铵态氮肥与碱混合加热,都有氨气放出,氨气有__________,能使湿润的红色石蕊试纸____,
这些可用于________________。
注意:氨态氮肥不可与__________________________等碱性物质混用,否则会降低肥效。
刺激性气味
变蓝
铵态氮肥的检验
熟石灰、草木灰(含碳酸钾)
?类型一 酸碱指示剂
命题角度:考查学生对酸碱指示剂的掌握情况。
例1某同学在晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该生先后所用的无色液体可能是(
)
A.石蕊试液、稀硫酸
B.酚酞试液、“雪碧”饮料
C.NaOH溶液、酚酞试剂
D.CuSO4溶液、NaOH溶液
例题解析
C
【解析】从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,CuSO4溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色。
故选C。
命题角度:考查学生对溶液酸碱度的认识
例2 一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是______,它能使紫色石蕊试液变成______色;
?类型二 pH值
苹果
食物
苹果
葡萄
牛奶
玉米
pH
2.9~3.3
3.5~4.5
6.3~6.6
6.8~8.0
红
(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸
【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色;
(2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水。
玉米
氢氧化铝
Al(OH)3+3HCl═AlCl3+3H2O
(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸
【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色;
(2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水。
玉米
氢氧化铝
Al(OH)3+3HCl═AlCl3+3H2O
命题角度:考查学生对常见酸的知识的掌握情况
例3生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?类型三 常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3+6HCl==2FeCl3+3H2O
有气泡产生
Fe+2HCl==FeCl2+H2↑
命题角度:考查学生对常见酸的知识的掌握情况
例3生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。
?类型三 常见酸的性质和用途
铁锈逐渐消失,无色溶液变成黄色
Fe2O3+6HCl==2FeCl3+3H2O
有气泡产生
Fe+2HCl==FeCl2+H2↑
【解析】铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,无色溶液变成黄色,反应的化学方程式为:Fe2O3+6HCl==2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应现象是有气泡产生,反应的化学方程式为:Fe+2HCl==FeCl2+H2↑。
命题角度:考查学生对常见碱的知识的掌握情况
例4
氢氧化钠有强烈的________性,所以它的俗名叫苛性钠、火碱或烧碱,氢氧化钠固体曝露在空气中时容易吸收水分而溶解,还易与空气中的____________发生反应而变质,其反应的化学方程式为:___________________________________。
?类型四 常见碱的性质和用途
腐蚀
二氧化碳
CO2+2NaOH==Na2CO3+H2O
【解析】氢氧化钠具有强烈的腐蚀性,易与空气中的二氧化碳反应生成碳酸钠和水而变质,化学方程式是:CO2+2NaOH==Na2CO3+H2O。
故答案为:腐蚀;二氧化碳(CO2);
CO2+2NaOH==Na2CO3+H2O。
命题角度:考查学生对中和反应的掌握情况。
例5下列反应中属于中和反应的是(
)
A.CaO+2HCl==CaCl2+H2O
B.Ca(OH)2+2HCl==CaCl2+2H2O
C.CaCO3+2HCl==CaCl2+H2O+CO2↑
D.2NaOH+CO2==Na2CO3+H2O
?类型五 酸与碱的中和反应
B
【解析】中和反应是酸与碱作用生成盐和水的反应,A.氧化钙与盐酸反应生成氯化钙和水,不是酸与碱的反应,不属于中和反应;B.氢氧化钙与盐酸反应生成氯化钙和水,反应物是酸和碱,生成物是盐和水,属于中和反应;C.碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,不是酸与碱的反应,不属于中和反应;D.氢氧化钠与二氧化碳反应生成氯化钠和水,不是酸与碱的反应,不属于中和反应。
故选B。
命题角度:考查学生对常见盐的知识的掌握情况。
例6下列实验现象描述正确的是(
)
A.氯化铜溶液中加入铁粉后,溶液颜色变为无色。
B.硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成。
C.硫酸铜溶液中滴加氢氧化钾溶液后,有蓝色沉淀生成。
D.酚酞试液中通入二氧化碳变红。
?类型六 常见盐的性质和用途
C
【解析】A.氯化铜加入铁粉会生成氯化亚铁溶液会变成浅绿色,故此选项错误;
B.铵盐遇碱会放出氨气,氨气有刺激性气味,故此选项错误;
C.硫酸铜能与氢氧化钾反应生成氢氧化铜沉淀,氢氧化铜是蓝色沉淀,故此选项正确;
D.酚酞遇碱性溶液会变红,二氧化碳通入到酚酞中不会生成碱,故此选项错误。
故选C。
命题角度:考查学生对化学肥料知识点的掌握情况
例7 下列关于化肥的说法中不正确的是(
)
A.铵盐不能与碱类物质混放或混用。
B.化肥对提高农作物产量具有重要作用,应尽量多施用。
C.复合肥料能同时均匀地供给作物几种养分,肥效高。
D.长期使用硫酸铵、硫酸钾会使土壤酸化、板结。
?类型七 化学肥料
B
【解析】A.铵盐与碱性物质发生酸碱中和反应,而不能混放和混用。故A正确;
B.化肥对提高农作物产量具有重要作用,但应适量施用.故B错误;
C.复合肥料能同时均匀地供给作物几种养分,肥效高.故C正确;
D.长期施用硫酸铵、硫酸钾会使土壤酸化、板结,应施些复合肥.故D正确;
故选B。
谢
谢
