第7章 应用广泛的酸、碱、盐 章节复习第二课时--课件(共28张PPT)
文档属性
| 名称 | 第7章 应用广泛的酸、碱、盐 章节复习第二课时--课件(共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 691.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 21:11:27 | ||
图片预览




文档简介
(共28张PPT)
应用广泛的酸碱盐
九年级化学第七章复习
(第二课时)
1、了解物质的分类方法,归纳酸、碱、盐的化学性质
;
2、了解溶液中的复分解反应发生的条件以及书写规律
;
3、学会用酸碱盐的知识解决生活中的相关问题,增长生活技能。
复习目标
《石灰吟》(于谦)
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
动脑思考?
CaCO3==CaO+CO2↑
CaO
+
H2O
=
Ca(OH)2
Ca(OH)2
+
CO2
=
CaCO3↓
+
H2O
高温
CaO
Ca(OH)2
CaCO3
石灰石(主要成分CaCO3
)
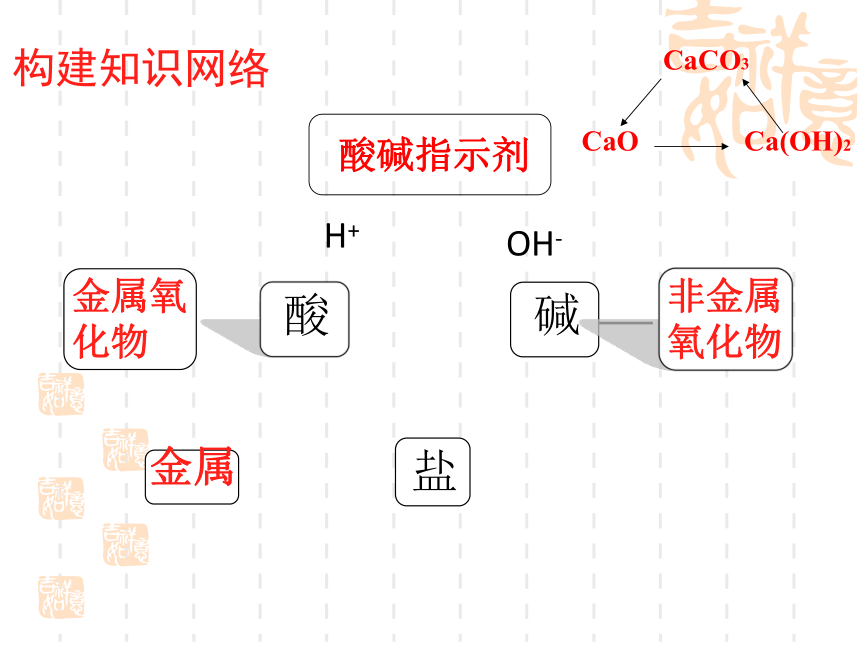
酸
盐
碱
金属
金属氧化物
非金属氧化物
构建知识网络
酸碱指示剂
H+
OH-
CaO
Ca(OH)2
CaCO3
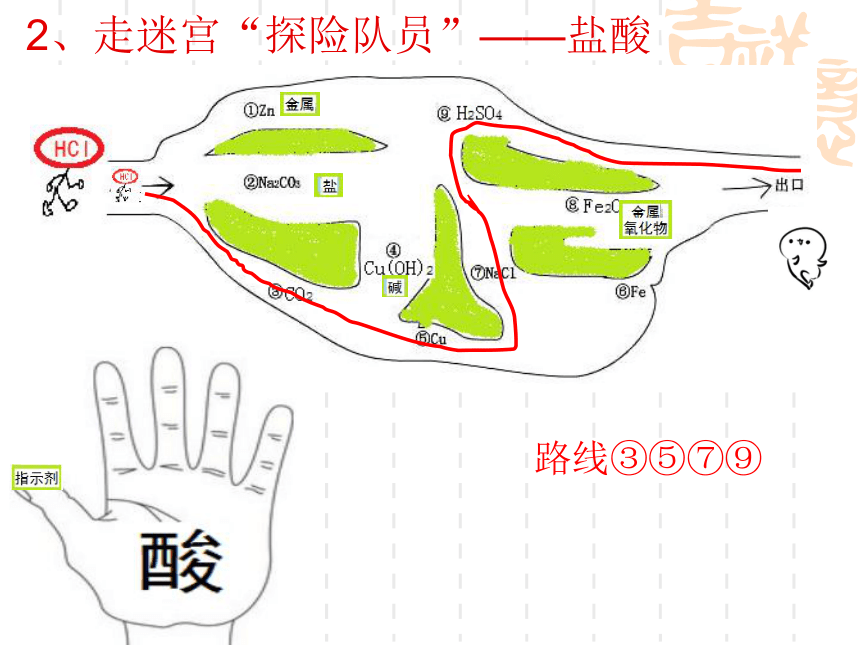
2、走迷宫“探险队员”——盐酸
路线③⑤⑦⑨
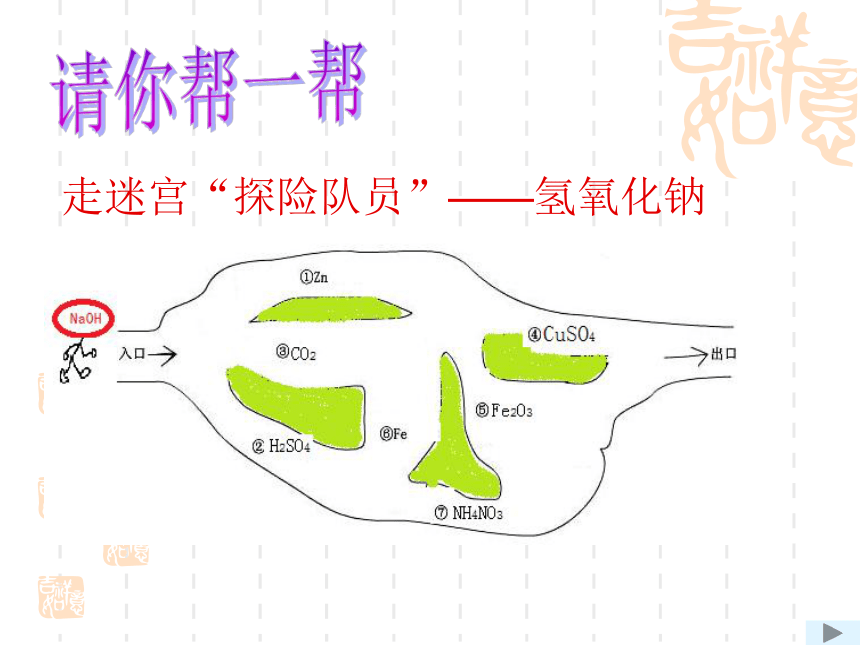
走迷宫“探险队员”——氢氧化钠
请你帮一帮
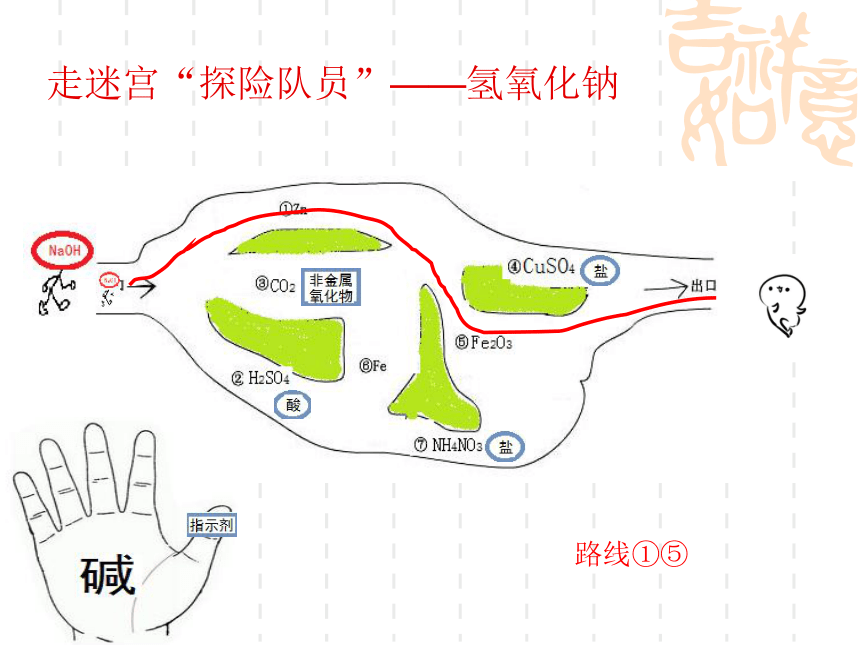
走迷宫“探险队员”——氢氧化钠
路线①⑤
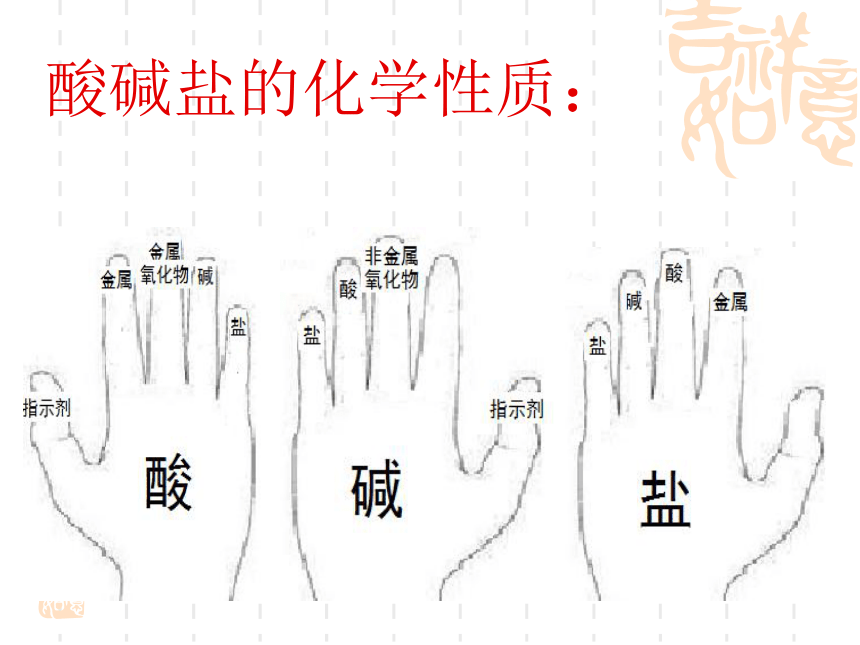
酸碱盐的化学性质:
检验H+可选择试剂:
石蕊溶液(或可用pH试纸测溶液的pH)
活泼金属
生锈的铁钉
碳酸盐
难溶性碱
检验OH-可选择试剂
1.无色酚酞试液
2.Cu2+溶液(CuSO4溶液)或Fe3+溶液(FeCl3溶液)
检验CO32-可选试剂
稀盐酸、澄清石灰水
检验SO42-可选试剂
检验Cl-可选试剂
检验NH4+可选试剂
硝酸钡溶液、稀硝酸
硝酸银溶液、稀硝酸
氢氧化钠溶液、湿润的红色石蕊试纸
酸
盐
碱
金属
金属氧化物
非金属氧化物
氢前
活泼置换不活泼……
交流总结:
酸碱指示剂
H+
OH-
盐
复分解反应的条件:
复分解反应的条件:
AB
+
CD
=
AD
+
CB
①②
反应物两者可溶
生成物有
↓、↑或H2O
③④
反应物酸可溶
Ca2+、OH-
H+、SO4
2
-
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+
H2SO4——
CaSO4+2H2O
——
√
溶液中反应的离子变化
复分解反应发生的实质:
溶液中离子种类发生改变
离子反应网络图
H+
CO32-
OH-
HCO3-
Ca2+
Ba2+
SO42-
Ag+
Cl-
Cu2+
Fe3+
Mg2+
Al3+
NH4+
总结与回顾
今天这节课你有什么收获呢?
1、建构部分酸碱盐知识的网络图:
2、掌握常见离子的检验
3、复分解反应的条件及微观实质
1、下列各组物质能够共存的是:
(
)
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
2、下列各组离子中,能够大量共存于同一溶液的是(
)
D
复分解反应的实质:离子间的结合生成↓、↑或H2O
中考链接
1.某同学欲用①NaOH溶液、②Na2SO4溶液、③Na2CO3粉末、④铁钉、⑤Ba(NO3)2溶液分别与稀硫酸混合来验证复分解反应发生的条件.(如图)
(1)从物质类别和构成的角度分析,铁钉、
与稀硫酸混合的实验没有必要做;
(2)上述物质中
能与稀硫酸发生复分解反应,但是没有明显现象;为证明两者能够反应,你的做法是
(3)Na2CO3粉末和稀硫酸能发生反应,是因为反应中有
生成;
(4)依据常见酸、碱、盐的溶解性表(室温),某物质能与稀硫酸发生中和反应,同时生成水和沉淀,写出反应的化学方程式
中考链接
硫酸钠溶液
H2SO4+Ba(OH)2
BaSO4↓+2H2O
氢氧化钠溶液
将稀硫酸逐滴滴入混有酚酞
溶液的氢氧化钠溶液中,当溶液变成无色时,说明二者能够发生反应。
气体
3.【2016年湖南省湘西州】下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH
B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl
D.NaCl、KCl、HCl、NaNO3
4.【2016年江苏省苏州市】下列各组离子在溶液中能大量共存的是( )
A.H+、SO42﹣、OH﹣
B.H+、Cl﹣、CO32﹣
C.Cu2+、Cl﹣、OH﹣
D.Na+、NO3﹣、SO42﹣
5.【2017年湖南省邵阳市】下列各组离子能在
pH=10
的溶液中大量共存的是(
)
A.
Na+、
Mg2+、
CO32-
B.
H+、
Cu2+、
NO3-
C.
NH4+、
Fe3+、
SO42-
D.
K+、
Ba2+、
Cl-
中考链接
D
D
D
6.下列不能用于区分Ca(OH)2溶液和NaOH溶液的试剂是(
)
A.CO2
B.CuSO4溶液
C.Na2CO3溶液
D.K2CO3溶液
B
中考链接
7.不使用其它试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是(
)
A.?H2SO4、Na2SO4、BaCl2、FeCl3
B.?BaCl2、HCl、NaNO3、AgNO3
C.?Na2CO3、HNO3、NaNO3、BaCl2
D.?H2SO4、NaOH、MgCl2、Ba(NO3)2
C
B
BaCl2
HCl
NaNO3
AgNO3
BaCl2
HCl
NaNO3
AgNO3
C
Na2CO3
HNO3
NaNO3
BaCl2
Na2CO3
HNO3
NaNO3
BaCl2
D
H2SO4
NaOH
MgCl2
Ba(NO3)2
H2SO4
NaOH
MgCl2
Ba(NO3)2
(2018上海)10.能用AgNO3溶液鉴别的一组物质是(
)
A.
HCl、KNO3
B.
HCl、MgCl2
C.
KNO3、NaNO3
D.
HCl、H2SO4
A
再见!
2NaOH+H2SO4=Na2SO4+2H2O
HCl
+
NaOH
=
NaCl
+
H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl
=
2NaCl+
H2CO3
NaHCO3+HCl
=
NaCl+
H2CO3
CaCO3+2HCl
=
CaCl2+H2CO3
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
这些化学方程式的特点是什么?
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
判断下列各组物质能否发生复分解反应,能,请写出化学方程式。
(1)碳酸钠溶液与氯化钙溶液
(2)氯化镁溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化镁溶液
Na2CO3
+
CaCl2
=
2NaCl
+
CaCO3↓
不能
2NaOH
+
MgCl2
=
2NaCl
+
Mg(OH)2↓
1.写出下列反应的化学方程式。
(1)盐酸(HCl)与氢氧化钙〔Ca(OH)2
〕反应
(2)硫酸(H2SO4)与氢氧化钠(NaOH)反应
(3)硫酸(H2SO4)与氢氧化钡〔
Ba(OH)2
〕反应
2NaOH+H2SO4
=
Na2SO4+2H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
H2SO4
+Ba(OH)2
=
BaSO4↓
+H2O
交流与讨论:
应用广泛的酸碱盐
九年级化学第七章复习
(第二课时)
1、了解物质的分类方法,归纳酸、碱、盐的化学性质
;
2、了解溶液中的复分解反应发生的条件以及书写规律
;
3、学会用酸碱盐的知识解决生活中的相关问题,增长生活技能。
复习目标
《石灰吟》(于谦)
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
动脑思考?
CaCO3==CaO+CO2↑
CaO
+
H2O
=
Ca(OH)2
Ca(OH)2
+
CO2
=
CaCO3↓
+
H2O
高温
CaO
Ca(OH)2
CaCO3
石灰石(主要成分CaCO3
)
酸
盐
碱
金属
金属氧化物
非金属氧化物
构建知识网络
酸碱指示剂
H+
OH-
CaO
Ca(OH)2
CaCO3
2、走迷宫“探险队员”——盐酸
路线③⑤⑦⑨
走迷宫“探险队员”——氢氧化钠
请你帮一帮
走迷宫“探险队员”——氢氧化钠
路线①⑤
酸碱盐的化学性质:
检验H+可选择试剂:
石蕊溶液(或可用pH试纸测溶液的pH)
活泼金属
生锈的铁钉
碳酸盐
难溶性碱
检验OH-可选择试剂
1.无色酚酞试液
2.Cu2+溶液(CuSO4溶液)或Fe3+溶液(FeCl3溶液)
检验CO32-可选试剂
稀盐酸、澄清石灰水
检验SO42-可选试剂
检验Cl-可选试剂
检验NH4+可选试剂
硝酸钡溶液、稀硝酸
硝酸银溶液、稀硝酸
氢氧化钠溶液、湿润的红色石蕊试纸
酸
盐
碱
金属
金属氧化物
非金属氧化物
氢前
活泼置换不活泼……
交流总结:
酸碱指示剂
H+
OH-
盐
复分解反应的条件:
复分解反应的条件:
AB
+
CD
=
AD
+
CB
①②
反应物两者可溶
生成物有
↓、↑或H2O
③④
反应物酸可溶
Ca2+、OH-
H+、SO4
2
-
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+
H2SO4——
CaSO4+2H2O
——
√
溶液中反应的离子变化
复分解反应发生的实质:
溶液中离子种类发生改变
离子反应网络图
H+
CO32-
OH-
HCO3-
Ca2+
Ba2+
SO42-
Ag+
Cl-
Cu2+
Fe3+
Mg2+
Al3+
NH4+
总结与回顾
今天这节课你有什么收获呢?
1、建构部分酸碱盐知识的网络图:
2、掌握常见离子的检验
3、复分解反应的条件及微观实质
1、下列各组物质能够共存的是:
(
)
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
2、下列各组离子中,能够大量共存于同一溶液的是(
)
D
复分解反应的实质:离子间的结合生成↓、↑或H2O
中考链接
1.某同学欲用①NaOH溶液、②Na2SO4溶液、③Na2CO3粉末、④铁钉、⑤Ba(NO3)2溶液分别与稀硫酸混合来验证复分解反应发生的条件.(如图)
(1)从物质类别和构成的角度分析,铁钉、
与稀硫酸混合的实验没有必要做;
(2)上述物质中
能与稀硫酸发生复分解反应,但是没有明显现象;为证明两者能够反应,你的做法是
(3)Na2CO3粉末和稀硫酸能发生反应,是因为反应中有
生成;
(4)依据常见酸、碱、盐的溶解性表(室温),某物质能与稀硫酸发生中和反应,同时生成水和沉淀,写出反应的化学方程式
中考链接
硫酸钠溶液
H2SO4+Ba(OH)2
BaSO4↓+2H2O
氢氧化钠溶液
将稀硫酸逐滴滴入混有酚酞
溶液的氢氧化钠溶液中,当溶液变成无色时,说明二者能够发生反应。
气体
3.【2016年湖南省湘西州】下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH
B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl
D.NaCl、KCl、HCl、NaNO3
4.【2016年江苏省苏州市】下列各组离子在溶液中能大量共存的是( )
A.H+、SO42﹣、OH﹣
B.H+、Cl﹣、CO32﹣
C.Cu2+、Cl﹣、OH﹣
D.Na+、NO3﹣、SO42﹣
5.【2017年湖南省邵阳市】下列各组离子能在
pH=10
的溶液中大量共存的是(
)
A.
Na+、
Mg2+、
CO32-
B.
H+、
Cu2+、
NO3-
C.
NH4+、
Fe3+、
SO42-
D.
K+、
Ba2+、
Cl-
中考链接
D
D
D
6.下列不能用于区分Ca(OH)2溶液和NaOH溶液的试剂是(
)
A.CO2
B.CuSO4溶液
C.Na2CO3溶液
D.K2CO3溶液
B
中考链接
7.不使用其它试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是(
)
A.?H2SO4、Na2SO4、BaCl2、FeCl3
B.?BaCl2、HCl、NaNO3、AgNO3
C.?Na2CO3、HNO3、NaNO3、BaCl2
D.?H2SO4、NaOH、MgCl2、Ba(NO3)2
C
B
BaCl2
HCl
NaNO3
AgNO3
BaCl2
HCl
NaNO3
AgNO3
C
Na2CO3
HNO3
NaNO3
BaCl2
Na2CO3
HNO3
NaNO3
BaCl2
D
H2SO4
NaOH
MgCl2
Ba(NO3)2
H2SO4
NaOH
MgCl2
Ba(NO3)2
(2018上海)10.能用AgNO3溶液鉴别的一组物质是(
)
A.
HCl、KNO3
B.
HCl、MgCl2
C.
KNO3、NaNO3
D.
HCl、H2SO4
A
再见!
2NaOH+H2SO4=Na2SO4+2H2O
HCl
+
NaOH
=
NaCl
+
H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl
=
2NaCl+
H2CO3
NaHCO3+HCl
=
NaCl+
H2CO3
CaCO3+2HCl
=
CaCl2+H2CO3
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
这些化学方程式的特点是什么?
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
判断下列各组物质能否发生复分解反应,能,请写出化学方程式。
(1)碳酸钠溶液与氯化钙溶液
(2)氯化镁溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化镁溶液
Na2CO3
+
CaCl2
=
2NaCl
+
CaCO3↓
不能
2NaOH
+
MgCl2
=
2NaCl
+
Mg(OH)2↓
1.写出下列反应的化学方程式。
(1)盐酸(HCl)与氢氧化钙〔Ca(OH)2
〕反应
(2)硫酸(H2SO4)与氢氧化钠(NaOH)反应
(3)硫酸(H2SO4)与氢氧化钡〔
Ba(OH)2
〕反应
2NaOH+H2SO4
=
Na2SO4+2H2O
2HCl
+Ca(OH)2
=
CaCl2
+2H2O
H2SO4
+Ba(OH)2
=
BaSO4↓
+H2O
交流与讨论:
