第3节 几种重要的盐第二课时1-课件(共21张PPT)
文档属性
| 名称 | 第3节 几种重要的盐第二课时1-课件(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 21:15:44 | ||
图片预览







文档简介
(共21张PPT)
第二课时
学习目标
1.初步认识常见的复分解反应。
2.知道复分解反应的条件
1.认识复分解反应及复分解反应发生的条件2.了解几种化学反应类型,并能进行判断。
学习目标
知
识
回
顾:
写出下列反应的化学方程式
(1)氢氧化钠与硫酸
(2)碳酸钠与盐酸
(3)碳酸氢钠与盐酸
(4)碳酸钙与盐酸
(5)碳酸钠与澄清石灰水
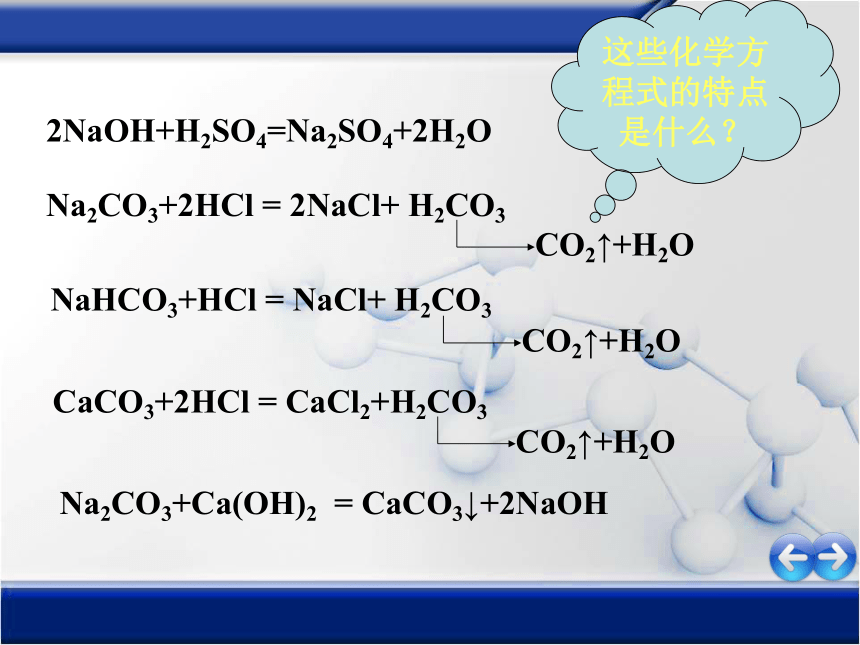
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl
=
2NaCl+
H2CO3
NaHCO3+HCl
=
NaCl+
H2CO3
CaCO3+2HCl
=
CaCl2+H2CO3
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
这些化学方程式的特点是什么?
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
二、复分解反应
1.定义:两种化合物相互交换成分,生成另外两种化合物的反应
关键词:两种化合物
、交换成分
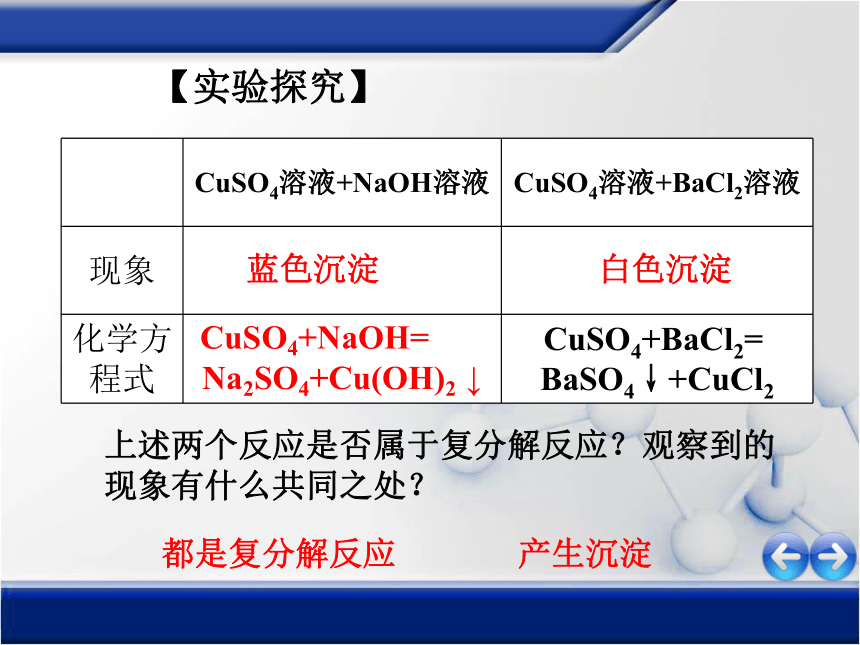
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
CuSO4+BaCl2=
BaSO4↓+CuCl2
【实验探究】
蓝色沉淀
CuSO4+NaOH=
Na2SO4+Cu(OH)2
↓
白色沉淀
都是复分解反应
产生沉淀
上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
酸碱中和反应是否也属于复分解反应?生成物中相同的物质是什么?
如:2NaOH+H2SO4
=
Na2SO4+2H2O
都是复分解反应
都有水生成
碳酸盐与盐酸发生复分解反应时,可观察到的共同现象是什么?
如:CaCO3+2HCl
=
CaCl2+2H2O+CO2
↑
都产生气泡
2.
复分解反应发生的条件
(1)反应物有酸酸溶,无酸双溶
(2)生成物有水
、沉淀
或气体
【实验探究】
NaOH
溶液
NaCl
溶液
K2CO3
溶液
Ba(NO3)2
溶液
稀硫酸
判断
依据
能
能
能
不能
有水生成
无水、沉淀或气体生成
有气体
产生
有沉淀产生
判断下列各组物质能否发生复分解反应,能,请写出化学方程式。
(1)碳酸钠溶液与氯化钙溶液
(2)氯化镁溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化镁溶液
Na2CO3
+
CaCl2
=
2NaCl
+
CaCO3↓
不能
2NaOH
+
MgCl2
=
2NaCl
+
Mg(OH)2↓
(4)氢氧化钾与稀盐酸
(5)碳酸钾与稀硫酸
(6)氯化钠溶液与硝酸钾溶液
KOH
+
HCl
=
KCl
+
H2O
K2CO3
+
H2SO4
=
K2SO4
+
H2O
+
CO2↑
不能
除去食盐中的氯化镁、氯化钙杂质的方法?写出有关的化学方程式。
2NaOH+MgCl2
=
2NaCl
+Mg(OH)2
↓
Na2CO3+CaCl2
=
CaCO3↓+2NaCl
化合反应:A+B→AB
基本反应类型
分解反应:AB→A+B
置换反应:A+BC→AC+B
复分解反应:AB+CD→AD+CB
CaO+H2O
=
Ca(OH)2
H2CO3=
H2O+CO2
↑
Fe+CuSO4
=
FeSO4+Cu
CuSO4+BaCl2
=
BaSO4↓+CuCl2
1.你知道什么样的反应为复分解反应吗?你能判断两种化合物溶液混合是否能发生反应吗?
2.基本反应类型包括哪些?各有什么特点?
课堂小结
生活中常见的盐
三、复分解反应
1.定义
由两种化合物相互交换成分,生成另外两种化合物的反应。
2.发生条件
(1)反应物有酸酸溶,无酸双溶;
(2)生成物有水、沉淀或气体。
1.
医疗上可以用含有氢氧化镁的药物治疗胃酸过多,其反应的化学方程式为:Mg(OH)2?+?2HCl=MgCl2?+?2H2O,该反应属于(
)
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
D
2.下列各组物质的溶液,不能发生复分解反应的是?
(??????
)
A.
HCl和Ca(OH)2?
B.
Na2CO3和H2SO4?
C.
AgNO3和BaCl2?
D.
KCl和CuSO4
D
3.
在水溶液中,一般不会与其他物质发生复分解反应的物质是(
)
A.
KCl
B.
NaNO3
C.
HNO3
D.
Mg(OH)2
B
4.
下列各组物质的转变中不能一步实现的是(
)
A.
Na2CO3→NaCl
B.
K2SO4→Na2SO4
C.
CaCO3→
H2O
D.
Ca(OH)2→NaOH
B
5.向结有水垢的热水瓶中加入稀盐酸,水垢溶解脱落,向所得的溶液中加入过量的Na2CO3溶液,又有白色沉淀出现,这种水垢可能有(
)
A.BaSO4 B.CaCO3 C.K2CO3 D.AgNO3
B
(2018上海)18.关于复分解反应说法一定正确的是( )
A.
反应物为酸和碱
B.
伴随有明显现象
C.
生成物为盐和水
D.
元素化合价不变
D
第二课时
学习目标
1.初步认识常见的复分解反应。
2.知道复分解反应的条件
1.认识复分解反应及复分解反应发生的条件2.了解几种化学反应类型,并能进行判断。
学习目标
知
识
回
顾:
写出下列反应的化学方程式
(1)氢氧化钠与硫酸
(2)碳酸钠与盐酸
(3)碳酸氢钠与盐酸
(4)碳酸钙与盐酸
(5)碳酸钠与澄清石灰水
2NaOH+H2SO4=Na2SO4+2H2O
Na2CO3+2HCl
=
2NaCl+
H2CO3
NaHCO3+HCl
=
NaCl+
H2CO3
CaCO3+2HCl
=
CaCl2+H2CO3
Na2CO3+Ca(OH)2
=
CaCO3↓+2NaOH
这些化学方程式的特点是什么?
CO2↑+H2O
CO2↑+H2O
CO2↑+H2O
二、复分解反应
1.定义:两种化合物相互交换成分,生成另外两种化合物的反应
关键词:两种化合物
、交换成分
CuSO4溶液+NaOH溶液
CuSO4溶液+BaCl2溶液
现象
化学方程式
CuSO4+BaCl2=
BaSO4↓+CuCl2
【实验探究】
蓝色沉淀
CuSO4+NaOH=
Na2SO4+Cu(OH)2
↓
白色沉淀
都是复分解反应
产生沉淀
上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
酸碱中和反应是否也属于复分解反应?生成物中相同的物质是什么?
如:2NaOH+H2SO4
=
Na2SO4+2H2O
都是复分解反应
都有水生成
碳酸盐与盐酸发生复分解反应时,可观察到的共同现象是什么?
如:CaCO3+2HCl
=
CaCl2+2H2O+CO2
↑
都产生气泡
2.
复分解反应发生的条件
(1)反应物有酸酸溶,无酸双溶
(2)生成物有水
、沉淀
或气体
【实验探究】
NaOH
溶液
NaCl
溶液
K2CO3
溶液
Ba(NO3)2
溶液
稀硫酸
判断
依据
能
能
能
不能
有水生成
无水、沉淀或气体生成
有气体
产生
有沉淀产生
判断下列各组物质能否发生复分解反应,能,请写出化学方程式。
(1)碳酸钠溶液与氯化钙溶液
(2)氯化镁溶液与硫酸铜溶液
(3)氢氧化钠溶液与氯化镁溶液
Na2CO3
+
CaCl2
=
2NaCl
+
CaCO3↓
不能
2NaOH
+
MgCl2
=
2NaCl
+
Mg(OH)2↓
(4)氢氧化钾与稀盐酸
(5)碳酸钾与稀硫酸
(6)氯化钠溶液与硝酸钾溶液
KOH
+
HCl
=
KCl
+
H2O
K2CO3
+
H2SO4
=
K2SO4
+
H2O
+
CO2↑
不能
除去食盐中的氯化镁、氯化钙杂质的方法?写出有关的化学方程式。
2NaOH+MgCl2
=
2NaCl
+Mg(OH)2
↓
Na2CO3+CaCl2
=
CaCO3↓+2NaCl
化合反应:A+B→AB
基本反应类型
分解反应:AB→A+B
置换反应:A+BC→AC+B
复分解反应:AB+CD→AD+CB
CaO+H2O
=
Ca(OH)2
H2CO3=
H2O+CO2
↑
Fe+CuSO4
=
FeSO4+Cu
CuSO4+BaCl2
=
BaSO4↓+CuCl2
1.你知道什么样的反应为复分解反应吗?你能判断两种化合物溶液混合是否能发生反应吗?
2.基本反应类型包括哪些?各有什么特点?
课堂小结
生活中常见的盐
三、复分解反应
1.定义
由两种化合物相互交换成分,生成另外两种化合物的反应。
2.发生条件
(1)反应物有酸酸溶,无酸双溶;
(2)生成物有水、沉淀或气体。
1.
医疗上可以用含有氢氧化镁的药物治疗胃酸过多,其反应的化学方程式为:Mg(OH)2?+?2HCl=MgCl2?+?2H2O,该反应属于(
)
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
D
2.下列各组物质的溶液,不能发生复分解反应的是?
(??????
)
A.
HCl和Ca(OH)2?
B.
Na2CO3和H2SO4?
C.
AgNO3和BaCl2?
D.
KCl和CuSO4
D
3.
在水溶液中,一般不会与其他物质发生复分解反应的物质是(
)
A.
KCl
B.
NaNO3
C.
HNO3
D.
Mg(OH)2
B
4.
下列各组物质的转变中不能一步实现的是(
)
A.
Na2CO3→NaCl
B.
K2SO4→Na2SO4
C.
CaCO3→
H2O
D.
Ca(OH)2→NaOH
B
5.向结有水垢的热水瓶中加入稀盐酸,水垢溶解脱落,向所得的溶液中加入过量的Na2CO3溶液,又有白色沉淀出现,这种水垢可能有(
)
A.BaSO4 B.CaCO3 C.K2CO3 D.AgNO3
B
(2018上海)18.关于复分解反应说法一定正确的是( )
A.
反应物为酸和碱
B.
伴随有明显现象
C.
生成物为盐和水
D.
元素化合价不变
D
