沪教版九年级化学下册 7.2.1常见的酸-课件(共31张PPT)
文档属性
| 名称 | 沪教版九年级化学下册 7.2.1常见的酸-课件(共31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 21:51:16 | ||
图片预览









文档简介
(共31张PPT)
第二节
常见的酸和碱(第1课时)
第七章
应用广泛的酸碱盐
?常见的酸;
?浓硫酸和浓盐酸的物理性质;
?稀硫酸和稀盐酸的化学性质。
化学研究表明,溶液的酸性是由于其中含有一类特殊的物质——
酸。
同样,溶液的碱性是由于其中含有一类特殊的物质——
碱。
你已经知道了什么?
你已经知道哪些酸?了解它们的性质吗?它们在生产,生活中有哪些应用?
请回答
醋酸
乳酸
盐酸
柠檬酸
苹果酸
硫酸
一、常见的酸
我们还知道:
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
三种重要的酸
从溶液的观点分析,酸溶于水后都生成了自由移动的离子,分析以下酸溶液的微粒构成(水分子除外)
,你对酸的共同点又有哪些认识?
盐酸
(HCl)
——
H+
+
Cl-
硫酸
(H2SO4)
——
H+
+
SO42-
硝酸
(HNO3)
——
H+
+
NO3-
碳酸
(H2CO3)
——
H+
+
CO32-
酸——溶于水后生成的阳离子全部是氢离子(H+)的化合物
酸根离子
酸——都含有氢元素
氢离子
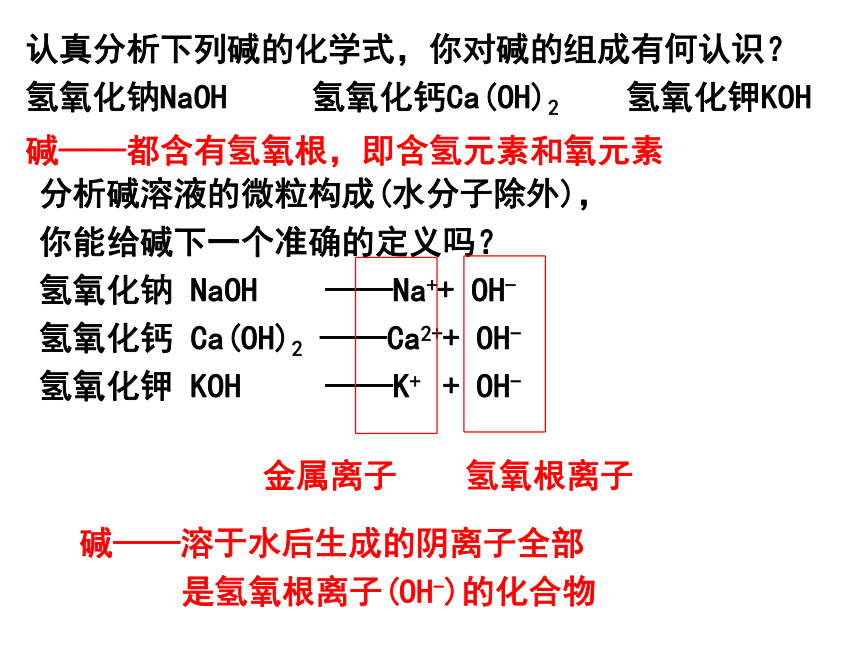
认真分析下列碱的化学式,你对碱的组成有何认识?
氢氧化钠NaOH
氢氧化钙Ca(OH)2
氢氧化钾KOH
分析碱溶液的微粒构成(水分子除外),
你能给碱下一个准确的定义吗?
氢氧化钠
NaOH
——Na++
OH-
氢氧化钙
Ca(OH)2
——Ca2++
OH-
氢氧化钾
KOH
——K+
+
OH-
碱——都含有氢氧根,即含氢元素和氧元素
碱——溶于水后生成的阴离子全部
是氢氧根离子(OH-)的化合物
金属离子
氢氧根离子
分析以下盐溶液的微粒构成(水分子除外)
,
你对盐的共同点又有哪些认识?
氯化铵
(NH4Cl)
——NH4+
+
Cl-
硫酸铜
(CuSO4)
——Cu2+
+
SO42-
硝酸钾
(HNO3)
——K+
+
NO3-
碳酸钠
(Na2CO3)
——Na+
+
CO32-
盐——由金属离子(或铵根离子)和酸根离子
构成的化合物
金属离子
(或铵根离子)
酸根离子
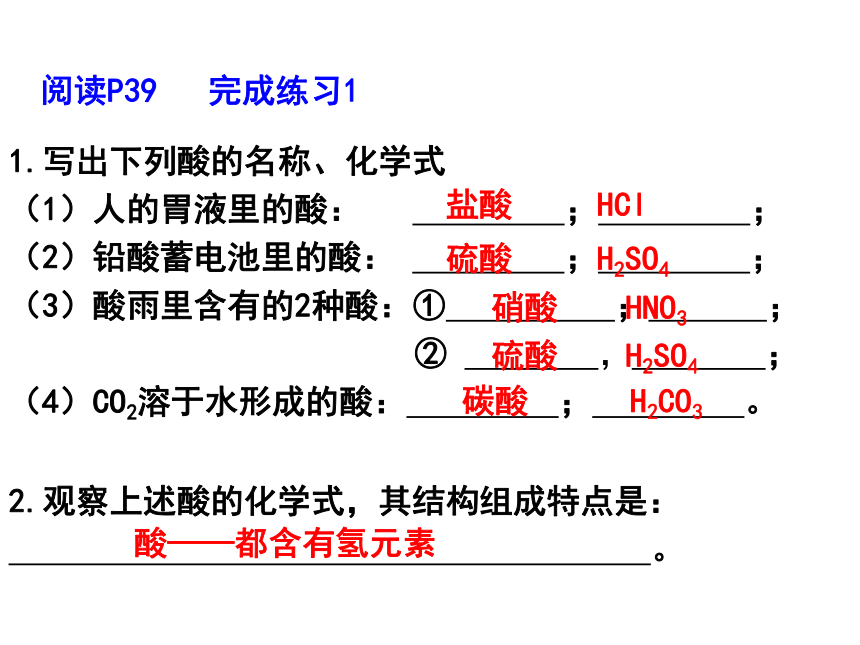
1.写出下列酸的名称、化学式
(1)人的胃液里的酸:
;
;
(2)铅酸蓄电池里的酸:
;
;
(3)酸雨里含有的2种酸:①
;
;
②
,
;
(4)CO2溶于水形成的酸:
;
。
阅读P39
完成练习1
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
硫酸
H2SO4
碳酸
H2CO3
2.观察上述酸的化学式,其结构组成特点是:
。
酸——都含有氢元素
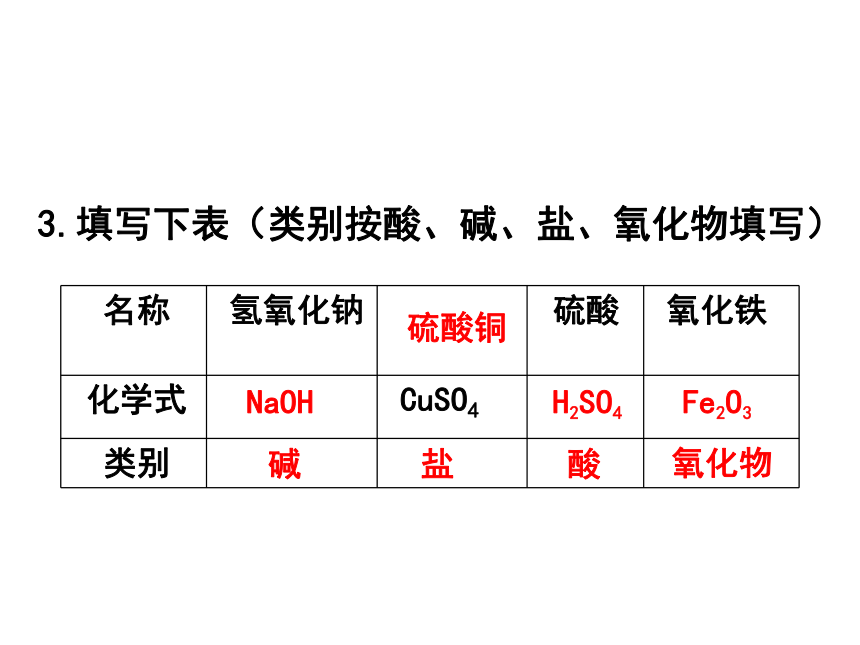
3.填写下表(类别按酸、碱、盐、氧化物填写)
名称
氢氧化钠
硫酸
氧化铁
化学式
CuSO4
类别
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
活动与探究一:
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小。
——浓酸的物理性质
打开瓶塞,观察发生的现象;闻一闻是否有气味。
请把实验结果结合课本P43内容,填入P40表7-3中
二、浓硫酸和浓盐酸的物理性质
浓硫酸
浓盐酸
溶质的化学式
颜色
状态
气味
密度(与水比较)
敞口发生的现象
其他
H2SO4
HCl
无色
无色
粘稠的油状液体
液体
无味
比水密度大
无明显现象
有刺激性气味
比水密度大
产生白雾
有强腐蚀性、
有腐蚀性、
有吸水性、
溶于水放出大量的热、
有挥发性
脱水性(炭化)
白雾:氯化氢气体与水蒸气结合,形成的盐酸小液滴
浓盐酸的挥发性
与水蒸气结合
浓硫酸的特性
2.浓硫酸有脱水性(化学性质),滴到
纸张、蔗糖上,会使纸张、蔗糖炭化。
稀硫酸滴到纸张上,在水分挥发的过
程中硫酸的浓度增大,也会使纸张逐
渐炭化;
3.浓硫酸有腐蚀性,会腐蚀衣物和皮肤;
4.浓硫酸溶于水时放出大量热。
1.浓硫酸能吸收水蒸气,有很强的
吸水性(物理性质),作为干燥剂;
稀释浓硫酸时,要把浓硫酸缓缓注入水中,
用玻璃棒引流并不断搅拌(使溶解放出的热量迅速扩散)。
浓硫酸
稀释
浓硫酸
错误稀释
如果水入酸,则水浮在上层,溶解时放出大量热,使水沸腾,酸液飞溅。
酸入水
1.下列各物质露置在空气中,一段时间后,不考虑水分挥发,物质的总质量会增加的是(
)减少的是(
)
A.浓盐酸
B.浓食盐水
C.浓硫酸
D.浓醋酸
C
2.盐酸是
气体的水溶液,打开浓盐酸瓶盖,瓶口会有
,说明浓盐酸有
性。
3、浓硫酸具有
性,常用作某些气体的干燥剂。
HCl
挥发
白雾
吸水
A
D
4.若将盛放浓硫酸和浓盐酸的试剂瓶敞口露置在空气中一段时间,不考虑水分挥发,可能发生什么变化?将判断的结果填入下表。
物质
溶液质量
溶质质量
溶剂质量
溶质质量分数
浓硫酸
浓盐酸
吸水性
挥发性
变大
不变
变大
变小
不变
变小
变小
变小
你能用几种不同的化学性质鉴别出稀盐酸和蒸馏水?
请写出所选取的试剂并说出现象。
1.紫色石蕊试液、蓝色石蕊试纸、pH试纸
2.金属镁(锌)
3.碳酸钙
用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入表7-4,并与同学讨论相关问题。
活动与探究二:
——稀酸的化学性质
三、稀酸的化学性质
(稀盐酸、稀硫酸)
1.酸与指示剂反应
使紫色石蕊变红色,无色酚酞不变色(pH<7);
2.金属+酸反应
你能写出镁、铁、锌、铜与稀硫酸反应的化学方程式吗?
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Cu+H2SO4
不反应
金属+酸→盐+H2
↑
盐酸
分析下图,你对金属Mg、Zn、Fe、Cu的活动性有何认识?
镁
锌
铁
铜
活动性顺序
现象
有大量气泡放出
有较多气泡放出
有少量气泡放出
没有气泡放出
镁>锌>铁>铜
判断金属活动性的依据:
比较金属与酸反应冒气泡的速率
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜
汞
银
铂
金
1.金属活动性顺序中,金属位置越靠前,活动性越强。
2.金属活动性顺序中,排在氢前的金属能与酸发生置换反应,生成氢气;排在氢后面的金属不能与酸发生反应。
3.与金属氧化物反应
铁锈的主要成分是
,将生锈的铁钉放入足量稀盐酸、稀硫酸中,看到
、
;
化学方程式
。
Fe2O3
铁锈溶解
溶液变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
生锈铁钉与盐酸反应
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈完全溶解后,可以看到铁钉表面有大量气泡生成,该气体是
;
化学方程式
。
H2
Fe+2HCl=FeCl2+H2↑
金属氧化物+酸→盐+H2O
氧化铜(CuO)
色,氧化铜与稀硫酸反应,看到
、
;
化学方程式
。
黑
黑色固体溶解
溶液变成蓝色
CuO+H2SO4=CuSO4+H2O
氧化铜
硫酸铜溶液
金属氧化物+酸→盐+H2O
稀盐酸与石灰石反应的现象是
,
化学方程式为:
。
产生大量气泡
稀盐酸与碳酸钠溶液反应,看到
;
化学方程式
。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
产生大量气泡
酸+碳酸盐=新盐+H2O+CO2↑
石灰石与稀硫酸反应的现象是
,
化学方程式为:
。
产生少量气泡、停止反应
CaCO3+H2SO4=CaSO4+H2O+CO2↑
生成物微溶于水,阻止反应的进一步发生。
4.与碳酸盐反应
记录:稀硫酸和稀盐酸的化学性质
实验内容
现象与结论
将镁条、锌粒、铜片分别放入稀硫酸、稀盐酸中
稀硫酸、稀盐酸分别与铁锈作用
稀盐酸与石灰石作用
镁、锌表面均有气泡产生。铜表面无明显现象
铁锈逐渐溶解,溶液由无色逐渐转变为黄色
石灰石表面有气泡产生
1、跟指示剂的反应
2、跟金属的反应
3、跟金属氧化物的反应
4、跟碳酸盐反应
酸能使石蕊试液变成红色,使蓝色石蕊试纸变红。
金属+酸==盐+氢气↑
Zn+H2SO4=ZnSO4+H2↑
Fe2O3+6HCl=
2FeCl3+3H2O
金属氧化物+酸==盐+水
稀酸的化学性质
Na2CO3+2HCl=
2NaCl+H2O+CO2↑碳酸盐+酸==新盐+二氧化碳+水
1.下列物质可以用于实验室与锌发生置换反应制取氢气的是
(
)
A.浓盐酸
B.稀硫酸
C.硝酸
D.浓硫酸
B
2.下物质能由酸和金属反应置换生成的是(
)
A.AlCl2
B.ZnSO4
C.FeCl3
D.CuSO4
B
强氧化性
强氧化性
应为+2价
铜与酸不发生置换反应
铝只有+3价
AlCl3
挥发性
3.下列说法正确的是(
)
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质的质量分数变大
C.长期露置于空气中,浓盐酸与浓硫酸的溶液质量都增大
D.打开盛浓盐酸的试剂瓶,瓶口会产生白雾
4.下列物质放入稀盐酸中,无气体生成的是(
)
A.铝
B.碳酸钠
C.铁锈
D.石灰石
D
C
酸红碱蓝
浓硫酸具有吸水性,
溶质的质量分数变小。
浓盐酸易挥发,溶液质量减小;
浓硫酸吸水性,溶液质量增大。
氢气
二氧化碳
二氧化碳
5.根据金属与酸的反应速率,可以证明金属的活动性顺
序。有人设计下列实验证明Zn、Fe
的活动性顺序:
实验方法
实验现象
结论
将相同质量的锌粉和铁钉分别放入相同质量的相同浓度稀硫酸中
锌冒气泡速度比铁快
锌比铁
活泼
这种设计是否正确?为什么?
不正确,锌粉和铁钉形状不同
(与酸的接触面积不同)。
作业:
1.
归纳碱的4条通性,且每一条写出2个方程式(指示剂变色除外);
2.
完成《探究与训练》第七章第二节第一课时,并预习第2节剩余内容。
第二节
常见的酸和碱(第1课时)
第七章
应用广泛的酸碱盐
?常见的酸;
?浓硫酸和浓盐酸的物理性质;
?稀硫酸和稀盐酸的化学性质。
化学研究表明,溶液的酸性是由于其中含有一类特殊的物质——
酸。
同样,溶液的碱性是由于其中含有一类特殊的物质——
碱。
你已经知道了什么?
你已经知道哪些酸?了解它们的性质吗?它们在生产,生活中有哪些应用?
请回答
醋酸
乳酸
盐酸
柠檬酸
苹果酸
硫酸
一、常见的酸
我们还知道:
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
三种重要的酸
从溶液的观点分析,酸溶于水后都生成了自由移动的离子,分析以下酸溶液的微粒构成(水分子除外)
,你对酸的共同点又有哪些认识?
盐酸
(HCl)
——
H+
+
Cl-
硫酸
(H2SO4)
——
H+
+
SO42-
硝酸
(HNO3)
——
H+
+
NO3-
碳酸
(H2CO3)
——
H+
+
CO32-
酸——溶于水后生成的阳离子全部是氢离子(H+)的化合物
酸根离子
酸——都含有氢元素
氢离子
认真分析下列碱的化学式,你对碱的组成有何认识?
氢氧化钠NaOH
氢氧化钙Ca(OH)2
氢氧化钾KOH
分析碱溶液的微粒构成(水分子除外),
你能给碱下一个准确的定义吗?
氢氧化钠
NaOH
——Na++
OH-
氢氧化钙
Ca(OH)2
——Ca2++
OH-
氢氧化钾
KOH
——K+
+
OH-
碱——都含有氢氧根,即含氢元素和氧元素
碱——溶于水后生成的阴离子全部
是氢氧根离子(OH-)的化合物
金属离子
氢氧根离子
分析以下盐溶液的微粒构成(水分子除外)
,
你对盐的共同点又有哪些认识?
氯化铵
(NH4Cl)
——NH4+
+
Cl-
硫酸铜
(CuSO4)
——Cu2+
+
SO42-
硝酸钾
(HNO3)
——K+
+
NO3-
碳酸钠
(Na2CO3)
——Na+
+
CO32-
盐——由金属离子(或铵根离子)和酸根离子
构成的化合物
金属离子
(或铵根离子)
酸根离子
1.写出下列酸的名称、化学式
(1)人的胃液里的酸:
;
;
(2)铅酸蓄电池里的酸:
;
;
(3)酸雨里含有的2种酸:①
;
;
②
,
;
(4)CO2溶于水形成的酸:
;
。
阅读P39
完成练习1
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
硫酸
H2SO4
碳酸
H2CO3
2.观察上述酸的化学式,其结构组成特点是:
。
酸——都含有氢元素
3.填写下表(类别按酸、碱、盐、氧化物填写)
名称
氢氧化钠
硫酸
氧化铁
化学式
CuSO4
类别
NaOH
碱
硫酸铜
盐
H2SO4
酸
Fe2O3
氧化物
活动与探究一:
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小。
——浓酸的物理性质
打开瓶塞,观察发生的现象;闻一闻是否有气味。
请把实验结果结合课本P43内容,填入P40表7-3中
二、浓硫酸和浓盐酸的物理性质
浓硫酸
浓盐酸
溶质的化学式
颜色
状态
气味
密度(与水比较)
敞口发生的现象
其他
H2SO4
HCl
无色
无色
粘稠的油状液体
液体
无味
比水密度大
无明显现象
有刺激性气味
比水密度大
产生白雾
有强腐蚀性、
有腐蚀性、
有吸水性、
溶于水放出大量的热、
有挥发性
脱水性(炭化)
白雾:氯化氢气体与水蒸气结合,形成的盐酸小液滴
浓盐酸的挥发性
与水蒸气结合
浓硫酸的特性
2.浓硫酸有脱水性(化学性质),滴到
纸张、蔗糖上,会使纸张、蔗糖炭化。
稀硫酸滴到纸张上,在水分挥发的过
程中硫酸的浓度增大,也会使纸张逐
渐炭化;
3.浓硫酸有腐蚀性,会腐蚀衣物和皮肤;
4.浓硫酸溶于水时放出大量热。
1.浓硫酸能吸收水蒸气,有很强的
吸水性(物理性质),作为干燥剂;
稀释浓硫酸时,要把浓硫酸缓缓注入水中,
用玻璃棒引流并不断搅拌(使溶解放出的热量迅速扩散)。
浓硫酸
稀释
浓硫酸
错误稀释
如果水入酸,则水浮在上层,溶解时放出大量热,使水沸腾,酸液飞溅。
酸入水
1.下列各物质露置在空气中,一段时间后,不考虑水分挥发,物质的总质量会增加的是(
)减少的是(
)
A.浓盐酸
B.浓食盐水
C.浓硫酸
D.浓醋酸
C
2.盐酸是
气体的水溶液,打开浓盐酸瓶盖,瓶口会有
,说明浓盐酸有
性。
3、浓硫酸具有
性,常用作某些气体的干燥剂。
HCl
挥发
白雾
吸水
A
D
4.若将盛放浓硫酸和浓盐酸的试剂瓶敞口露置在空气中一段时间,不考虑水分挥发,可能发生什么变化?将判断的结果填入下表。
物质
溶液质量
溶质质量
溶剂质量
溶质质量分数
浓硫酸
浓盐酸
吸水性
挥发性
变大
不变
变大
变小
不变
变小
变小
变小
你能用几种不同的化学性质鉴别出稀盐酸和蒸馏水?
请写出所选取的试剂并说出现象。
1.紫色石蕊试液、蓝色石蕊试纸、pH试纸
2.金属镁(锌)
3.碳酸钙
用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入表7-4,并与同学讨论相关问题。
活动与探究二:
——稀酸的化学性质
三、稀酸的化学性质
(稀盐酸、稀硫酸)
1.酸与指示剂反应
使紫色石蕊变红色,无色酚酞不变色(pH<7);
2.金属+酸反应
你能写出镁、铁、锌、铜与稀硫酸反应的化学方程式吗?
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
Cu+H2SO4
不反应
金属+酸→盐+H2
↑
盐酸
分析下图,你对金属Mg、Zn、Fe、Cu的活动性有何认识?
镁
锌
铁
铜
活动性顺序
现象
有大量气泡放出
有较多气泡放出
有少量气泡放出
没有气泡放出
镁>锌>铁>铜
判断金属活动性的依据:
比较金属与酸反应冒气泡的速率
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序
金属活动性由强逐渐减弱
钾
钙
钠
镁
铝
锌
铁锡铅(氢)铜
汞
银
铂
金
1.金属活动性顺序中,金属位置越靠前,活动性越强。
2.金属活动性顺序中,排在氢前的金属能与酸发生置换反应,生成氢气;排在氢后面的金属不能与酸发生反应。
3.与金属氧化物反应
铁锈的主要成分是
,将生锈的铁钉放入足量稀盐酸、稀硫酸中,看到
、
;
化学方程式
。
Fe2O3
铁锈溶解
溶液变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
生锈铁钉与盐酸反应
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈完全溶解后,可以看到铁钉表面有大量气泡生成,该气体是
;
化学方程式
。
H2
Fe+2HCl=FeCl2+H2↑
金属氧化物+酸→盐+H2O
氧化铜(CuO)
色,氧化铜与稀硫酸反应,看到
、
;
化学方程式
。
黑
黑色固体溶解
溶液变成蓝色
CuO+H2SO4=CuSO4+H2O
氧化铜
硫酸铜溶液
金属氧化物+酸→盐+H2O
稀盐酸与石灰石反应的现象是
,
化学方程式为:
。
产生大量气泡
稀盐酸与碳酸钠溶液反应,看到
;
化学方程式
。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
产生大量气泡
酸+碳酸盐=新盐+H2O+CO2↑
石灰石与稀硫酸反应的现象是
,
化学方程式为:
。
产生少量气泡、停止反应
CaCO3+H2SO4=CaSO4+H2O+CO2↑
生成物微溶于水,阻止反应的进一步发生。
4.与碳酸盐反应
记录:稀硫酸和稀盐酸的化学性质
实验内容
现象与结论
将镁条、锌粒、铜片分别放入稀硫酸、稀盐酸中
稀硫酸、稀盐酸分别与铁锈作用
稀盐酸与石灰石作用
镁、锌表面均有气泡产生。铜表面无明显现象
铁锈逐渐溶解,溶液由无色逐渐转变为黄色
石灰石表面有气泡产生
1、跟指示剂的反应
2、跟金属的反应
3、跟金属氧化物的反应
4、跟碳酸盐反应
酸能使石蕊试液变成红色,使蓝色石蕊试纸变红。
金属+酸==盐+氢气↑
Zn+H2SO4=ZnSO4+H2↑
Fe2O3+6HCl=
2FeCl3+3H2O
金属氧化物+酸==盐+水
稀酸的化学性质
Na2CO3+2HCl=
2NaCl+H2O+CO2↑碳酸盐+酸==新盐+二氧化碳+水
1.下列物质可以用于实验室与锌发生置换反应制取氢气的是
(
)
A.浓盐酸
B.稀硫酸
C.硝酸
D.浓硫酸
B
2.下物质能由酸和金属反应置换生成的是(
)
A.AlCl2
B.ZnSO4
C.FeCl3
D.CuSO4
B
强氧化性
强氧化性
应为+2价
铜与酸不发生置换反应
铝只有+3价
AlCl3
挥发性
3.下列说法正确的是(
)
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质的质量分数变大
C.长期露置于空气中,浓盐酸与浓硫酸的溶液质量都增大
D.打开盛浓盐酸的试剂瓶,瓶口会产生白雾
4.下列物质放入稀盐酸中,无气体生成的是(
)
A.铝
B.碳酸钠
C.铁锈
D.石灰石
D
C
酸红碱蓝
浓硫酸具有吸水性,
溶质的质量分数变小。
浓盐酸易挥发,溶液质量减小;
浓硫酸吸水性,溶液质量增大。
氢气
二氧化碳
二氧化碳
5.根据金属与酸的反应速率,可以证明金属的活动性顺
序。有人设计下列实验证明Zn、Fe
的活动性顺序:
实验方法
实验现象
结论
将相同质量的锌粉和铁钉分别放入相同质量的相同浓度稀硫酸中
锌冒气泡速度比铁快
锌比铁
活泼
这种设计是否正确?为什么?
不正确,锌粉和铁钉形状不同
(与酸的接触面积不同)。
作业:
1.
归纳碱的4条通性,且每一条写出2个方程式(指示剂变色除外);
2.
完成《探究与训练》第七章第二节第一课时,并预习第2节剩余内容。
