沪教版九年级化学下册 7.2.3中和反应-课件(共20张PPT)
文档属性
| 名称 | 沪教版九年级化学下册 7.2.3中和反应-课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 21:55:27 | ||
图片预览





文档简介
(共20张PPT)
————中和反应
第七章
应用广泛的酸碱盐
第二节
常见的酸和碱(3)
思考:
为什么吃皮蛋的时候要放食醋呢?
第一步:往氢氧化钠溶液中滴入酚酞试液,振荡观察,溶液颜色由无色逐渐变为______
,插入一根温度计,测量此时溶液的温度,往溶液中逐滴滴入盐酸至溶液刚好变为无色时,溶液温度______(升高,降低,不变)
,实验过程中溶液碱性_____(增强,不变,减弱)。
第二步:将试管中无色溶液取少量于另一支试管中,滴入氢氧化钠溶液,发现溶液颜色变为_____。说明了什么?
第三步:蒸发烧杯内无色液体,发现有________,会是氢氧化钠晶体吗?
实验探究,印象深刻
红色
升高
减弱
红色
白色晶体
OH
Na
H
Cl
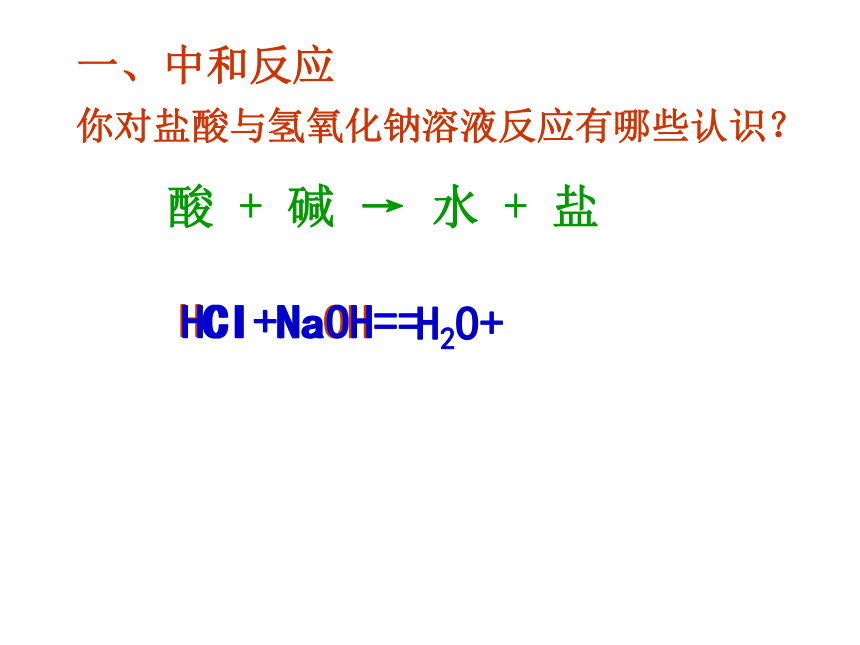
你对盐酸与氢氧化钠溶液反应有哪些认识?
一、中和反应
HCl+NaOH==
H2O+
酸
+
碱
→
水
+
盐
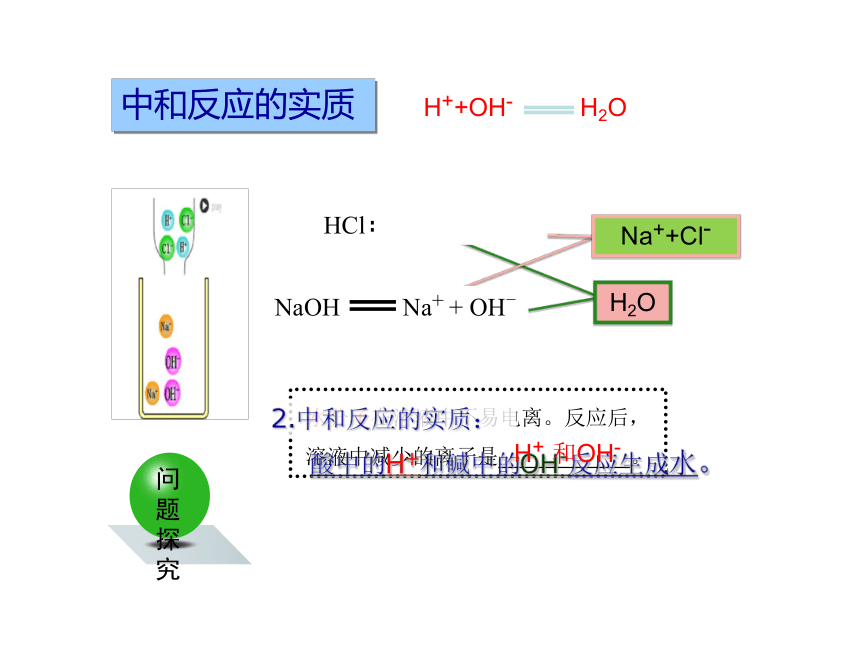
水分子在溶液中不易电离。反应后,
溶液中减少的离子是
。
酸中的H+和碱中的OH-反应生成水。
问题探究
HCl
H+
+
Cl-
H++OH-
H2O
H2O
Na++Cl-
H+
和OH-
2.中和反应的实质:
中和反应的实质
NaOH
Na+
+
OH-
随学随练,效果好
下列属于复分解反应的是(
),属于中和反应的是(
),属于氧化反应的是(
)。
A.
Zn
+
2HCl
==
ZnCl2
+
H2↑
B.
CuO
+
2HCl
==
CuCl2
+
H2O
C.
Cu(OH)2
+
H2SO4==
CuSO4
+
2H2O
D.
H2CO3
==
H2O
+
CO2↑
E.
H2
+
O2
==
2H2O
B、C
C
置换反应
分解反应
点燃
化合反应
复分解反应
复分解反应
中和反应属于复分解反应!
中和反应、氧化反应不属于基本反应类型!
E
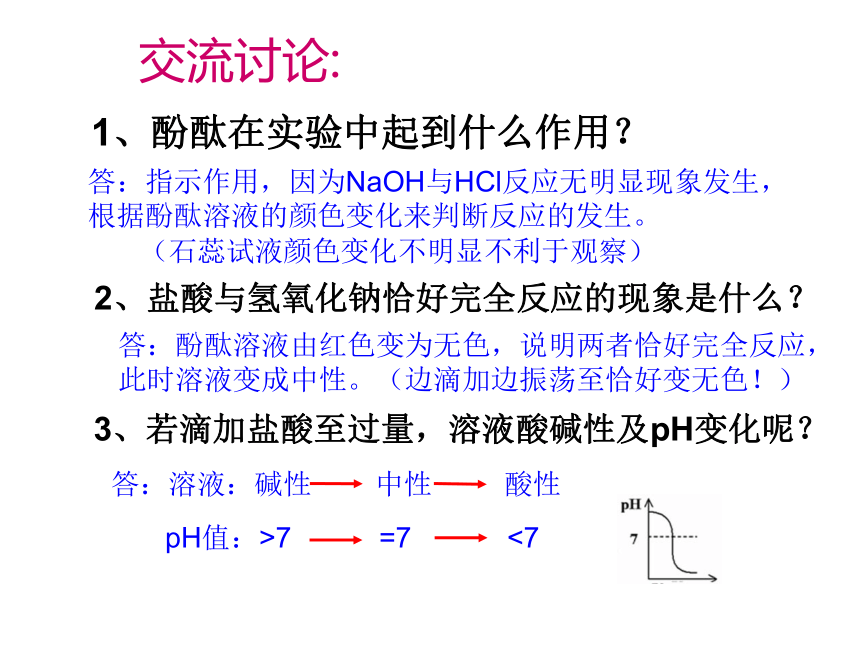
交流讨论:
1、酚酞在实验中起到什么作用?
2、盐酸与氢氧化钠恰好完全反应的现象是什么?
3、若滴加盐酸至过量,溶液酸碱性及pH变化呢?
答:指示作用,因为NaOH与HCl反应无明显现象发生,根据酚酞溶液的颜色变化来判断反应的发生。
答:酚酞溶液由红色变为无色,说明两者恰好完全反应,此时溶液变成中性。(边滴加边振荡至恰好变无色!)
答:溶液:碱性
中性
酸性
pH值:>7
=7
<7
(石蕊试液颜色变化不明显不利于观察)
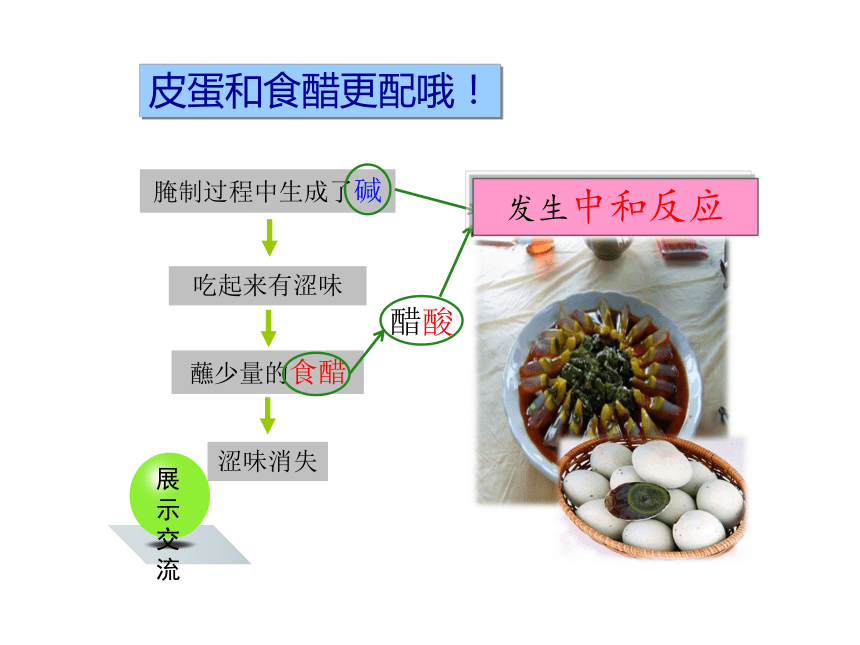
展示交流
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生中和反应
皮蛋和食醋更配哦!
二、中和反应在实际中的应用
1
.农业上:改变土壤的酸碱性
⑴酸性土壤:
如用熟石灰改良酸性土壤
⑵碱性土壤:
如用碳酸饮料浇树
改良土壤的碱性
促进植物的光合作用
2.工业上:处理工厂的废水
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
H2SO4+
Ca(OH)2=CaSO4+2H2O
(1)酸性废水:
(2)碱性废水:
如造纸厂的废水
3.用于医药
胃酸(主要HCl)过多的病人,可以服用含氢氧化铝的药来治病。
铝离子对身体有不良作用,所以氢氧化铝的药物逐渐被取代,改用含氢氧化镁的药物。
3HCl+Al(OH)3=AlCl3+3H2O
中和胃酸
2HCl+Mg(OH)2=MgCl2+2H2O
蚊虫能分泌出蚁酸,使皮肤肿痛,怎么办呢?
可以涂一些含有碱性物质(如肥皂水、牙膏或NH3·H2O)等药水,就可以减轻痛痒。
你能帮助他吗?
思考:
改良酸性土壤、治疗胃酸过多时,为什么不使用NaOH呢?
NaOH具有强烈的腐蚀性
中和
反应
定义
课堂小结
本质
应用
酸
+
碱
→
水
+
盐
H++OH-
H2O
改变土壤、工业废水酸碱性
治疗胃酸过多,蚊虫叮咬等等
1.能与盐酸发生中和反应的是(
)
A.铁
B.大理石
C.氧化铜
D.氢氧化钠
2.小烧杯中盛有含石蕊试液的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是(
)
A.紫色—红色—蓝色
B.蓝色—紫色—红色
C.蓝色—红色—紫色
D.紫色—蓝色—红色
3.芋艿(俗称毛芋)是一种常见的食品,新鲜芋艿在去皮时会出现一种白色的汁液,汁液内含有一种碱性物质,沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是(
)
A.食醋
B.料酒
C.纯碱
D.食盐水
B
D
A
H+
和OH-
练一练:
碱性
中性
酸性
4.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是(
)
A.用熟石灰改良酸性土壤
B.用盐酸除去铁锈
C.用含氢氧化镁的药物治疗胃酸过多
D.用氨水(NH3·H2O)处理工厂的硫酸
5.下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是(
)
A.Fe和CuSO4溶液
B.Zn和稀硫酸
C.NaOH溶液和稀盐酸
D.澄清石灰水和CO2
B
C
Fe2O3+6HCl=2FeCl3+3H2O
红色固体析出
气泡
澄清石灰水变浑浊
HCl+NaOH=NaCl+H2O
熟石灰和硫酸铜配制波尔多液(杀菌剂)
6.下列关于物质的用途的叙述不正确的是
(
)
A.盐酸可用来除铁锈
B.稀硫酸在实验室里常用作干燥剂
C.氢氧化钠可用作制肥皂和造纸工业
D.熟石灰可用来改良酸性土壤
7.某化学兴趣小组利用稀盐酸和氢氧化钠溶液来探究中和反应的规律时,某溶液的pH随时间的变化如图所示,则a点所示溶液中的溶质是(
)
A.HCl NaOH
B.NaCl
C.NaCl NaOH
D.NaCl HCl
C
B
HCl+NaOH=NaCl+H2O
NaOH
浓硫酸
8.将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示:
(1)由图知,稀盐酸与氢氧化钠溶液发生的反应是
(填“放热”或“吸热”)反应。?
(2)从A到B过程中,烧杯中溶液的pH逐渐
,B点表示的含义是
。?
放热
减小
氢氧化钠和盐酸恰好完全反应
9.“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。请结合下图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式:
。?
(2)写出图中C方框内甲、乙两种粒子的符号:
甲
、乙 。?
(3)从微观的角度分析,上述反应的实质是
(填粒子符号,下同)和
结合成H2O。?
Na+
H+
OH-
10、小王同学以酚酞做指示剂做稀盐酸与氢氧化钠溶液的中和实验,如图所示:
(1)推测小王是向稀盐酸中滴加氢氧化钠溶液,还是向氢氧化钠溶液中滴加稀盐酸?
7
pH
A
B
C
是向氢氧化钠溶液中滴加稀盐酸
红色
无色
NaCl,NaOH
NaCl
NaCl,HCl
无色
(2)实验过程中取三点,试推测这三点溶液的颜色:A
;B
;C
.
(3)再推测这三点溶液所含的溶质(不含酚酞)
A:
B:
C:
.
作业:
1
、完成课本第2节课后练习的全部内容,明天讲评;
2、完成《探究与训练》第七章第二节全部内容,明天上课复习第二节内容;
3、存在问题及时和化学老师沟通。
————中和反应
第七章
应用广泛的酸碱盐
第二节
常见的酸和碱(3)
思考:
为什么吃皮蛋的时候要放食醋呢?
第一步:往氢氧化钠溶液中滴入酚酞试液,振荡观察,溶液颜色由无色逐渐变为______
,插入一根温度计,测量此时溶液的温度,往溶液中逐滴滴入盐酸至溶液刚好变为无色时,溶液温度______(升高,降低,不变)
,实验过程中溶液碱性_____(增强,不变,减弱)。
第二步:将试管中无色溶液取少量于另一支试管中,滴入氢氧化钠溶液,发现溶液颜色变为_____。说明了什么?
第三步:蒸发烧杯内无色液体,发现有________,会是氢氧化钠晶体吗?
实验探究,印象深刻
红色
升高
减弱
红色
白色晶体
OH
Na
H
Cl
你对盐酸与氢氧化钠溶液反应有哪些认识?
一、中和反应
HCl+NaOH==
H2O+
酸
+
碱
→
水
+
盐
水分子在溶液中不易电离。反应后,
溶液中减少的离子是
。
酸中的H+和碱中的OH-反应生成水。
问题探究
HCl
H+
+
Cl-
H++OH-
H2O
H2O
Na++Cl-
H+
和OH-
2.中和反应的实质:
中和反应的实质
NaOH
Na+
+
OH-
随学随练,效果好
下列属于复分解反应的是(
),属于中和反应的是(
),属于氧化反应的是(
)。
A.
Zn
+
2HCl
==
ZnCl2
+
H2↑
B.
CuO
+
2HCl
==
CuCl2
+
H2O
C.
Cu(OH)2
+
H2SO4==
CuSO4
+
2H2O
D.
H2CO3
==
H2O
+
CO2↑
E.
H2
+
O2
==
2H2O
B、C
C
置换反应
分解反应
点燃
化合反应
复分解反应
复分解反应
中和反应属于复分解反应!
中和反应、氧化反应不属于基本反应类型!
E
交流讨论:
1、酚酞在实验中起到什么作用?
2、盐酸与氢氧化钠恰好完全反应的现象是什么?
3、若滴加盐酸至过量,溶液酸碱性及pH变化呢?
答:指示作用,因为NaOH与HCl反应无明显现象发生,根据酚酞溶液的颜色变化来判断反应的发生。
答:酚酞溶液由红色变为无色,说明两者恰好完全反应,此时溶液变成中性。(边滴加边振荡至恰好变无色!)
答:溶液:碱性
中性
酸性
pH值:>7
=7
<7
(石蕊试液颜色变化不明显不利于观察)
展示交流
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生中和反应
皮蛋和食醋更配哦!
二、中和反应在实际中的应用
1
.农业上:改变土壤的酸碱性
⑴酸性土壤:
如用熟石灰改良酸性土壤
⑵碱性土壤:
如用碳酸饮料浇树
改良土壤的碱性
促进植物的光合作用
2.工业上:处理工厂的废水
硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
H2SO4+
Ca(OH)2=CaSO4+2H2O
(1)酸性废水:
(2)碱性废水:
如造纸厂的废水
3.用于医药
胃酸(主要HCl)过多的病人,可以服用含氢氧化铝的药来治病。
铝离子对身体有不良作用,所以氢氧化铝的药物逐渐被取代,改用含氢氧化镁的药物。
3HCl+Al(OH)3=AlCl3+3H2O
中和胃酸
2HCl+Mg(OH)2=MgCl2+2H2O
蚊虫能分泌出蚁酸,使皮肤肿痛,怎么办呢?
可以涂一些含有碱性物质(如肥皂水、牙膏或NH3·H2O)等药水,就可以减轻痛痒。
你能帮助他吗?
思考:
改良酸性土壤、治疗胃酸过多时,为什么不使用NaOH呢?
NaOH具有强烈的腐蚀性
中和
反应
定义
课堂小结
本质
应用
酸
+
碱
→
水
+
盐
H++OH-
H2O
改变土壤、工业废水酸碱性
治疗胃酸过多,蚊虫叮咬等等
1.能与盐酸发生中和反应的是(
)
A.铁
B.大理石
C.氧化铜
D.氢氧化钠
2.小烧杯中盛有含石蕊试液的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是(
)
A.紫色—红色—蓝色
B.蓝色—紫色—红色
C.蓝色—红色—紫色
D.紫色—蓝色—红色
3.芋艿(俗称毛芋)是一种常见的食品,新鲜芋艿在去皮时会出现一种白色的汁液,汁液内含有一种碱性物质,沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是(
)
A.食醋
B.料酒
C.纯碱
D.食盐水
B
D
A
H+
和OH-
练一练:
碱性
中性
酸性
4.中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是(
)
A.用熟石灰改良酸性土壤
B.用盐酸除去铁锈
C.用含氢氧化镁的药物治疗胃酸过多
D.用氨水(NH3·H2O)处理工厂的硫酸
5.下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是(
)
A.Fe和CuSO4溶液
B.Zn和稀硫酸
C.NaOH溶液和稀盐酸
D.澄清石灰水和CO2
B
C
Fe2O3+6HCl=2FeCl3+3H2O
红色固体析出
气泡
澄清石灰水变浑浊
HCl+NaOH=NaCl+H2O
熟石灰和硫酸铜配制波尔多液(杀菌剂)
6.下列关于物质的用途的叙述不正确的是
(
)
A.盐酸可用来除铁锈
B.稀硫酸在实验室里常用作干燥剂
C.氢氧化钠可用作制肥皂和造纸工业
D.熟石灰可用来改良酸性土壤
7.某化学兴趣小组利用稀盐酸和氢氧化钠溶液来探究中和反应的规律时,某溶液的pH随时间的变化如图所示,则a点所示溶液中的溶质是(
)
A.HCl NaOH
B.NaCl
C.NaCl NaOH
D.NaCl HCl
C
B
HCl+NaOH=NaCl+H2O
NaOH
浓硫酸
8.将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示:
(1)由图知,稀盐酸与氢氧化钠溶液发生的反应是
(填“放热”或“吸热”)反应。?
(2)从A到B过程中,烧杯中溶液的pH逐渐
,B点表示的含义是
。?
放热
减小
氢氧化钠和盐酸恰好完全反应
9.“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。请结合下图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题。
(1)写出氢氧化钠溶液和稀硫酸反应的化学方程式:
。?
(2)写出图中C方框内甲、乙两种粒子的符号:
甲
、乙 。?
(3)从微观的角度分析,上述反应的实质是
(填粒子符号,下同)和
结合成H2O。?
Na+
H+
OH-
10、小王同学以酚酞做指示剂做稀盐酸与氢氧化钠溶液的中和实验,如图所示:
(1)推测小王是向稀盐酸中滴加氢氧化钠溶液,还是向氢氧化钠溶液中滴加稀盐酸?
7
pH
A
B
C
是向氢氧化钠溶液中滴加稀盐酸
红色
无色
NaCl,NaOH
NaCl
NaCl,HCl
无色
(2)实验过程中取三点,试推测这三点溶液的颜色:A
;B
;C
.
(3)再推测这三点溶液所含的溶质(不含酚酞)
A:
B:
C:
.
作业:
1
、完成课本第2节课后练习的全部内容,明天讲评;
2、完成《探究与训练》第七章第二节全部内容,明天上课复习第二节内容;
3、存在问题及时和化学老师沟通。
