沪教版九年级化学下册7.3.1盐-课件(共28张PPT)
文档属性
| 名称 | 沪教版九年级化学下册7.3.1盐-课件(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1020.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
第三节
几种重要的盐(1)
盐的性质
食盐NaCl
CuSO4·5H2O
高锰酸钾KMnO4
1、某10岁少年因食用非法销售的工业食盐而中毒殒命。
2、某女大学生一口气吃了十多根火腿肠,出现休克现象。经医院抢救后脱险。
新闻事件两则
原因是食品中的食盐含有亚硝酸钠NaNO2
氯化钠、硫酸钠、碳酸钠、硝酸铵
以下物质都是盐,写出其化学式及其电离方程式:
NH4NO3
===
NH4+
+
NO3-
Na2CO3
===
2Na+
+
CO32-
Na2SO4
===
2Na+
+
SO42
-
NaCl
===
Na+
+
Cl-
电离时能产生金属离子(或铵根离子)和酸根离子的化合物,叫做盐。
温故知新:什么是盐?
一、盐的分类
1)依据组成盐的阳离子和酸根的种类对其进行分类:
按阳离子可以把盐分成钾盐、钠盐、钙盐等。
如:Na
Cl
、Na
NO3
、
Na2
SO4
、
Na2CO3就是钠盐。
按阴离子也可以把盐分成盐酸盐、硫酸盐、硝酸盐、碳酸盐等。
如:K
Cl、Na
Cl
、
NH4
Cl
、
AgCl
、
BaCl2
都是盐酸盐。
2)依据盐的溶解性分:
可溶性盐、难溶性盐。
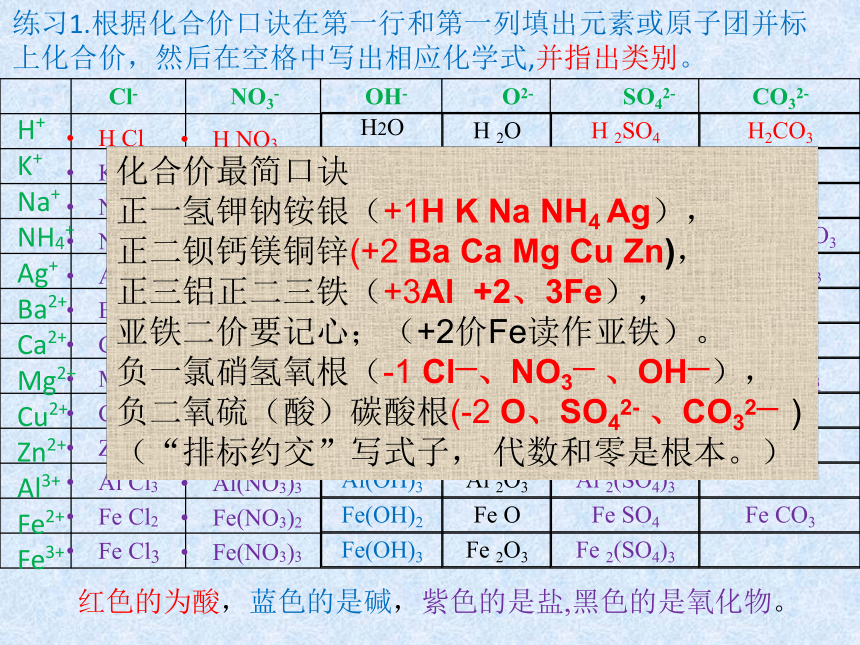
练习1.根据化合价口诀在第一行和第一列填出元素或原子团并标上化合价,然后在空格中写出相应化学式,并指出类别。
红色的为酸,蓝色的是碱,紫色的是盐,黑色的是氧化物。
H
Cl
K
Cl
Na
Cl
NH4
Cl
Ag
Cl
BaCl2
Ca
Cl2
Mg
Cl2
Cu
Cl2
Zn
Cl2
Al
Cl3
Fe
Cl2
Fe
Cl3
H
NO3
K
NO3
Na
NO3
NH4
NO3
Ag
NO3
Ba(NO3)2
Ca(NO3)2
Mg(NO3)2
Cu(NO3)2
Zn(NO3)2
Al(NO3)3
Fe(NO3)2
Fe(NO3)3
H2O
H
2O
H
2SO4
H2CO3
K
OH
K
2O
K
2SO4
K2CO3
Na
OH
Na2
O
Na2
SO4
Na2CO3
NH3·H2O
(NH4)2SO4
(NH4)2
CO3
Ag
2O
Ag
2SO4
Ag
2CO3
Ba(OH)2
Ba
O
Ba
SO4
Ba
CO3
Ca(OH)2
Ca
O
Ca
SO4
Ca
CO3
Mg(OH)2
Mg
O
Mg
SO4
Mg
CO3
Cu(OH)2
Cu
O
Cu
SO4
Zn(OH)2
Zn
O
Zn
SO4
Zn
CO3
Al(OH)3
Al
2O3
Al
2(SO4)3
Fe(OH)2
Fe
O
Fe
SO4
Fe
CO3
Fe(OH)3
Fe
2O3
Fe
2(SO4)3
H+
K+
Na+
NH4+
Ag+
Ba2+
Ca2+
Mg2+
Cu2+
Zn2+
Al3+
Fe2+
Fe3+
Cl-
NO3-
OH-
O2-
SO42-
CO32-
化合价最简口诀
正一氢钾钠铵银(+1H
K
Na
NH4
Ag),
正二钡钙镁铜锌(+2
Ba
Ca
Mg
Cu
Zn),
正三铝正二三铁(+3Al
+2、3Fe),
亚铁二价要记心;(+2价Fe读作亚铁)。
负一氯硝氢氧根(-1
Cl—、NO3—
、OH—),
负二氧硫(酸)碳酸根(-2
O、SO42-
、CO32—
)
(“排标约交”写式子,
代数和零是根本。)
练习2.将下列物质(或主要成分)的化学式填入相应的空格内:盐酸、碳酸、熟石灰、纯碱、大理石,硫酸、硝酸、苛性钠、碳酸氢钠、硝酸铵、干冰、生石灰。?
①属于酸的是________________________;
②属于碱的是____________________;
③属于盐的是_____________________________________;
④属于非金属氧化物的是_______;⑤属于金属氧化物的是______
练习3.写出由H、O、Cl、C、Cu
中的元素组成的下列各类化合物的化学式(各举一例):
酸____________碱_____________盐____________
非金属氧化物_____________金属氧化物___________
CuO
HCl
H2CO3
H2SO4
HNO3
Ca(OH)2
NaOH
Na2CO3
CaCO3
NaHCO3
NH4NO3
CO2
CaO
HCl
Cu(OH)2
CuCl2
H2O或CO2
(一)、盐的物理性质
1.颜色
大多数盐是白色固体,溶于水后得到无色溶液;
少数盐有颜色,它们是
:
蓝色的溶液—
CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液
浅绿色的溶液—FeSO4、FeCl2、Fe(NO3)2等含Fe2+溶液
黄色的溶液—FeCl3、Fe2(SO4)3等含Fe3+溶液
二、盐的性质
OH-
NO3-
Cl-
SO42-
CO32-
PO43-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
K+
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
Ag+
——
溶
不
微
不
不
Ba2+
溶
溶
溶
不
不
不
Ca2+
微
溶
溶
微
不
不
Mg2+
不
溶
溶
溶
微
不
Cu2+
不
溶
溶
溶
不
不
Zn2+
不
溶
溶
溶
不
不
Al3+
不
溶
溶
溶
——
不
Fe2+
不
溶
溶
溶
不
不
Fe3+
不
溶
溶
溶
——
不
2.酸、碱、盐的溶解性(20℃)P127
OH-
NO3-
Cl-
SO42-
CO32-
PO43-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
K+
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
Ag+
——
溶
不
微
不
不
Ba2+
溶
溶
溶
不
不
不
Ca2+
微
溶
溶
微
不
不
Mg2+
不
溶
溶
溶
微
不
Cu2+
不
溶
溶
溶
不
不
硫钡(BaSO4想象三国时的刘备)氯化银(AgCl)不行,
碱中还有Ba
[Ba(OH)2]可溶,碳磷几乎都不行
即:要记住4种溶的,再记住3个特殊的物质:
BaSO4↓
、AgCl↓、Ba(OH)2可溶就行了
还可以看出:三大强酸(HCl、H2SO4、HNO3)的盐较易溶;
碳酸盐、磷酸盐和碱大多数不溶。
一、盐的性质
1.物理性质—溶解性
不
不
溶
溶解性口诀:钾钠铵硝
(K、Na、
NH4、NO3)
全都溶,
扩展:酸溶性
多数不溶于水的物质可溶于酸。如碱和碳酸盐的沉淀都能溶于硝酸、盐酸等。
例如:Cu(OH)2+2HCl=CuCl2+2H2O
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
但AgCl和BaSO4不仅不溶于水也不溶于酸。因为:
AgCl+HNO3≠HCl+AgNO3
BaSO4+2HNO3≠Ba(NO3)2+H2SO4
Cl-
NO3-
OH-
O2-
SO42-
CO32-
H+
H
Cl
H
NO3
H
2O
H
2SO4
H2CO3
K+
K
Cl
K
NO3
K
OH
K
2O
K
2SO4
K2CO3
Na+
Na
Cl
Na
NO3
Na
OH
Na2
O
Na2
SO4
Na2CO3
NH4+
NH4
Cl
NH4
NO3
NH3·H2O
(NH4)2O
(NH4)2SO4
(NH4)2
CO3
Ag+
Ag
Cl
Ag
NO3
Ag
2O
Ag
2SO4
Ag
2CO3
Ba2+
BaCl2
Ba(NO3)2
Ba(OH)2
Ba
O
Ba
SO4
Ba
CO3
Ca2+
Ca
Cl2
Ca(NO3)2
Ca(OH)2
Ca
O
Ca
SO4
Ca
CO3
Mg2+
Mg
Cl2
Mg(NO3)2
Mg(OH)2
Mg
O
Mg
SO4
Mg
CO3
Cu2+
Cu
Cl2
Cu(NO3)2
Cu(OH)2
Cu
O
Cu
SO4
Zn2+
Zn
Cl2
Zn(NO3)2
Zn(OH)2
Zn
O
Zn
SO4
Zn
CO3
Al3+
Al
Cl3
Al(NO3)3
Al(OH)3
Al
2O3
Al
2(SO4)3
Fe2+
Fe
Cl2
Fe(NO3)2
Fe(OH)2
Fe
O
Fe
SO4
Fe
CO3
Fe3+
Fe
Cl3
Fe(NO3)3
Fe(OH)3
Fe
2O3
Fe
2(SO4)3
溶解性口诀:钾钠铵硝
(K、Na、
NH4、NO3)
全都溶,硫钡(硫酸钡BaSO4想象三国时的刘备)氯化银(AgCl)不行,碱中还有Ba
[Ba(OH)2]可溶,碳磷几乎都不行(碳酸盐和磷酸盐除钾钠铵外都不溶了)。即:熟记4种全溶的,3个特殊的:AgCl↓、BaSO4↓Ba(OH)2可溶即可。三大强酸(HCl、H2SO4、HNO3)的盐较易溶;
碳酸盐和碱大多数不溶。
练习1.在“根据化合价口诀填的表”中,用↓标注在不溶物质的后面(氧化物不标)
↓
↓
↓
↓
↓
↓
↓
↓
有颜色的溶液:蓝色:Cu(NO3)2、CuCl2、
Cu
SO4黄色:Fe(NO3)3
FeCl3Fe
2(SO4)3
浅绿色:Fe(NO3)2
FeCl2
Fe
SO4。沉淀的颜色有:Cu(OH)2蓝色沉淀,Fe(OH)3红褐色,其他均为白色沉淀,下划线的为微溶。
↓
↓
↓
↓
↓
√
√
√
√
√
练习2:
判断下列物质是可溶还是沉淀。
①NaOH
②CaCO3
③K2SO4
④BaSO4
⑤Cu(NO3)2
⑥AgCl
⑦(NH4)2CO3
⑧NaCl
⑨Mg(OH)2
⑩Ba(OH)2
⑾
Fe(OH)3
⑿MgCl2
⒀
AgNO3
⒁BaCO3
↓
↓
↓
↓
↓
↓
练习3.下列物质中不溶于水的有
__________________
既不溶于水也不溶于酸的有__________。
①NH4HCO3②KCl③Na2CO3④Mg(NO3)2⑤AgCl
⑥BaSO4⑦BaCO3⑧Ag2CO3⑨Ba(OH)2⑩Cu(OH)2
练习4.下列各组物质中,都能溶于水的是(
)
A.CO2
CaO
Na20
Fe2O3
B.CuCl2
BaSO4
Mg(OH)2
C.KOH
AgCl
CuCO3
D.Ba(OH)2
NH4Cl
K2CO3
5、6、7、8、10
5、6
D
实验操作
现象
与盐的作用
NaCl+AgNO3
Na2SO4+BaCl2
有白色沉淀生成
有白色沉淀生成
探究:
(二)、
盐的化学性质
实验操作
方程
结论
与盐的作用
NaCl+AgNO3
与盐的作用生成两种______
NaCl+AgNO3
=
AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2
=
BaSO4↓+2NaCl
新盐
盐
+
盐
→
新盐
+
新盐(复分解反应)
小结:盐的化学性质
规律:盐1+X1→盐2+X2
(X同类物质)
即反应物和生成物的类别不变。
1.盐+金属→新盐+金属
2AgNO3+Cu=2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
3.盐+碱→新盐+新碱
FeCl3+3NaOH=3NaCl+
Fe(OH)3↓
4.盐+盐→新盐+新盐
CuSO4+BaCl2=BaSO4↓+CuCl2
下列金属和盐溶液能否反应置换出金属?为什么?
1.Cu+FeSO4
=
2.Zn+FeSO4
=
3.Fe+CuSO4
=
4.Fe+AgCl
=
5.
Na+CuSO4
=
ZnSO4+Fe
FeSO4
+Cu
2
Na
+
2H2O
=
2
NaOH
+H2↑
2
NaOH+
CuSO4
=
Na2SO4
+Cu(OH)2↓
Na2SO4+
Cu
2
置换反应条件:
盐须溶,
K
Ca
Na不能行
(太活泼,能和水反应)
前置后
Cu没有Fe活泼
AgCl不溶
三、金属和盐反应条件
思路1:中间金、两边盐
练习:选择适当的试剂确定Al、
Fe
、
Cu的活动性顺序
思路2:中间盐、两边金
所选物质:AlCl3
Fe
CuSO4
所选物质:Al
FeSO4
Cu
规律:
验证金属的活动性顺序原则是:
①所选物质必须含有要确定的金属元素;
②相邻两种物质的类别不同。
所选物质:
AlCl3
、
FeSO4
、
Cu行吗?
不行,不能验出Al、
Fe的活泼性
K2SO4
+
NaNO3
Na+、SO42-
2K+、2NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4
+
KNO3
==
2Na+、2NO3-
四、复分解反应的条件
2
2
×
Ca2+、2OH-
2H+、SO4
2
-
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+
H2SO4——
CaSO4
+2H2O
——
溶液中反应的离子变化
+2H2O
四、复分解反应的条件
口诀:双交换,价不变,生成气体、水、沉淀;
盐-盐、盐-碱须可溶,弱酸制强不能行。
练习1:下列物质间能否反应?能反应的写出方程式,
不能反应的说明理由。
①Fe2O3+H2SO4=
②Ca(OH)2+Na2CO3=
③KOH+Na2CO3=
④BaCO3+Na2SO4=
⑤Cu(OH)2+MgSO4=
⑥CaCl2+H2CO3=
解析:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③不能2KOH+Na2CO3≠2NaOH+K2CO3
无气体、水、沉淀生成
④不能BaCO3+Na2SO4≠BaSO4↓+Na2CO3
BaCO3不溶于水
⑤不能Cu(OH)2+MgSO4≠CuSO4+Mg(OH)2↓
Cu(OH)2不溶于水
⑥不能CaCl2+H2CO3≠CaCO3↓+2HCl
因为:CaCO3+2HCl=CaCl2+H2O+CO2↑弱酸制强不能行啊
练习2:下列物质间能否反应?能反应的写出方程式,不能反应的说明理由。
1.BaCl2+H2SO4=
2.Na2CO3+
HCl=
3.K2SO4+HCl=
4.FeCl3+
NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+
HNO3=
BaSO4↓+2HCl
2
2NaCl+H2O+CO2↑
3
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3
Fe(NO3)3+3H2O
不能,无气体、水、沉淀生成
不能,无气体、水、沉淀生成
1.从Fe、H2O、CO2、NaOH、Ba(NO3)2、H2SO4、CuCl2、BaCl2、Na2SO4、KMnO4、MgSO411种物质中选择适当物质(每种物质只允许使用一次),分别写出符合下列要求的化学方程式:
(1)化合反应_________;(2)分解反应____;
(3)置换反应_______________________;
(4)酸和盐的复分解反应______________________;
(5)碱与盐反应_____________________;
(6)盐与盐反应 _____________________________。
(1)CO2+H2O═H2CO3;
(2)2KMnO4
△
K2MnO4+MnO2+O2↑
(3)Fe+CuCl2═Cu+FeCl2;
(4)H2SO4+Ba
(NO3)2
═
BaSO4↓+2HNO3;
(5)2NaOH+CuSO4
═
Cu(OH)2↓+Na2SO4
(6)Na2SO4+BaCl2
═
BaSO4↓+2NaCl
五、综合测试
2.2008年春季,特大暴风雪袭击了我国南方地区,在抗击暴风雪的战斗中,融雪剂发挥了—定的作用。小明现有一包某公司生产的融雪剂,已知它由碳酸钠、氯化镁、硫酸铜、氯化钠中的一种或几种物质组成。
[提出问题]该公司生产的融雪剂到底含有什么物质呢?
[查阅资料]含钠元素的物质在酒精灯的火焰上灼烧时会产生黄色火焰。
[实验探究]下面是小明设计的探究实验,请你帮他完成。
实验操作
实验现象
结论
①取少量融雪剂,加水溶解
得无色溶液
不含______物质
②另取少量融雪剂,滴加稀硫酸
无明显现象
________
③向该融雪剂的水溶液中滴加氢氧化钠溶液
出现白色沉淀
________
④________________________________
____________
?含有氯化钠
?[反思和评价]
(1)写出③中反应的化学方程式_________________________________。
(2)融雪剂融雪的原理是____________________。
(3)使用融雪剂有很多危害,例如会腐蚀道路、桥梁。请你再举一例_______________________
。
硫酸铜
不含碳酸钠
含有氯化镁
取少量融雪剂在酒精灯的火焰上灼烧
产生黄色火焰
MgCl2+2NaOH?=Mg(OH)2↓+2NaCl
污染水,污染土壤等等
降低了溶液的凝固点
徐州市中考题解析
再见!
课后作业:完成探究与训练7.3.1
第三节
几种重要的盐(1)
盐的性质
食盐NaCl
CuSO4·5H2O
高锰酸钾KMnO4
1、某10岁少年因食用非法销售的工业食盐而中毒殒命。
2、某女大学生一口气吃了十多根火腿肠,出现休克现象。经医院抢救后脱险。
新闻事件两则
原因是食品中的食盐含有亚硝酸钠NaNO2
氯化钠、硫酸钠、碳酸钠、硝酸铵
以下物质都是盐,写出其化学式及其电离方程式:
NH4NO3
===
NH4+
+
NO3-
Na2CO3
===
2Na+
+
CO32-
Na2SO4
===
2Na+
+
SO42
-
NaCl
===
Na+
+
Cl-
电离时能产生金属离子(或铵根离子)和酸根离子的化合物,叫做盐。
温故知新:什么是盐?
一、盐的分类
1)依据组成盐的阳离子和酸根的种类对其进行分类:
按阳离子可以把盐分成钾盐、钠盐、钙盐等。
如:Na
Cl
、Na
NO3
、
Na2
SO4
、
Na2CO3就是钠盐。
按阴离子也可以把盐分成盐酸盐、硫酸盐、硝酸盐、碳酸盐等。
如:K
Cl、Na
Cl
、
NH4
Cl
、
AgCl
、
BaCl2
都是盐酸盐。
2)依据盐的溶解性分:
可溶性盐、难溶性盐。
练习1.根据化合价口诀在第一行和第一列填出元素或原子团并标上化合价,然后在空格中写出相应化学式,并指出类别。
红色的为酸,蓝色的是碱,紫色的是盐,黑色的是氧化物。
H
Cl
K
Cl
Na
Cl
NH4
Cl
Ag
Cl
BaCl2
Ca
Cl2
Mg
Cl2
Cu
Cl2
Zn
Cl2
Al
Cl3
Fe
Cl2
Fe
Cl3
H
NO3
K
NO3
Na
NO3
NH4
NO3
Ag
NO3
Ba(NO3)2
Ca(NO3)2
Mg(NO3)2
Cu(NO3)2
Zn(NO3)2
Al(NO3)3
Fe(NO3)2
Fe(NO3)3
H2O
H
2O
H
2SO4
H2CO3
K
OH
K
2O
K
2SO4
K2CO3
Na
OH
Na2
O
Na2
SO4
Na2CO3
NH3·H2O
(NH4)2SO4
(NH4)2
CO3
Ag
2O
Ag
2SO4
Ag
2CO3
Ba(OH)2
Ba
O
Ba
SO4
Ba
CO3
Ca(OH)2
Ca
O
Ca
SO4
Ca
CO3
Mg(OH)2
Mg
O
Mg
SO4
Mg
CO3
Cu(OH)2
Cu
O
Cu
SO4
Zn(OH)2
Zn
O
Zn
SO4
Zn
CO3
Al(OH)3
Al
2O3
Al
2(SO4)3
Fe(OH)2
Fe
O
Fe
SO4
Fe
CO3
Fe(OH)3
Fe
2O3
Fe
2(SO4)3
H+
K+
Na+
NH4+
Ag+
Ba2+
Ca2+
Mg2+
Cu2+
Zn2+
Al3+
Fe2+
Fe3+
Cl-
NO3-
OH-
O2-
SO42-
CO32-
化合价最简口诀
正一氢钾钠铵银(+1H
K
Na
NH4
Ag),
正二钡钙镁铜锌(+2
Ba
Ca
Mg
Cu
Zn),
正三铝正二三铁(+3Al
+2、3Fe),
亚铁二价要记心;(+2价Fe读作亚铁)。
负一氯硝氢氧根(-1
Cl—、NO3—
、OH—),
负二氧硫(酸)碳酸根(-2
O、SO42-
、CO32—
)
(“排标约交”写式子,
代数和零是根本。)
练习2.将下列物质(或主要成分)的化学式填入相应的空格内:盐酸、碳酸、熟石灰、纯碱、大理石,硫酸、硝酸、苛性钠、碳酸氢钠、硝酸铵、干冰、生石灰。?
①属于酸的是________________________;
②属于碱的是____________________;
③属于盐的是_____________________________________;
④属于非金属氧化物的是_______;⑤属于金属氧化物的是______
练习3.写出由H、O、Cl、C、Cu
中的元素组成的下列各类化合物的化学式(各举一例):
酸____________碱_____________盐____________
非金属氧化物_____________金属氧化物___________
CuO
HCl
H2CO3
H2SO4
HNO3
Ca(OH)2
NaOH
Na2CO3
CaCO3
NaHCO3
NH4NO3
CO2
CaO
HCl
Cu(OH)2
CuCl2
H2O或CO2
(一)、盐的物理性质
1.颜色
大多数盐是白色固体,溶于水后得到无色溶液;
少数盐有颜色,它们是
:
蓝色的溶液—
CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液
浅绿色的溶液—FeSO4、FeCl2、Fe(NO3)2等含Fe2+溶液
黄色的溶液—FeCl3、Fe2(SO4)3等含Fe3+溶液
二、盐的性质
OH-
NO3-
Cl-
SO42-
CO32-
PO43-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
K+
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
Ag+
——
溶
不
微
不
不
Ba2+
溶
溶
溶
不
不
不
Ca2+
微
溶
溶
微
不
不
Mg2+
不
溶
溶
溶
微
不
Cu2+
不
溶
溶
溶
不
不
Zn2+
不
溶
溶
溶
不
不
Al3+
不
溶
溶
溶
——
不
Fe2+
不
溶
溶
溶
不
不
Fe3+
不
溶
溶
溶
——
不
2.酸、碱、盐的溶解性(20℃)P127
OH-
NO3-
Cl-
SO42-
CO32-
PO43-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
K+
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
Ag+
——
溶
不
微
不
不
Ba2+
溶
溶
溶
不
不
不
Ca2+
微
溶
溶
微
不
不
Mg2+
不
溶
溶
溶
微
不
Cu2+
不
溶
溶
溶
不
不
硫钡(BaSO4想象三国时的刘备)氯化银(AgCl)不行,
碱中还有Ba
[Ba(OH)2]可溶,碳磷几乎都不行
即:要记住4种溶的,再记住3个特殊的物质:
BaSO4↓
、AgCl↓、Ba(OH)2可溶就行了
还可以看出:三大强酸(HCl、H2SO4、HNO3)的盐较易溶;
碳酸盐、磷酸盐和碱大多数不溶。
一、盐的性质
1.物理性质—溶解性
不
不
溶
溶解性口诀:钾钠铵硝
(K、Na、
NH4、NO3)
全都溶,
扩展:酸溶性
多数不溶于水的物质可溶于酸。如碱和碳酸盐的沉淀都能溶于硝酸、盐酸等。
例如:Cu(OH)2+2HCl=CuCl2+2H2O
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
但AgCl和BaSO4不仅不溶于水也不溶于酸。因为:
AgCl+HNO3≠HCl+AgNO3
BaSO4+2HNO3≠Ba(NO3)2+H2SO4
Cl-
NO3-
OH-
O2-
SO42-
CO32-
H+
H
Cl
H
NO3
H
2O
H
2SO4
H2CO3
K+
K
Cl
K
NO3
K
OH
K
2O
K
2SO4
K2CO3
Na+
Na
Cl
Na
NO3
Na
OH
Na2
O
Na2
SO4
Na2CO3
NH4+
NH4
Cl
NH4
NO3
NH3·H2O
(NH4)2O
(NH4)2SO4
(NH4)2
CO3
Ag+
Ag
Cl
Ag
NO3
Ag
2O
Ag
2SO4
Ag
2CO3
Ba2+
BaCl2
Ba(NO3)2
Ba(OH)2
Ba
O
Ba
SO4
Ba
CO3
Ca2+
Ca
Cl2
Ca(NO3)2
Ca(OH)2
Ca
O
Ca
SO4
Ca
CO3
Mg2+
Mg
Cl2
Mg(NO3)2
Mg(OH)2
Mg
O
Mg
SO4
Mg
CO3
Cu2+
Cu
Cl2
Cu(NO3)2
Cu(OH)2
Cu
O
Cu
SO4
Zn2+
Zn
Cl2
Zn(NO3)2
Zn(OH)2
Zn
O
Zn
SO4
Zn
CO3
Al3+
Al
Cl3
Al(NO3)3
Al(OH)3
Al
2O3
Al
2(SO4)3
Fe2+
Fe
Cl2
Fe(NO3)2
Fe(OH)2
Fe
O
Fe
SO4
Fe
CO3
Fe3+
Fe
Cl3
Fe(NO3)3
Fe(OH)3
Fe
2O3
Fe
2(SO4)3
溶解性口诀:钾钠铵硝
(K、Na、
NH4、NO3)
全都溶,硫钡(硫酸钡BaSO4想象三国时的刘备)氯化银(AgCl)不行,碱中还有Ba
[Ba(OH)2]可溶,碳磷几乎都不行(碳酸盐和磷酸盐除钾钠铵外都不溶了)。即:熟记4种全溶的,3个特殊的:AgCl↓、BaSO4↓Ba(OH)2可溶即可。三大强酸(HCl、H2SO4、HNO3)的盐较易溶;
碳酸盐和碱大多数不溶。
练习1.在“根据化合价口诀填的表”中,用↓标注在不溶物质的后面(氧化物不标)
↓
↓
↓
↓
↓
↓
↓
↓
有颜色的溶液:蓝色:Cu(NO3)2、CuCl2、
Cu
SO4黄色:Fe(NO3)3
FeCl3Fe
2(SO4)3
浅绿色:Fe(NO3)2
FeCl2
Fe
SO4。沉淀的颜色有:Cu(OH)2蓝色沉淀,Fe(OH)3红褐色,其他均为白色沉淀,下划线的为微溶。
↓
↓
↓
↓
↓
√
√
√
√
√
练习2:
判断下列物质是可溶还是沉淀。
①NaOH
②CaCO3
③K2SO4
④BaSO4
⑤Cu(NO3)2
⑥AgCl
⑦(NH4)2CO3
⑧NaCl
⑨Mg(OH)2
⑩Ba(OH)2
⑾
Fe(OH)3
⑿MgCl2
⒀
AgNO3
⒁BaCO3
↓
↓
↓
↓
↓
↓
练习3.下列物质中不溶于水的有
__________________
既不溶于水也不溶于酸的有__________。
①NH4HCO3②KCl③Na2CO3④Mg(NO3)2⑤AgCl
⑥BaSO4⑦BaCO3⑧Ag2CO3⑨Ba(OH)2⑩Cu(OH)2
练习4.下列各组物质中,都能溶于水的是(
)
A.CO2
CaO
Na20
Fe2O3
B.CuCl2
BaSO4
Mg(OH)2
C.KOH
AgCl
CuCO3
D.Ba(OH)2
NH4Cl
K2CO3
5、6、7、8、10
5、6
D
实验操作
现象
与盐的作用
NaCl+AgNO3
Na2SO4+BaCl2
有白色沉淀生成
有白色沉淀生成
探究:
(二)、
盐的化学性质
实验操作
方程
结论
与盐的作用
NaCl+AgNO3
与盐的作用生成两种______
NaCl+AgNO3
=
AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2
=
BaSO4↓+2NaCl
新盐
盐
+
盐
→
新盐
+
新盐(复分解反应)
小结:盐的化学性质
规律:盐1+X1→盐2+X2
(X同类物质)
即反应物和生成物的类别不变。
1.盐+金属→新盐+金属
2AgNO3+Cu=2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
3.盐+碱→新盐+新碱
FeCl3+3NaOH=3NaCl+
Fe(OH)3↓
4.盐+盐→新盐+新盐
CuSO4+BaCl2=BaSO4↓+CuCl2
下列金属和盐溶液能否反应置换出金属?为什么?
1.Cu+FeSO4
=
2.Zn+FeSO4
=
3.Fe+CuSO4
=
4.Fe+AgCl
=
5.
Na+CuSO4
=
ZnSO4+Fe
FeSO4
+Cu
2
Na
+
2H2O
=
2
NaOH
+H2↑
2
NaOH+
CuSO4
=
Na2SO4
+Cu(OH)2↓
Na2SO4+
Cu
2
置换反应条件:
盐须溶,
K
Ca
Na不能行
(太活泼,能和水反应)
前置后
Cu没有Fe活泼
AgCl不溶
三、金属和盐反应条件
思路1:中间金、两边盐
练习:选择适当的试剂确定Al、
Fe
、
Cu的活动性顺序
思路2:中间盐、两边金
所选物质:AlCl3
Fe
CuSO4
所选物质:Al
FeSO4
Cu
规律:
验证金属的活动性顺序原则是:
①所选物质必须含有要确定的金属元素;
②相邻两种物质的类别不同。
所选物质:
AlCl3
、
FeSO4
、
Cu行吗?
不行,不能验出Al、
Fe的活泼性
K2SO4
+
NaNO3
Na+、SO42-
2K+、2NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4
+
KNO3
==
2Na+、2NO3-
四、复分解反应的条件
2
2
×
Ca2+、2OH-
2H+、SO4
2
-
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+
H2SO4——
CaSO4
+2H2O
——
溶液中反应的离子变化
+2H2O
四、复分解反应的条件
口诀:双交换,价不变,生成气体、水、沉淀;
盐-盐、盐-碱须可溶,弱酸制强不能行。
练习1:下列物质间能否反应?能反应的写出方程式,
不能反应的说明理由。
①Fe2O3+H2SO4=
②Ca(OH)2+Na2CO3=
③KOH+Na2CO3=
④BaCO3+Na2SO4=
⑤Cu(OH)2+MgSO4=
⑥CaCl2+H2CO3=
解析:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③不能2KOH+Na2CO3≠2NaOH+K2CO3
无气体、水、沉淀生成
④不能BaCO3+Na2SO4≠BaSO4↓+Na2CO3
BaCO3不溶于水
⑤不能Cu(OH)2+MgSO4≠CuSO4+Mg(OH)2↓
Cu(OH)2不溶于水
⑥不能CaCl2+H2CO3≠CaCO3↓+2HCl
因为:CaCO3+2HCl=CaCl2+H2O+CO2↑弱酸制强不能行啊
练习2:下列物质间能否反应?能反应的写出方程式,不能反应的说明理由。
1.BaCl2+H2SO4=
2.Na2CO3+
HCl=
3.K2SO4+HCl=
4.FeCl3+
NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+
HNO3=
BaSO4↓+2HCl
2
2NaCl+H2O+CO2↑
3
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
3
Fe(NO3)3+3H2O
不能,无气体、水、沉淀生成
不能,无气体、水、沉淀生成
1.从Fe、H2O、CO2、NaOH、Ba(NO3)2、H2SO4、CuCl2、BaCl2、Na2SO4、KMnO4、MgSO411种物质中选择适当物质(每种物质只允许使用一次),分别写出符合下列要求的化学方程式:
(1)化合反应_________;(2)分解反应____;
(3)置换反应_______________________;
(4)酸和盐的复分解反应______________________;
(5)碱与盐反应_____________________;
(6)盐与盐反应 _____________________________。
(1)CO2+H2O═H2CO3;
(2)2KMnO4
△
K2MnO4+MnO2+O2↑
(3)Fe+CuCl2═Cu+FeCl2;
(4)H2SO4+Ba
(NO3)2
═
BaSO4↓+2HNO3;
(5)2NaOH+CuSO4
═
Cu(OH)2↓+Na2SO4
(6)Na2SO4+BaCl2
═
BaSO4↓+2NaCl
五、综合测试
2.2008年春季,特大暴风雪袭击了我国南方地区,在抗击暴风雪的战斗中,融雪剂发挥了—定的作用。小明现有一包某公司生产的融雪剂,已知它由碳酸钠、氯化镁、硫酸铜、氯化钠中的一种或几种物质组成。
[提出问题]该公司生产的融雪剂到底含有什么物质呢?
[查阅资料]含钠元素的物质在酒精灯的火焰上灼烧时会产生黄色火焰。
[实验探究]下面是小明设计的探究实验,请你帮他完成。
实验操作
实验现象
结论
①取少量融雪剂,加水溶解
得无色溶液
不含______物质
②另取少量融雪剂,滴加稀硫酸
无明显现象
________
③向该融雪剂的水溶液中滴加氢氧化钠溶液
出现白色沉淀
________
④________________________________
____________
?含有氯化钠
?[反思和评价]
(1)写出③中反应的化学方程式_________________________________。
(2)融雪剂融雪的原理是____________________。
(3)使用融雪剂有很多危害,例如会腐蚀道路、桥梁。请你再举一例_______________________
。
硫酸铜
不含碳酸钠
含有氯化镁
取少量融雪剂在酒精灯的火焰上灼烧
产生黄色火焰
MgCl2+2NaOH?=Mg(OH)2↓+2NaCl
污染水,污染土壤等等
降低了溶液的凝固点
徐州市中考题解析
再见!
课后作业:完成探究与训练7.3.1
