沪教版九年级化学下册 7.2.2常见的碱-课件(共22张PPT)
文档属性
| 名称 | 沪教版九年级化学下册 7.2.2常见的碱-课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-05-31 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第2节 常见的酸和碱
7.2.2 常见的碱
A
+
C
=
B
A
B
D
C
D
+
由两种化合物互相交换成分生成另外两种化合物
反应叫做复分解反应。
书写原则:
等价交换
Fe2 O3 + 6HCl= 2FeCl3 + 3H2O
+3 -2 +1 -1
+3 -1 +1 -2
温故知新:盐酸除铁锈
再如:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
氢氧化钠 NaOH
氢氧化钙Ca(OH)2
氨水NH3·H2O
常见的碱
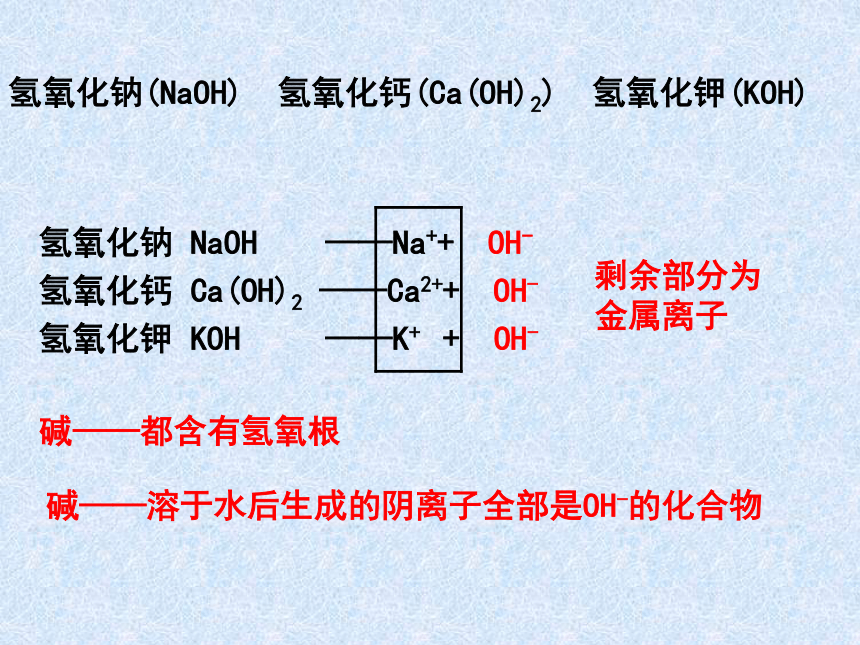
氢氧化钠(NaOH) 氢氧化钙(Ca(OH)2) 氢氧化钾(KOH)
氢氧化钠 NaOH ——Na++ OH-
氢氧化钙 Ca(OH)2 ——Ca2++ OH-
氢氧化钾 KOH ——K+ + OH-
碱——都含有氢氧根
碱——溶于水后生成的阴离子全部是OH-的化合物
剩余部分为金属离子
你了解它们的性质吗?它们在生产、生活中有哪些应用?
1.观察固体烧碱、消石灰和氨水的颜色、状态,正确地闻氨水的气味。在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。
2.在试管中加一些固体氢氧化钠,加入水,振荡,观察它的溶解过程,并摸一摸试管,感觉溶液温度的变化。
[活动与探究1]
常见的碱
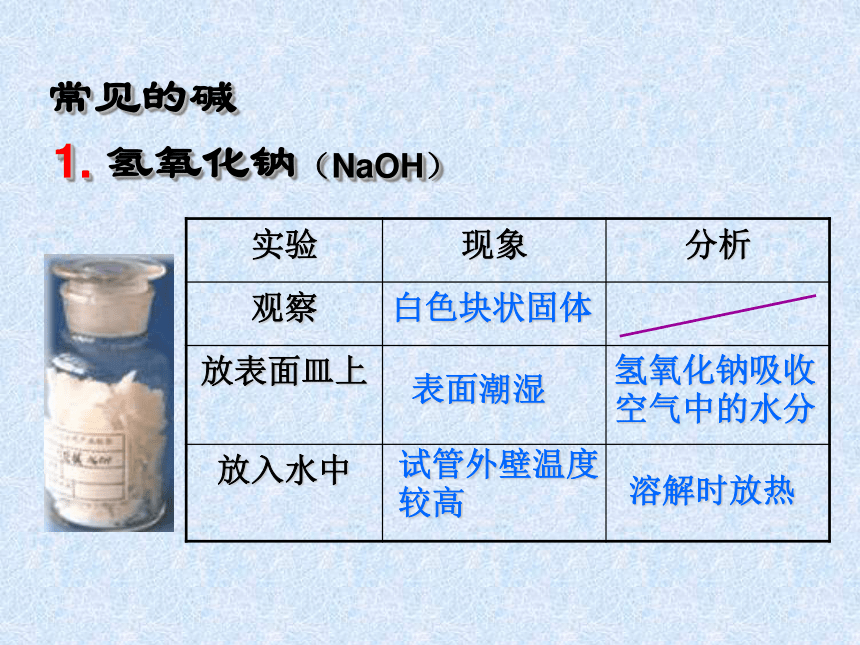
1. 氢氧化钠(NaOH)
实验 现象 分析
观察
放表面皿上
放入水中
白色块状固体
表面潮湿
试管外壁温度较高
氢氧化钠吸收空气中的水分
溶解时放热
①氢氧化钠是白色的固体。
②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。
③氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。
④氢氧化钠极易溶于水,溶解时会放出大量的热。
⑤常见用途:造纸、纺织、印染、炼油、人造丝、橡胶工业
1. 氢氧化钠(NaOH)
⑥氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。
⑦如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
2. 氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
(1)氢氧化钙也有腐蚀性,使用时应注意安全。俗称熟石灰、消石灰。
(2)常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)等。
生石灰与水反应能转化成熟石灰,这一反应过程是放热过程。
生石灰具有强烈的吸水性,常用它作干燥剂
生石灰
熟石灰
实验内容 实验现象 烧碱、消石灰、 氨水物理性质的比较 烧碱 消石灰 氨水
颜色
状态
气味
溶解性
俗名
烧碱、氨水露置在空气中发生的变化 烧碱的溶解情况 白色
白色
无色
片状固体
粉末状固体
液体
无味
无味
有氨臭味
易溶
微溶
易溶
烧碱、火碱、苛性钠
熟石灰、消石灰
烧碱露置在空气中,表面出现潮湿,这个现象称为潮
解。氨水露置在空气中,会使其溶质质量分数变小。
易溶于水放出大量的热,水溶液具有滑腻感。
1.碱溶液使紫色石蕊试液变 色,
无色酚酞试液变 色; 碱溶液pH 。
2.碱(OH-)的化学性质
写出CO2分别与Ca(OH)2 、 NaOH反应的化学方程式
CO2+Ca(OH)2==
CO2+ NaOH ==
2.非金属氧化物+碱→
蓝
红
>7
CaCO3 ↓+H2O
2 Na2CO3+ H2O
盐+水
[活动与探究2]
“不吹自大”的气球。
2NaOH + CO2 = Na2CO3 + H2O
学以致用
1.工业上常用氢氧化钙或氢氧化钠吸收二氧化硫,分别生成亚硫酸钙CaSO3或亚硫酸钠Na2SO3和水,你能写出相关化学方程式吗?
Ca(OH)2 +SO2 =
NaOH + SO2 =
CaSO3↓+H2O
Na2SO3+H2O
2
a 固体NaOH在空气中易吸收水蒸气而潮解(物理变化)
b 还能吸收二氧化碳气体生成碳酸钠而变质(化学变化)
2.你能说出固体氢氧化钠必须密封保存的原因吗?
[活动与探究3]
在硫酸铜溶液中分别滴加石灰水和氢氧化钠溶液
现象:有蓝色沉淀生成
CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
四、碱的通性:
1.碱溶液能使紫色石蕊变蓝、无色酚酞变红
2.碱 + 非金属氧化物 → 盐 + 水
2NaOH + CO2== Na2CO3 + H2O
Ca(OH)2+CO2== CaCO3↓+ H2O
3.碱+酸→盐+水
NaOH+HCl==NaCl + H2O
Ca(OH)2+2HCl==CaCl2+2H2O
4.碱 + 盐→ 新碱+新盐
Ca(OH)2+CuSO4 ==Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
碱的通性原因:
都能电离出OH—
(1)与酸碱指示剂作用
A.紫色石蕊试剂或红色石蕊试纸遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
归纳总结:
碱(OH-)的共同化学性质
1.碱溶液具有相似的化学性质,这是因为碱溶液中都含有 ( )
A.水分子 B.氢离子
C.氢氧根离子 D.金属离子
2.火碱的化学式是 ( )
A.NaCl B.NaOH
C.Mg(OH)2 D.Na2SO4
3.下列物质不能作为干燥剂的 ( )
A.氢氧化钠 B.浓硫酸
C.生石灰 D.氢氧化钠溶液
巩固练习:
C
B
D
4.下列气体中,不能用NaOH干燥的是 ( )
A.O2 B.N2 C.H2 D.CO2
5.下列溶液暴露在空气中,因发生化学变化而使溶液质量增大的是 ( )
A.浓氢氧化钠溶液 B. 浓盐酸
C.浓硫酸 D. 饱和食盐水
D
A
挥发性
物理性质
吸水性
物理性质
吸收二氧化碳,
化学变化
不变
6、(07南昌)下列属于复分解反应的是 ( )
A.Fe + CuSO4 === FeSO4 + Cu
B.CaCO3 === CaO + CO2↑
C.H2SO4 + 2NaOH === Na2SO4 + 2H2O
D.CH4 + 2O2 === CO2 + 2H2O
高温
点燃
C
作业:
1. 归纳碱的4条通性,且每一条写出2个方程式(指示剂变色除外);
2. 完成《探究与训练》第七章第2节第2课时;
3.预习课本第七章第2节剩余内容。
第2节 常见的酸和碱
7.2.2 常见的碱
A
+
C
=
B
A
B
D
C
D
+
由两种化合物互相交换成分生成另外两种化合物
反应叫做复分解反应。
书写原则:
等价交换
Fe2 O3 + 6HCl= 2FeCl3 + 3H2O
+3 -2 +1 -1
+3 -1 +1 -2
温故知新:盐酸除铁锈
再如:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
氢氧化钠 NaOH
氢氧化钙Ca(OH)2
氨水NH3·H2O
常见的碱
氢氧化钠(NaOH) 氢氧化钙(Ca(OH)2) 氢氧化钾(KOH)
氢氧化钠 NaOH ——Na++ OH-
氢氧化钙 Ca(OH)2 ——Ca2++ OH-
氢氧化钾 KOH ——K+ + OH-
碱——都含有氢氧根
碱——溶于水后生成的阴离子全部是OH-的化合物
剩余部分为金属离子
你了解它们的性质吗?它们在生产、生活中有哪些应用?
1.观察固体烧碱、消石灰和氨水的颜色、状态,正确地闻氨水的气味。在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。
2.在试管中加一些固体氢氧化钠,加入水,振荡,观察它的溶解过程,并摸一摸试管,感觉溶液温度的变化。
[活动与探究1]
常见的碱
1. 氢氧化钠(NaOH)
实验 现象 分析
观察
放表面皿上
放入水中
白色块状固体
表面潮湿
试管外壁温度较高
氢氧化钠吸收空气中的水分
溶解时放热
①氢氧化钠是白色的固体。
②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。
③氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。
④氢氧化钠极易溶于水,溶解时会放出大量的热。
⑤常见用途:造纸、纺织、印染、炼油、人造丝、橡胶工业
1. 氢氧化钠(NaOH)
⑥氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。
⑦如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
2. 氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
(1)氢氧化钙也有腐蚀性,使用时应注意安全。俗称熟石灰、消石灰。
(2)常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)等。
生石灰与水反应能转化成熟石灰,这一反应过程是放热过程。
生石灰具有强烈的吸水性,常用它作干燥剂
生石灰
熟石灰
实验内容 实验现象 烧碱、消石灰、 氨水物理性质的比较 烧碱 消石灰 氨水
颜色
状态
气味
溶解性
俗名
烧碱、氨水露置在空气中发生的变化 烧碱的溶解情况 白色
白色
无色
片状固体
粉末状固体
液体
无味
无味
有氨臭味
易溶
微溶
易溶
烧碱、火碱、苛性钠
熟石灰、消石灰
烧碱露置在空气中,表面出现潮湿,这个现象称为潮
解。氨水露置在空气中,会使其溶质质量分数变小。
易溶于水放出大量的热,水溶液具有滑腻感。
1.碱溶液使紫色石蕊试液变 色,
无色酚酞试液变 色; 碱溶液pH 。
2.碱(OH-)的化学性质
写出CO2分别与Ca(OH)2 、 NaOH反应的化学方程式
CO2+Ca(OH)2==
CO2+ NaOH ==
2.非金属氧化物+碱→
蓝
红
>7
CaCO3 ↓+H2O
2 Na2CO3+ H2O
盐+水
[活动与探究2]
“不吹自大”的气球。
2NaOH + CO2 = Na2CO3 + H2O
学以致用
1.工业上常用氢氧化钙或氢氧化钠吸收二氧化硫,分别生成亚硫酸钙CaSO3或亚硫酸钠Na2SO3和水,你能写出相关化学方程式吗?
Ca(OH)2 +SO2 =
NaOH + SO2 =
CaSO3↓+H2O
Na2SO3+H2O
2
a 固体NaOH在空气中易吸收水蒸气而潮解(物理变化)
b 还能吸收二氧化碳气体生成碳酸钠而变质(化学变化)
2.你能说出固体氢氧化钠必须密封保存的原因吗?
[活动与探究3]
在硫酸铜溶液中分别滴加石灰水和氢氧化钠溶液
现象:有蓝色沉淀生成
CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
四、碱的通性:
1.碱溶液能使紫色石蕊变蓝、无色酚酞变红
2.碱 + 非金属氧化物 → 盐 + 水
2NaOH + CO2== Na2CO3 + H2O
Ca(OH)2+CO2== CaCO3↓+ H2O
3.碱+酸→盐+水
NaOH+HCl==NaCl + H2O
Ca(OH)2+2HCl==CaCl2+2H2O
4.碱 + 盐→ 新碱+新盐
Ca(OH)2+CuSO4 ==Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
碱的通性原因:
都能电离出OH—
(1)与酸碱指示剂作用
A.紫色石蕊试剂或红色石蕊试纸遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
归纳总结:
碱(OH-)的共同化学性质
1.碱溶液具有相似的化学性质,这是因为碱溶液中都含有 ( )
A.水分子 B.氢离子
C.氢氧根离子 D.金属离子
2.火碱的化学式是 ( )
A.NaCl B.NaOH
C.Mg(OH)2 D.Na2SO4
3.下列物质不能作为干燥剂的 ( )
A.氢氧化钠 B.浓硫酸
C.生石灰 D.氢氧化钠溶液
巩固练习:
C
B
D
4.下列气体中,不能用NaOH干燥的是 ( )
A.O2 B.N2 C.H2 D.CO2
5.下列溶液暴露在空气中,因发生化学变化而使溶液质量增大的是 ( )
A.浓氢氧化钠溶液 B. 浓盐酸
C.浓硫酸 D. 饱和食盐水
D
A
挥发性
物理性质
吸水性
物理性质
吸收二氧化碳,
化学变化
不变
6、(07南昌)下列属于复分解反应的是 ( )
A.Fe + CuSO4 === FeSO4 + Cu
B.CaCO3 === CaO + CO2↑
C.H2SO4 + 2NaOH === Na2SO4 + 2H2O
D.CH4 + 2O2 === CO2 + 2H2O
高温
点燃
C
作业:
1. 归纳碱的4条通性,且每一条写出2个方程式(指示剂变色除外);
2. 完成《探究与训练》第七章第2节第2课时;
3.预习课本第七章第2节剩余内容。
