复分解反应的条件及应用 课件(28张PPT)
文档属性
| 名称 | 复分解反应的条件及应用 课件(28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 297.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-07 21:54:16 | ||
图片预览





文档简介
(共28张PPT)
专题复习
复分解反应的条件及应用
1.理解复分解反应的概念和反应的条件;
2.能利用复分解反应的条件判断复分解反应是否发生以及实际的应用;
3.能够正确书写复分解反应的化学方程式;
4.能从微观的角度,即“离子对”之间的互换反应角度认识复分解反应的本质。
复习目标:
一、复分解反应的概念和反应条件
三、
复分解反应条件(“离子对”)在不同题型中的应用
复习内容:
二、能用微观角度去理解复分解反应发生条件的实质
一、复分解反应的概念、条件及实质
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
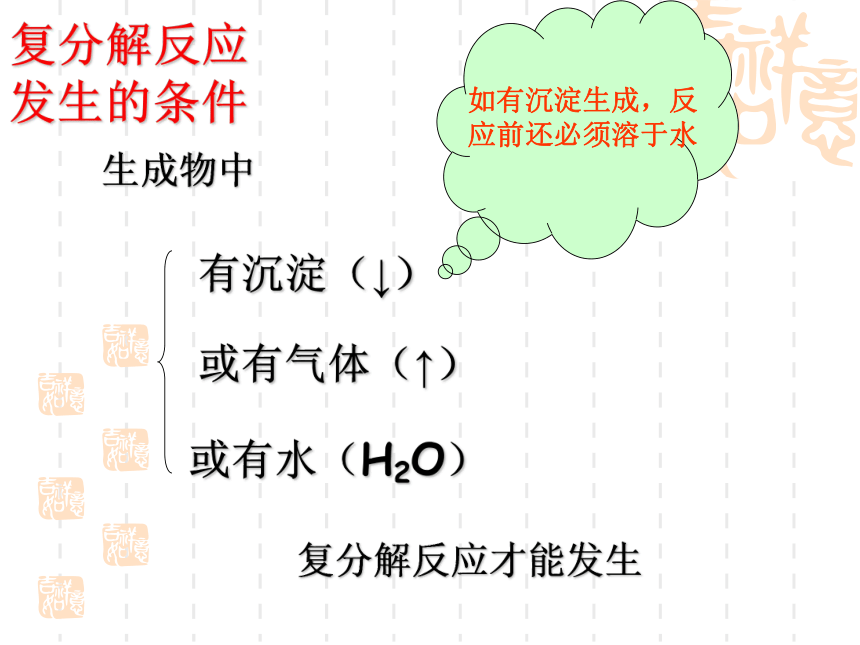
复分解反应发生的条件
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
生成物中
如有沉淀生成,反应前还必须溶于水
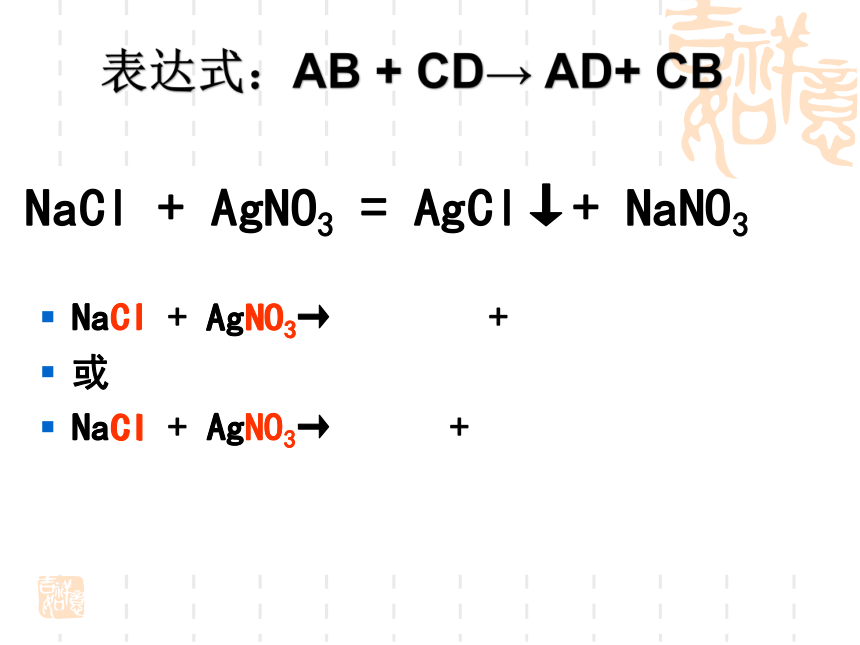
NaCl
+
AgNO3→
+
或
NaCl
+
AgNO3→
+
Na
NO3
Ag
Cl
Na
Cl
Ag
NO3
NaCl
+
AgNO3
=
AgCl↓+
NaNO3
表达式:AB
+
CD→
AD+
CB
复分解反应的实质是什么呢?
Na+
OH-
H+
Cl-
H2O
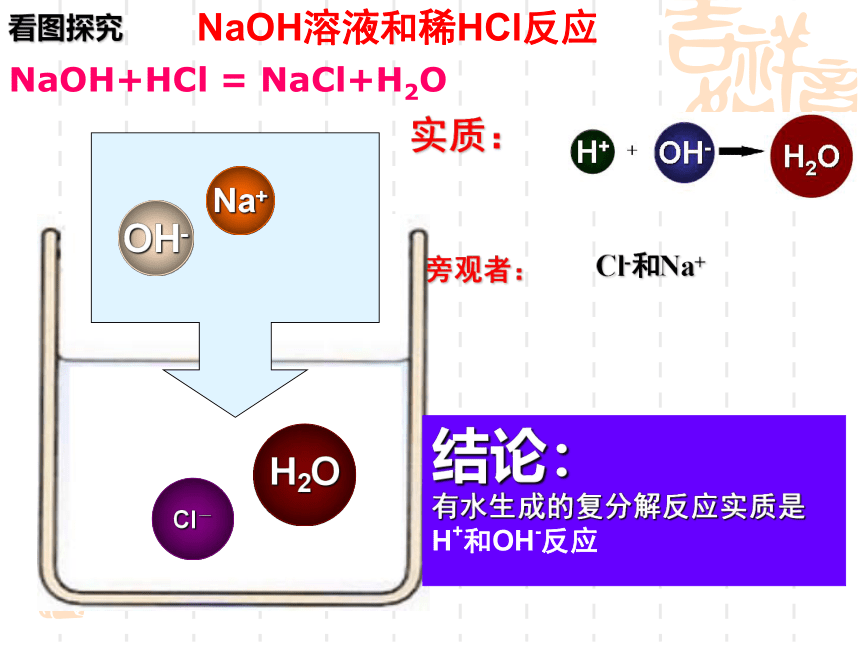
NaOH溶液和稀HCl反应
看图探究
结论:
有水生成的复分解反应实质是
H+和OH-反应
实质:
旁观者:
Cl-和Na+
NaOH+HCl
=
NaCl+H2O
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
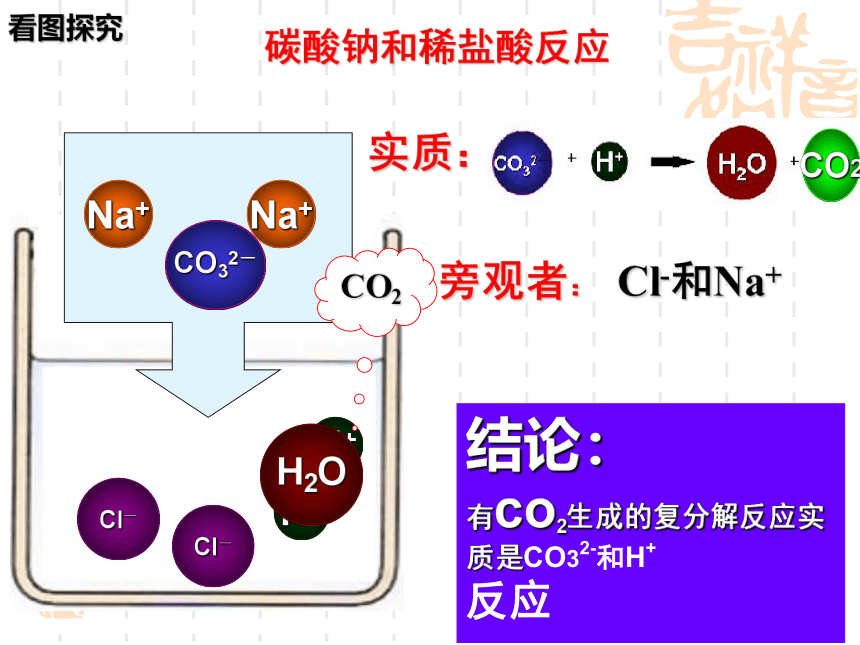
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水。即“离子对”之间的反应
(“离子对”是指:能相互结合生成“水”、“气体(↑)”或“沉淀(↓)”的阴、阳离子,叫“离子对”)
复分解反应的实质:
在中考题中,大部分的知识点要靠酸、碱、盐知识的有机结合才能解决。初中阶段酸碱盐部分涉及到的阳离子主要有:H+、NH4+、Ca2+、Cu2+、Fe3+、Ag+等,主要的阴离子有:OH-、SO42-、CO32-、Cl-等。学习和做题中我们可以有意识的从离子角度分析问题,抓住问题的实质(构建离子对),从而提高解题的效率。
酸
:
H+
+
OH-
=
H2O
2H+
+
CO32-
=
CO2
+H2O
碱:2OH-
+
Cu2+
=Cu(OH)2
3OH-
+
Fe3+
=Fe(OH)3
2OH-
+
Mg2+
=Mg(OH)2
OH-
+
NH4+
=
NH3
+H2O
盐:Ag++Cl-=
AgCl
Ba2+
+SO42-=BaSO4
Ba2+
+
CO32-
=
BaCO3
Ca2+
+
CO32-
=
CaCO3
初中常见的离子反应(即“离子对”)
蓝色沉淀
红褐色沉淀
白色沉淀
二、复分解反应在不同题型中的应用:
含义:两种离子相互作用没有水、气体或沉淀等物质生成,则这两种离子能共存于同一溶液中(否则不能大量共存)。
1.离子共存题
1.离子共存题
原则:
“大量共存”——则溶液中相应的离子之间不能反应,则找不到相应的“离子对”生成H2O、气体或沉淀。
不共存离子对
H+与OH-、CO32-、HCO3-
OH-?与NH4+、Mg2+、Cu2+、
Fe3+
Cl-与Ag+?
CO32-
与Ca2+、Ba2+
SO42-?与Ba2+?
溶液中常见的有色离子如下:
Cu2+(蓝色)、Fe2+(淡绿色)、
Fe3+(黄色)、MnO4-(紫色)
离子共存的判断
例1:下列各组离子中,能够大量共存于同一溶液的是(
)
A、CO32-、H+、Na+、NO3-
B、H+、Ag+、Cl-、SO42-
C、K+、NH4+、
Cl-、OH-
D、
OH-
、NO3-
、
K+、
Na+
D
例2:在PH=1的无色溶液中,能够大量共存的一组是(
)
A、
Cl-、
CO32-
、
Na+、
OH-
B、
NO3-
、
Cu2+、
Cl-、Fe3+
、
C、NO3-、SO42-、
K+、Zn2+
D、
SO42-
、
NH4+、
Ba2+、
Cl-
C
解题要点1:相互反应的离子不能共存
解题要点2:不反应;且为无色。
例题讲解
2.鉴别题中的应用
2.鉴别题
例题3.
现有Na2SO4
、Na2CO3
、AgNO3三种无色溶液,请用一种试剂一次鉴别出来,则该试剂应选(
)
A.
BaCl2溶液
B.稀硝酸
C.NaOH溶液
D.稀盐酸
(解析:解答鉴别题时,利用“离子对”之间的关系,分别得出不同的实验现象)
D
HCl
变式题(练习题)
现有Na2SO4
、Na2CO3
两种无色溶液,请用一种试剂一次鉴别出来,你有几种方法:
分析:依据“被鉴别物质的性质特征,可以采用物理方法和化学方法。化学方法主要原理是加入某种物质,可以产生特殊的现象。目前常用的是形成沉淀或气体。有时也用到颜色变化”的基本思想,通过所提供物质性质和组成的比较,阳离子Na+相同不用考虑,重点考虑阴离子的CO32-
和SO42-
,根据离子对来鉴别物质。
3.除杂题中的应用
3.除杂题
转化法-加入试剂,使杂质变成被提取物质。
例题
4:除去NaOH变质后含有的杂质Na2CO3,加适量
溶液,再过滤,
发生反应的化学方程式:
。
(原理:
除去杂质的原则,一般将杂质部分转化为沉淀或气体除去,同时不能引进新杂质)
Ca(OH)2
Na2CO3+?Ca(OH)2?=?CaCO3↓
+?2NaOH
分析:根据离子对,依据“换啥给啥,卸啥对啥”原则,通过有用物质和杂质的比较,阳离子Na+相同不用考虑,阴离子需把CO32-换成OH-
先给OH-
,而要卸掉CO32-需要对应Ca2+或
Ba2+
,即需要Ca(OH)2或Ba(OH)2
总结:除杂质首先不能生成新的杂质,其次要便于分离,最好还能转化产生更多有用的物质。若遇到除杂质问题是选择题,可依据选项逐个排除,难度不太大,但若是填空或探究题,我们就可以利用离子对去解决涉及酸碱盐的一部分除杂问题。
达
标
训
练
1.根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是(
)
A.Na2CO3溶液和CaCl2溶液
B.NaOH溶液和盐酸溶液
C.CuSO4溶液和BaCl2溶液
D.K2SO4溶液和NaCl溶液
2.下列各组物质分别加入水中,既有沉淀,又有气体产生的是(
)
A.HNO3
Na2SO4
BaCl2
B.H2SO4
Na2CO3
BaCl2
C.KNO3
Na2CO3
HCl
D.HCl
AgNO3
NaCl
D
B
达
标
训
练
3.现有稀
H2SO4
、KOH
、CaCl2三种无色溶液,请用一种试剂一次鉴别出来,则该试剂应选(
)
A.KCl溶液
B.K2CO3溶液
C.稀盐酸
D.NaNO3溶液
4.下列各组物质,能在PH=1的溶液中大量共存,且形成无色溶液的是(
)
A.NaCl
BaCl2
Na2SO4
B.Na2CO3
NaCl
Na2SO4
C.CuSO4
NaCl
NaNO3
D.Na2SO4
HCl
KCl
D
B
达
标
训
练
实验
现象
(1)加水观察其溶解情况?
易溶解,得无色溶液?
(2)滴加无色酚酞试液?
溶液无变化?
5.取适量某白色固体依次进行如下表所示实验,已知该固体可能是碳酸钙、碳酸钠、氯化钠、硫酸铜中的一种,则依实验结果判断白色固体是(
)
A.CuSO4???
B.
NaCl????
C.Na2CO3???
D.
CaCO3
B
6.有关除去杂质的试题:
(1)气化法-将杂质转化成气体除去(括号内为杂质)。
如:NaCl(Na2CO3),除杂方法,加适量
,相关的化学方程式:
。
(2)沉淀法-加入试剂,使溶液中的杂质变成沉淀。
如:NaCl(Na2SO4),除杂方法,加适量
溶液,再过滤,相关的化学方程式:
。
达
标
训
练
Na2CO3+?2HCl
?=?2NaCl
+?H2O
+?CO2
↑
HCl
Na2SO4+?BaCl2?=?BaSO4↓
+?2NaCl
BaCl2
本节小结:
复分解反应的条件及应用
宏观角度
微观角度
有气体生成
2H+
+
CO32-
=
CO2
+H2O
OH-
+
NH4+
=
NH3
+H2O
有水生成
H+
+
OH-
=
H2O
有沉淀生成
2OH-
+
Cu2+
=Cu(OH)2
3OH-
+
Fe3+
=Fe(OH)3
2OH-
+
Mg2+
=Mg(OH)2
Ag++Cl-=
AgCl
Ba2+
+SO42-=BaSO4
Ba2+
+
CO32-
=
BaCO3
Ca2+
+
CO32-
=
CaCO3
作业
1.再次梳理导学案和达标训练的解题思维
2.做导学案中作业7
谢谢大家
专题复习
复分解反应的条件及应用
1.理解复分解反应的概念和反应的条件;
2.能利用复分解反应的条件判断复分解反应是否发生以及实际的应用;
3.能够正确书写复分解反应的化学方程式;
4.能从微观的角度,即“离子对”之间的互换反应角度认识复分解反应的本质。
复习目标:
一、复分解反应的概念和反应条件
三、
复分解反应条件(“离子对”)在不同题型中的应用
复习内容:
二、能用微观角度去理解复分解反应发生条件的实质
一、复分解反应的概念、条件及实质
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应
。
复分解反应发生的条件
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
生成物中
如有沉淀生成,反应前还必须溶于水
NaCl
+
AgNO3→
+
或
NaCl
+
AgNO3→
+
Na
NO3
Ag
Cl
Na
Cl
Ag
NO3
NaCl
+
AgNO3
=
AgCl↓+
NaNO3
表达式:AB
+
CD→
AD+
CB
复分解反应的实质是什么呢?
Na+
OH-
H+
Cl-
H2O
NaOH溶液和稀HCl反应
看图探究
结论:
有水生成的复分解反应实质是
H+和OH-反应
实质:
旁观者:
Cl-和Na+
NaOH+HCl
=
NaCl+H2O
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
结论:
有co2生成的复分解反应实质是CO32-和H+
反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水。即“离子对”之间的反应
(“离子对”是指:能相互结合生成“水”、“气体(↑)”或“沉淀(↓)”的阴、阳离子,叫“离子对”)
复分解反应的实质:
在中考题中,大部分的知识点要靠酸、碱、盐知识的有机结合才能解决。初中阶段酸碱盐部分涉及到的阳离子主要有:H+、NH4+、Ca2+、Cu2+、Fe3+、Ag+等,主要的阴离子有:OH-、SO42-、CO32-、Cl-等。学习和做题中我们可以有意识的从离子角度分析问题,抓住问题的实质(构建离子对),从而提高解题的效率。
酸
:
H+
+
OH-
=
H2O
2H+
+
CO32-
=
CO2
+H2O
碱:2OH-
+
Cu2+
=Cu(OH)2
3OH-
+
Fe3+
=Fe(OH)3
2OH-
+
Mg2+
=Mg(OH)2
OH-
+
NH4+
=
NH3
+H2O
盐:Ag++Cl-=
AgCl
Ba2+
+SO42-=BaSO4
Ba2+
+
CO32-
=
BaCO3
Ca2+
+
CO32-
=
CaCO3
初中常见的离子反应(即“离子对”)
蓝色沉淀
红褐色沉淀
白色沉淀
二、复分解反应在不同题型中的应用:
含义:两种离子相互作用没有水、气体或沉淀等物质生成,则这两种离子能共存于同一溶液中(否则不能大量共存)。
1.离子共存题
1.离子共存题
原则:
“大量共存”——则溶液中相应的离子之间不能反应,则找不到相应的“离子对”生成H2O、气体或沉淀。
不共存离子对
H+与OH-、CO32-、HCO3-
OH-?与NH4+、Mg2+、Cu2+、
Fe3+
Cl-与Ag+?
CO32-
与Ca2+、Ba2+
SO42-?与Ba2+?
溶液中常见的有色离子如下:
Cu2+(蓝色)、Fe2+(淡绿色)、
Fe3+(黄色)、MnO4-(紫色)
离子共存的判断
例1:下列各组离子中,能够大量共存于同一溶液的是(
)
A、CO32-、H+、Na+、NO3-
B、H+、Ag+、Cl-、SO42-
C、K+、NH4+、
Cl-、OH-
D、
OH-
、NO3-
、
K+、
Na+
D
例2:在PH=1的无色溶液中,能够大量共存的一组是(
)
A、
Cl-、
CO32-
、
Na+、
OH-
B、
NO3-
、
Cu2+、
Cl-、Fe3+
、
C、NO3-、SO42-、
K+、Zn2+
D、
SO42-
、
NH4+、
Ba2+、
Cl-
C
解题要点1:相互反应的离子不能共存
解题要点2:不反应;且为无色。
例题讲解
2.鉴别题中的应用
2.鉴别题
例题3.
现有Na2SO4
、Na2CO3
、AgNO3三种无色溶液,请用一种试剂一次鉴别出来,则该试剂应选(
)
A.
BaCl2溶液
B.稀硝酸
C.NaOH溶液
D.稀盐酸
(解析:解答鉴别题时,利用“离子对”之间的关系,分别得出不同的实验现象)
D
HCl
变式题(练习题)
现有Na2SO4
、Na2CO3
两种无色溶液,请用一种试剂一次鉴别出来,你有几种方法:
分析:依据“被鉴别物质的性质特征,可以采用物理方法和化学方法。化学方法主要原理是加入某种物质,可以产生特殊的现象。目前常用的是形成沉淀或气体。有时也用到颜色变化”的基本思想,通过所提供物质性质和组成的比较,阳离子Na+相同不用考虑,重点考虑阴离子的CO32-
和SO42-
,根据离子对来鉴别物质。
3.除杂题中的应用
3.除杂题
转化法-加入试剂,使杂质变成被提取物质。
例题
4:除去NaOH变质后含有的杂质Na2CO3,加适量
溶液,再过滤,
发生反应的化学方程式:
。
(原理:
除去杂质的原则,一般将杂质部分转化为沉淀或气体除去,同时不能引进新杂质)
Ca(OH)2
Na2CO3+?Ca(OH)2?=?CaCO3↓
+?2NaOH
分析:根据离子对,依据“换啥给啥,卸啥对啥”原则,通过有用物质和杂质的比较,阳离子Na+相同不用考虑,阴离子需把CO32-换成OH-
先给OH-
,而要卸掉CO32-需要对应Ca2+或
Ba2+
,即需要Ca(OH)2或Ba(OH)2
总结:除杂质首先不能生成新的杂质,其次要便于分离,最好还能转化产生更多有用的物质。若遇到除杂质问题是选择题,可依据选项逐个排除,难度不太大,但若是填空或探究题,我们就可以利用离子对去解决涉及酸碱盐的一部分除杂问题。
达
标
训
练
1.根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是(
)
A.Na2CO3溶液和CaCl2溶液
B.NaOH溶液和盐酸溶液
C.CuSO4溶液和BaCl2溶液
D.K2SO4溶液和NaCl溶液
2.下列各组物质分别加入水中,既有沉淀,又有气体产生的是(
)
A.HNO3
Na2SO4
BaCl2
B.H2SO4
Na2CO3
BaCl2
C.KNO3
Na2CO3
HCl
D.HCl
AgNO3
NaCl
D
B
达
标
训
练
3.现有稀
H2SO4
、KOH
、CaCl2三种无色溶液,请用一种试剂一次鉴别出来,则该试剂应选(
)
A.KCl溶液
B.K2CO3溶液
C.稀盐酸
D.NaNO3溶液
4.下列各组物质,能在PH=1的溶液中大量共存,且形成无色溶液的是(
)
A.NaCl
BaCl2
Na2SO4
B.Na2CO3
NaCl
Na2SO4
C.CuSO4
NaCl
NaNO3
D.Na2SO4
HCl
KCl
D
B
达
标
训
练
实验
现象
(1)加水观察其溶解情况?
易溶解,得无色溶液?
(2)滴加无色酚酞试液?
溶液无变化?
5.取适量某白色固体依次进行如下表所示实验,已知该固体可能是碳酸钙、碳酸钠、氯化钠、硫酸铜中的一种,则依实验结果判断白色固体是(
)
A.CuSO4???
B.
NaCl????
C.Na2CO3???
D.
CaCO3
B
6.有关除去杂质的试题:
(1)气化法-将杂质转化成气体除去(括号内为杂质)。
如:NaCl(Na2CO3),除杂方法,加适量
,相关的化学方程式:
。
(2)沉淀法-加入试剂,使溶液中的杂质变成沉淀。
如:NaCl(Na2SO4),除杂方法,加适量
溶液,再过滤,相关的化学方程式:
。
达
标
训
练
Na2CO3+?2HCl
?=?2NaCl
+?H2O
+?CO2
↑
HCl
Na2SO4+?BaCl2?=?BaSO4↓
+?2NaCl
BaCl2
本节小结:
复分解反应的条件及应用
宏观角度
微观角度
有气体生成
2H+
+
CO32-
=
CO2
+H2O
OH-
+
NH4+
=
NH3
+H2O
有水生成
H+
+
OH-
=
H2O
有沉淀生成
2OH-
+
Cu2+
=Cu(OH)2
3OH-
+
Fe3+
=Fe(OH)3
2OH-
+
Mg2+
=Mg(OH)2
Ag++Cl-=
AgCl
Ba2+
+SO42-=BaSO4
Ba2+
+
CO32-
=
BaCO3
Ca2+
+
CO32-
=
CaCO3
作业
1.再次梳理导学案和达标训练的解题思维
2.做导学案中作业7
谢谢大家
