第3节 几种重要的盐-复分解反应及其应用(共15张PPT)
文档属性
| 名称 | 第3节 几种重要的盐-复分解反应及其应用(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 508.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 00:00:00 | ||
图片预览




文档简介
(共15张PPT)
复分解反应
1.理解并掌握复分解反应的概念和反应的条件
2.理解复分解反应的实质、会判断复分解反应是否能发生
3.能够正确的书写复分解反应的化学方程式
学习目标
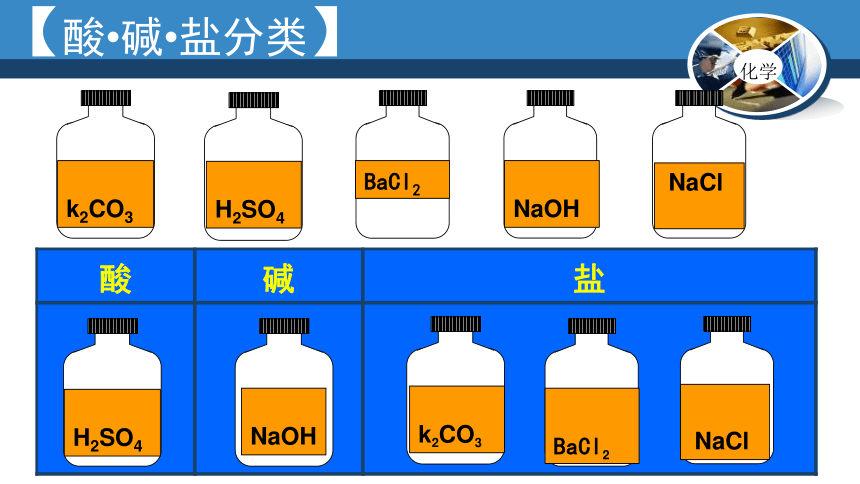
BaCl2
H2SO4
k2CO3
NaOH
酸
碱
盐
BaCl2
H2SO4
NaOH
k2CO3
【酸?碱?盐分类】
NaCl
NaCl
(1)CaCO3
+2HCl==CaCl2
+
H2CO3
(2)Na2CO3
+
2HCl==2NaCl
+
H2CO3
(3)NaHCO3
+
HCl==NaCl
+
H2CO3
(4)Na2CO3
+
Ca(OH)2==
2NaOH
+
CaCO3↓
H2O+CO2↑
H2O+CO2↑
H2O+CO2↑
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
复分解反应:由两种化合物互相交换成分生成另外两种化合物的反应。
A
+
C
=
B
A
B
D
C
D
+
【复分解反应】
复分解反应特点:
双交换、价不变。
酸、碱、盐
思考:什么条件下复分解反应才能发生呢???
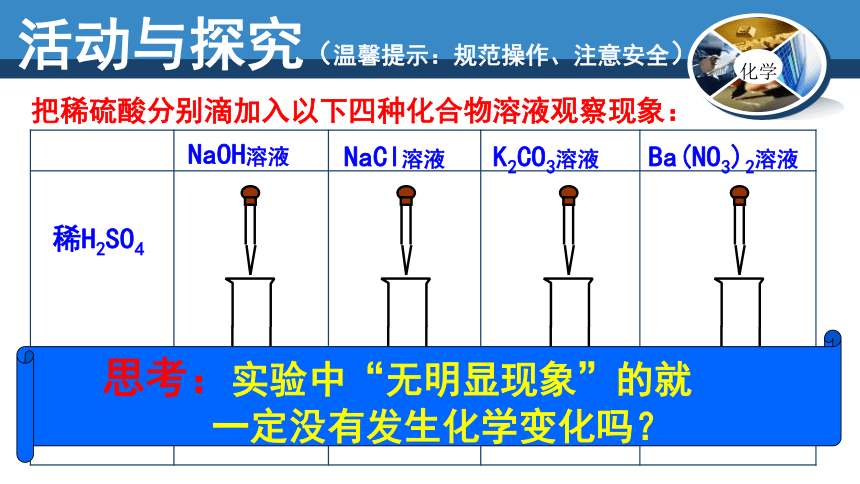
N
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀H2SO4
实验现象
无现象
无现象
放出气体
生成白色沉淀
活动与探究(温馨提示:规范操作、注意安全)
把稀硫酸分别滴加入以下四种化合物溶液观察现象:
思考:实验中“无明显现象”的就
一定没有发生化学变化吗?
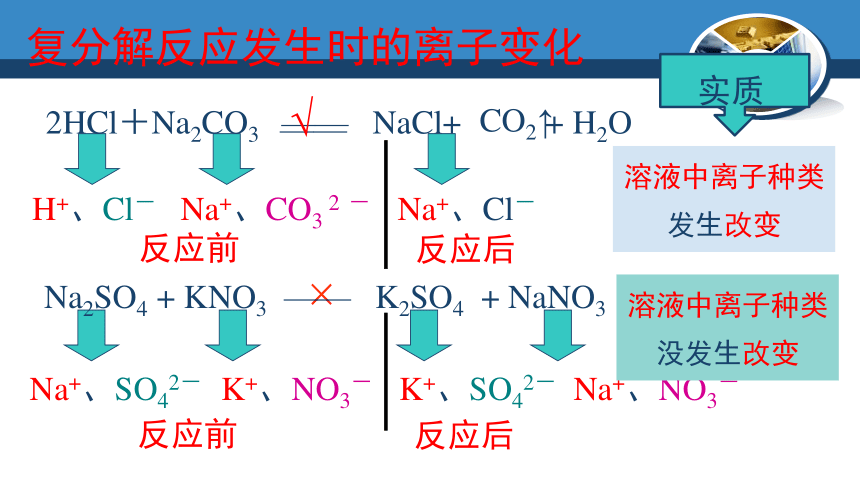
H+、Cl-
Na+、CO3
2
-
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3
——
NaCl+
+
H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4
+
NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4
+
KNO3
——
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
Ba2+
SO42-
NO3-
NO3-
H+
H+
BaSO4
硝酸钡与硫酸反应
实质:
结论:两种化合物相互交换成分,有_____生成时,复分解反应能够发生
。
沉淀
H2SO4
Ba(NO3)2
复分解反应的条件:生成沉淀
K+
K+
CO32-
SO42-
H+
H+
H2O
碳酸钾与硫酸反应
结论:两种化合物相互交换成分,有______生成时,复分解反应能够发生。
CO2
实质:
气体
k2CO3
H2SO4
CO32-
复分解反应的条件:生成气体
Na+
OH-
H+
SO42-
H2O
氢氧化钠与硫酸反应
结论:两种化合物相互交换成分,有______生成时,复分解反应能够发生。
实质:
水
NaOH
H2SO4
复分解反应的条件:生成水
复分解反应条件:
复分解反应特点:
A
+
C
=
B
A
B
D
C
D
+
思考:根据复分解反应的条件,你能判断
上面实验中哪些能发生复分解反应吗?
【课堂小结】
两种化合物互相交换成分,生成
物中有沉淀、气体或水生成。
双交换、价不变。
N
KOH溶液
NaCl溶液
K2CO3溶液
BaCl2溶液
稀H2SO4
判断依据
生成水
未发生复分解反应
放出气体
生成沉淀
判断稀硫酸与以下四种溶液之间能否发生复分解反应?
完成化学方程式
【小试牛刀】
【点击中考】
1.
下列物质能够在溶液中共存的是
(
)
A.
NaOH
和CuSO4
B.
H2SO4和
Na2CO3
C.
MgSO4和Ba(OH)2
D.
NaCl
和
KNO3
2.
下列离子能在水溶液中大量共存的是
(
)
A.
CO32-、
Cl-、
Na+
、
H+
B.
K+、
SO42-、
Cu2+、
OH-
C.
Cl-、
K+、
SO42-、
Na+
D.
Ca2+、
Cl-、
CO32-、
Na+
实例:利用X射线对钡盐的穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4做内服造影剂,这种透视俗称钡餐透视。由于Ba2+有剧毒,所以水溶性钡盐不能用做钡餐。BaCO3与BaSO4都是难溶性物质,是不是都可以用于钡餐透视?
答:BaCO3不可以用于钡餐透视,由于胃液酸性很强,如果服下BaCO3,胃酸可与BaCO3反应生成二氧化碳和水,从而使Ba2+浓度增大而引起人体中毒。
【生活?化学】
钡餐透视
?
?
?
实验室有两瓶失去标签的食盐溶液和纯碱溶液样品,你能有多种鉴别的鉴别方法吗?
【我学习!我快乐!】
复分解反应
1.理解并掌握复分解反应的概念和反应的条件
2.理解复分解反应的实质、会判断复分解反应是否能发生
3.能够正确的书写复分解反应的化学方程式
学习目标
BaCl2
H2SO4
k2CO3
NaOH
酸
碱
盐
BaCl2
H2SO4
NaOH
k2CO3
【酸?碱?盐分类】
NaCl
NaCl
(1)CaCO3
+2HCl==CaCl2
+
H2CO3
(2)Na2CO3
+
2HCl==2NaCl
+
H2CO3
(3)NaHCO3
+
HCl==NaCl
+
H2CO3
(4)Na2CO3
+
Ca(OH)2==
2NaOH
+
CaCO3↓
H2O+CO2↑
H2O+CO2↑
H2O+CO2↑
观察与思考
①观察:上述几个反应有什么特点?
②讨论:由此,你又有哪些新发现?
③归纳:复分解反应的概念、一般形式与特点。
复分解反应:由两种化合物互相交换成分生成另外两种化合物的反应。
A
+
C
=
B
A
B
D
C
D
+
【复分解反应】
复分解反应特点:
双交换、价不变。
酸、碱、盐
思考:什么条件下复分解反应才能发生呢???
N
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀H2SO4
实验现象
无现象
无现象
放出气体
生成白色沉淀
活动与探究(温馨提示:规范操作、注意安全)
把稀硫酸分别滴加入以下四种化合物溶液观察现象:
思考:实验中“无明显现象”的就
一定没有发生化学变化吗?
H+、Cl-
Na+、CO3
2
-
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3
——
NaCl+
+
H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4
+
NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4
+
KNO3
——
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
Ba2+
SO42-
NO3-
NO3-
H+
H+
BaSO4
硝酸钡与硫酸反应
实质:
结论:两种化合物相互交换成分,有_____生成时,复分解反应能够发生
。
沉淀
H2SO4
Ba(NO3)2
复分解反应的条件:生成沉淀
K+
K+
CO32-
SO42-
H+
H+
H2O
碳酸钾与硫酸反应
结论:两种化合物相互交换成分,有______生成时,复分解反应能够发生。
CO2
实质:
气体
k2CO3
H2SO4
CO32-
复分解反应的条件:生成气体
Na+
OH-
H+
SO42-
H2O
氢氧化钠与硫酸反应
结论:两种化合物相互交换成分,有______生成时,复分解反应能够发生。
实质:
水
NaOH
H2SO4
复分解反应的条件:生成水
复分解反应条件:
复分解反应特点:
A
+
C
=
B
A
B
D
C
D
+
思考:根据复分解反应的条件,你能判断
上面实验中哪些能发生复分解反应吗?
【课堂小结】
两种化合物互相交换成分,生成
物中有沉淀、气体或水生成。
双交换、价不变。
N
KOH溶液
NaCl溶液
K2CO3溶液
BaCl2溶液
稀H2SO4
判断依据
生成水
未发生复分解反应
放出气体
生成沉淀
判断稀硫酸与以下四种溶液之间能否发生复分解反应?
完成化学方程式
【小试牛刀】
【点击中考】
1.
下列物质能够在溶液中共存的是
(
)
A.
NaOH
和CuSO4
B.
H2SO4和
Na2CO3
C.
MgSO4和Ba(OH)2
D.
NaCl
和
KNO3
2.
下列离子能在水溶液中大量共存的是
(
)
A.
CO32-、
Cl-、
Na+
、
H+
B.
K+、
SO42-、
Cu2+、
OH-
C.
Cl-、
K+、
SO42-、
Na+
D.
Ca2+、
Cl-、
CO32-、
Na+
实例:利用X射线对钡盐的穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4做内服造影剂,这种透视俗称钡餐透视。由于Ba2+有剧毒,所以水溶性钡盐不能用做钡餐。BaCO3与BaSO4都是难溶性物质,是不是都可以用于钡餐透视?
答:BaCO3不可以用于钡餐透视,由于胃液酸性很强,如果服下BaCO3,胃酸可与BaCO3反应生成二氧化碳和水,从而使Ba2+浓度增大而引起人体中毒。
【生活?化学】
钡餐透视
?
?
?
实验室有两瓶失去标签的食盐溶液和纯碱溶液样品,你能有多种鉴别的鉴别方法吗?
【我学习!我快乐!】
