高中化学人教版选修2第一单元课题2 人工固氮技术──合成氨 课件(25张PPT)
文档属性
| 名称 | 高中化学人教版选修2第一单元课题2 人工固氮技术──合成氨 课件(25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-21 12:47:35 | ||
图片预览





文档简介
(共25张PPT)
课题2
人工固氮技术—合成氨
人教版
选修二——《化学与技术》
学习目标
1.
理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.了解合成氨生产的一般流程。
3.介绍合成氨,体验化工生产的过程,体验实验室研究与实际生产之间转化过程。
自学
影响化学反应速率和化学平衡的重要因素有哪些?
化学反应速率
化学平衡
浓度
气体
压强
温度
催化剂
温度越高,反应速率越大
压强越大,反应速率越大
正催化剂加快反应速率
反应物浓度越大,反应速率越大
升高温度,平衡向吸热反应方向移动
增大压强,平衡向气体体积减小的方向移动
催化剂对平衡无影响
增大反应物浓度,平衡正移动
课前复习
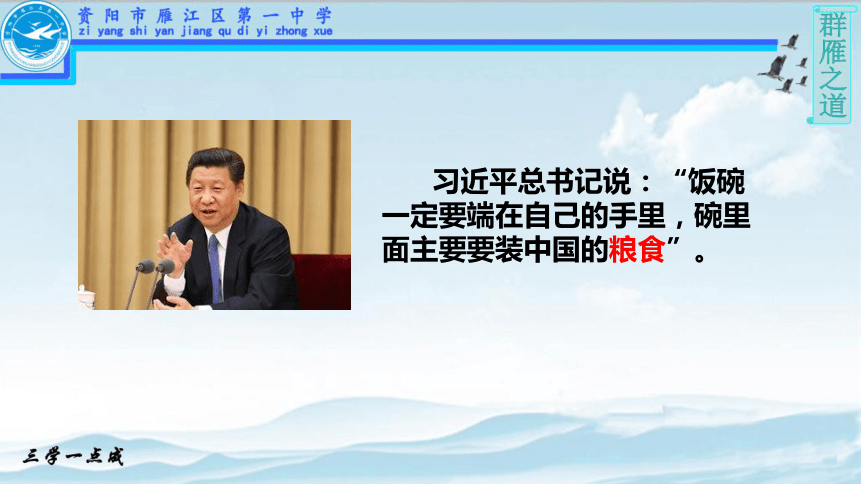
习近平总书记说:“饭碗一定要端在自己的手里,碗里面主要要装中国的粮食”。
问1:五谷的生长所需大量含氮化合物,含氮化合物的理想来源应该是什么物质?
问2:如何获得化合态氮元素?
地壳中氮的含量只有0.04%,而大气中氮气的体积分数为
78%。
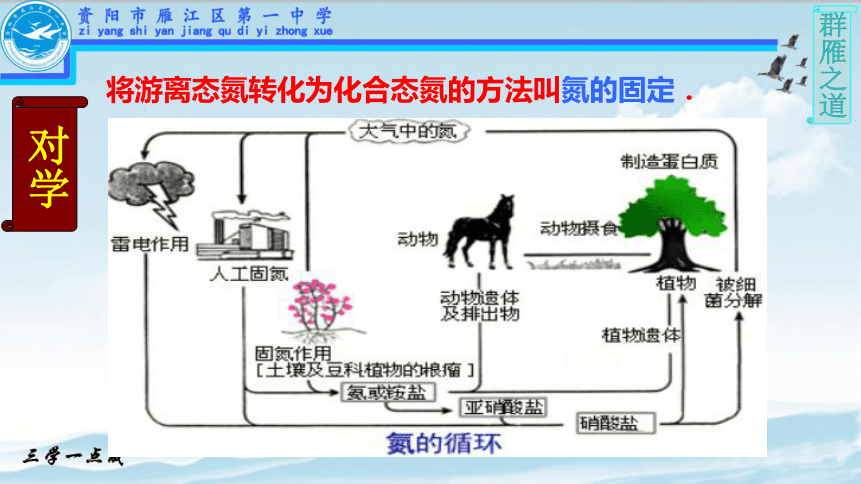
氮的固定
将游离态氮转化为化合态氮的方法叫氮的固定.
对学
德国化学家哈伯从1902年开始研究合成氨,
终于在1913年实现了合成氨的工业生产,满足了20世纪人口由30亿增至60亿对粮食的需求,因此人们赞扬哈伯是“用空气制造面包的圣人”。
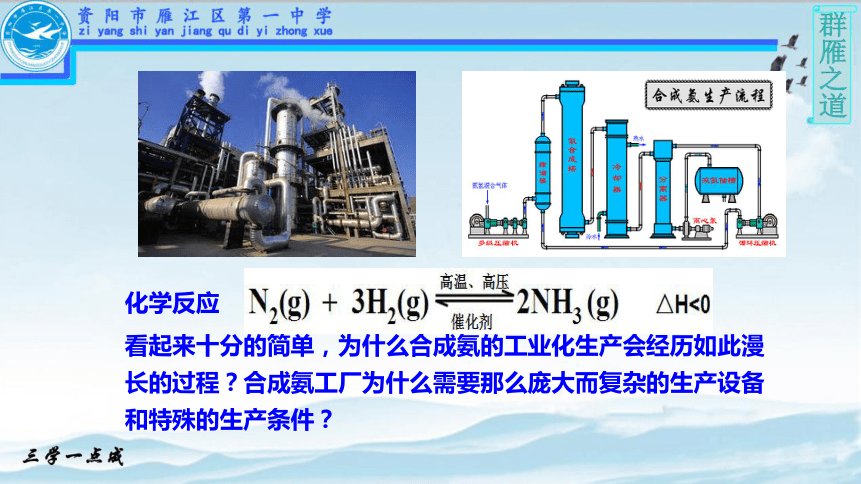
化学反应
看起来十分的简单,为什么合成氨的工业化生产会经历如此漫长的过程?合成氨工厂为什么需要那么庞大而复杂的生产设备和特殊的生产条件?
分析该反应的特点:
_____反应
正反应为_____反应
正反应为气体体积_____
反应特点
可逆
放热
减小
反应需要有
催化剂
假如你是一个合成氨化工厂的工程师,对工业生产你会考虑哪些问题?
要使氨生产得更快
(提高单位时间里氨的产量)
另外还要考虑生产中的消耗能源、原料来源、设备条件、环境保护等因素。
浓度
压强
温度
催化剂
提高合成氨的生产效益
要使氨生产得更多
(提高平衡混合物里氨的含量)
化学反应速率问题
化学平衡问题
1.根据合成氨反应的特点,应分别采取什么措施提高反应的平衡转化率和反应速率?
2.请尝试为合成氨选择适宜条件。
3.在确定合成氨的适宜条件的过程中遇到了哪些问题?是怎样解决的?
4.为了提高合成氨生产能力,还可以在哪些方面做进一步的改进?
群学
小组讨论
工业合成氨的合成条件的选择及理由
外部条件
取值范围或适宜条件
理由(化学反应速率、平衡原理、实际情况)
压强
温度
催化剂
浓度
20MPa_50MPa
500℃
使用铁触媒作催化剂
液化氨并及时分离
不断补充N2、H2(1:2.8)
反应速率大、平衡正移动、适合材料设备
反应速率大、平衡正移动
正催化剂加快反应速率,防止催化剂中毒
温度高反应速率大、平衡逆移动、催化剂活性最大
null
工业合成氨简易流程图
制取原料气
净化
压缩
合成
分离
液氨
N2和H2(循环)
冷凝
除去杂质气体、粉尘等,防止催化剂“中毒”
图1、合成氨工厂全貌
图2、合成氨生产装置
图3、合成氨生产控制室
图4、合成塔外貌
图5、贮存液氨的球罐
图6、合成氨的压缩机
图7、合成氨使用的催化剂
1
、能使合成氨反应进行程度增大的方法是(
)
A、升高温度
B
、降低压强
C、使用催化剂
D
、及时分离出氨气
课堂巩固
D
2、关于氨的合成工业的下列说法正确的是
(
)
(A)从合成塔出来的气体,其中氨一般占15%,所以生产氨的工业的效率都很低
(B)由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
(C)合成氨工业的反应温度控制在500
℃左右,目的是使平衡向正反应方向进行
(D)合成氨工业采用20
MPa
----
50MPa
,是因该条件下催化剂的活性最好
B
谢谢!
课题2
人工固氮技术—合成氨
人教版
选修二——《化学与技术》
学习目标
1.
理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件。
2.了解合成氨生产的一般流程。
3.介绍合成氨,体验化工生产的过程,体验实验室研究与实际生产之间转化过程。
自学
影响化学反应速率和化学平衡的重要因素有哪些?
化学反应速率
化学平衡
浓度
气体
压强
温度
催化剂
温度越高,反应速率越大
压强越大,反应速率越大
正催化剂加快反应速率
反应物浓度越大,反应速率越大
升高温度,平衡向吸热反应方向移动
增大压强,平衡向气体体积减小的方向移动
催化剂对平衡无影响
增大反应物浓度,平衡正移动
课前复习
习近平总书记说:“饭碗一定要端在自己的手里,碗里面主要要装中国的粮食”。
问1:五谷的生长所需大量含氮化合物,含氮化合物的理想来源应该是什么物质?
问2:如何获得化合态氮元素?
地壳中氮的含量只有0.04%,而大气中氮气的体积分数为
78%。
氮的固定
将游离态氮转化为化合态氮的方法叫氮的固定.
对学
德国化学家哈伯从1902年开始研究合成氨,
终于在1913年实现了合成氨的工业生产,满足了20世纪人口由30亿增至60亿对粮食的需求,因此人们赞扬哈伯是“用空气制造面包的圣人”。
化学反应
看起来十分的简单,为什么合成氨的工业化生产会经历如此漫长的过程?合成氨工厂为什么需要那么庞大而复杂的生产设备和特殊的生产条件?
分析该反应的特点:
_____反应
正反应为_____反应
正反应为气体体积_____
反应特点
可逆
放热
减小
反应需要有
催化剂
假如你是一个合成氨化工厂的工程师,对工业生产你会考虑哪些问题?
要使氨生产得更快
(提高单位时间里氨的产量)
另外还要考虑生产中的消耗能源、原料来源、设备条件、环境保护等因素。
浓度
压强
温度
催化剂
提高合成氨的生产效益
要使氨生产得更多
(提高平衡混合物里氨的含量)
化学反应速率问题
化学平衡问题
1.根据合成氨反应的特点,应分别采取什么措施提高反应的平衡转化率和反应速率?
2.请尝试为合成氨选择适宜条件。
3.在确定合成氨的适宜条件的过程中遇到了哪些问题?是怎样解决的?
4.为了提高合成氨生产能力,还可以在哪些方面做进一步的改进?
群学
小组讨论
工业合成氨的合成条件的选择及理由
外部条件
取值范围或适宜条件
理由(化学反应速率、平衡原理、实际情况)
压强
温度
催化剂
浓度
20MPa_50MPa
500℃
使用铁触媒作催化剂
液化氨并及时分离
不断补充N2、H2(1:2.8)
反应速率大、平衡正移动、适合材料设备
反应速率大、平衡正移动
正催化剂加快反应速率,防止催化剂中毒
温度高反应速率大、平衡逆移动、催化剂活性最大
null
工业合成氨简易流程图
制取原料气
净化
压缩
合成
分离
液氨
N2和H2(循环)
冷凝
除去杂质气体、粉尘等,防止催化剂“中毒”
图1、合成氨工厂全貌
图2、合成氨生产装置
图3、合成氨生产控制室
图4、合成塔外貌
图5、贮存液氨的球罐
图6、合成氨的压缩机
图7、合成氨使用的催化剂
1
、能使合成氨反应进行程度增大的方法是(
)
A、升高温度
B
、降低压强
C、使用催化剂
D
、及时分离出氨气
课堂巩固
D
2、关于氨的合成工业的下列说法正确的是
(
)
(A)从合成塔出来的气体,其中氨一般占15%,所以生产氨的工业的效率都很低
(B)由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
(C)合成氨工业的反应温度控制在500
℃左右,目的是使平衡向正反应方向进行
(D)合成氨工业采用20
MPa
----
50MPa
,是因该条件下催化剂的活性最好
B
谢谢!
