高中 化学鲁科版必修二第一章第2节 元素周期律与元素周期表 课件(19张PPT)
文档属性
| 名称 | 高中 化学鲁科版必修二第一章第2节 元素周期律与元素周期表 课件(19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-25 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
第二节
元素周期律
第一章
物质结构
元素周期律
【学习目标】
1.通过实验操作,培养学生实验技能。
2.掌握元素性质的周期性变化以及元素周期律。
【重
难
点】
元素性质的递变规律;元素周期律的实质。
【高考考点】
1.
元素周期律的应用。
2.
元素周期律的实质。
复习巩固:
?
?
1.元素原子核外电子排布规律有哪些
2.元素的化合价是如何随原子序数的递增而呈现周期性变化
①核外电子总是尽先依能量逐步升高从内层排起,即:排满K层排L层,排满L层排M层
②
每个电子层最多可容纳2n2个电子(n表示电子层序数)
③最外层可容纳的电子数不能超过8个(K层是最外层时,最多不超过2个),次外层不能超过18个,倒数第三层不能超过32个。
?随着原子序数的递增,元素化合价呈现由低逐渐升高的周期性变化
?主族元素最高正价=主族序数=最外层电子数=价电子数
元素的金属性和非金属性是否也随着原子序数的变化呈现周期性变化呢?
【思考】金属性强弱的判断依据
2.置换反应
3.最高价氧化物对应水化物的碱性强弱
1.金属与H2O或与酸反应难易程度
合作探究
探究对象
——
第三周期元素
Na
Mg
Al
Si
P
S
Cl
Ar
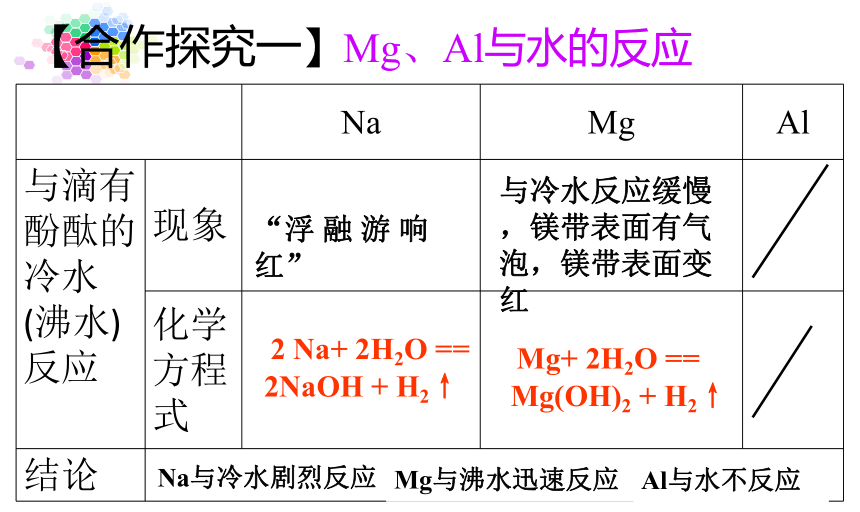
【合作探究一】
Mg、Al与滴有酚酞的水的反应
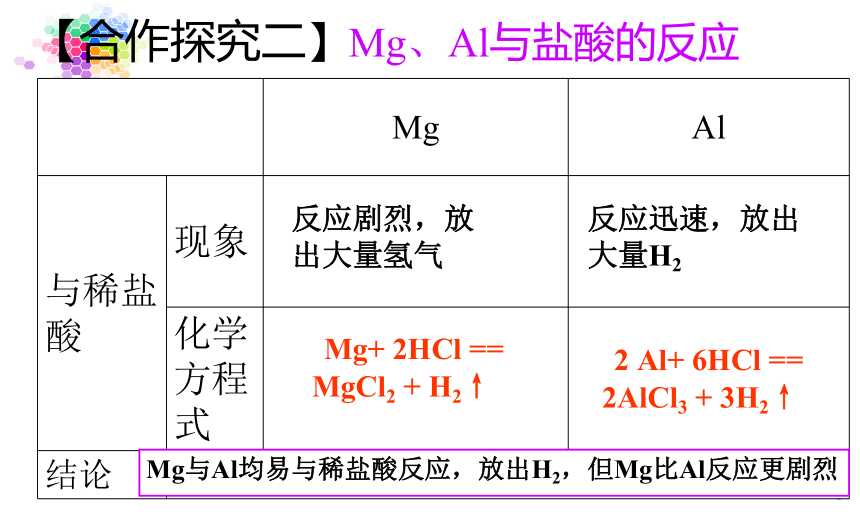
【合作探究二】Mg、Al与盐酸的反应
【合作探究三】Mg(OH)2的性质
【合作探究四】Al(OH)3的性质
2
Na+
2H2O
==
2NaOH
+
H2↑
Mg+
2H2O
==
Mg(OH)2
+
H2↑
“浮
融
游
响
红”
与冷水反应缓慢,镁带表面有气泡,镁带表面变红
Na与冷水剧烈反应,
Mg与沸水迅速反应,
Al与水不反应
【合作探究一】Mg、Al与水的反应
Na
Mg
Al
与滴有酚酞的
冷水(沸水)反应
现象
化学方程式
结论
2
Al+
6HCl
==
2AlCl3
+
3H2↑
反应剧烈,放出大量氢气
反应迅速,放出大量H2
【合作探究二】Mg、Al与盐酸的反应
Mg+
2HCl
==
MgCl2
+
H2↑
Mg与Al均易与稀盐酸反应,放出H2,但Mg比Al反应更剧烈
Mg
Al
与稀盐酸
现象
化学方程式
结论
沉淀不溶解
沉淀溶解
【合作探究三】Mg(OH)2的性质
Mg(OH)2不能溶于NaOH
Mg(OH)2+
2HCl
==
MgCl2
+
2H2O
Mg(OH)2能溶于稀盐酸
加入NaOH
加入稀盐酸
现象
化学方程式
结论
沉淀溶解
沉淀溶解
【合作探究四】Al(OH)3的性质
Al(OH)3既能溶于NaOH
Al(OH)3+
3HCl
==
AlCl3
+
3H2O
又能溶于稀盐酸
Al(OH)3+
NaOH
==
NaAlO2
+
2H2O
加入NaOH
加入稀盐酸
现象
化学方程式
结论
NaOH
Mg(OH)2
Al(OH)3
强碱
中强碱
两性氢氧化物
同一周期,随着原子序数的递增,金属性:Na>Mg>Al
与冷水剧烈反应放出H2
与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出H2
与酸剧烈反应放出氢气
Na
Mg
Al
单质与水(酸)反应
最高价氧化物对应的水化物
碱性强弱比较
结论
【链接高考】
1、用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是______
;
(2)最高价氧化物的水化物碱性最强的是___;
(3)最高价氧化物的水化物呈两性的是____;
Na
Na
Al
【思考】非金属性强弱的判断依据
1.单质与与氢气反应难易程度
2.最高价氧化物对应水化物的酸性强弱
【自主学习】结合学过的知识,完成学案表格
3.非金属气态氢化物越稳定,
非金属性越强
H2SiO3
同周期元素,随原子序数递增,非金属性:
Si高温
磷蒸汽与H2能反应
加热
光照或点燃时发生爆炸而化合
H2SO4
HClO4
弱酸
强酸
最强含氧酸
H3PO4
中强酸
Si
P
S
Cl
单质与H2反应的条件
气态氢化物的稳定性
最高价氧化物对应的水化物酸性强弱
结论
【学习反思】通过合作探究,得出什么结论?
1.同周期元素性质递变
同一周期,随原子序数的递增,
元素的金属性逐渐减弱,
元素的非金属性逐渐增强
【学习反思】这节课我们学习了什么内容?
2.元素周期律
?定义:
元素性质随原子序数的递增而呈周期性变化的规律
?实质:
核外电子排布的周期性变化
【链接高考】
2、下列说法能够证明氯元素的非金属性比硫元素强的是(
)
A.
HClO3的酸性比H2SO3
B.
HCl的酸性比H2S强
C.
HCl的稳定性比H2S强
D.
氯气与氢气化合的条件要比硫与氢气化合的条件更容易。
CD
3.
下列各组物质性质的比较中,不正确的是(
)
A、氢氧化物的碱性:
RbOH>KOH>NaOH>LiOH
B、最高价氧化物对应水化物的酸性:
HClO4C、气态氢化物的稳定性:
CH4D、单质的非金属性:F2>O2>N2>C
【练一练】
作业:
1.课本P19第六题
2.写出Al2O3、Al(OH)3分别与强酸强碱反应的离子方程式
第二节
元素周期律
第一章
物质结构
元素周期律
【学习目标】
1.通过实验操作,培养学生实验技能。
2.掌握元素性质的周期性变化以及元素周期律。
【重
难
点】
元素性质的递变规律;元素周期律的实质。
【高考考点】
1.
元素周期律的应用。
2.
元素周期律的实质。
复习巩固:
?
?
1.元素原子核外电子排布规律有哪些
2.元素的化合价是如何随原子序数的递增而呈现周期性变化
①核外电子总是尽先依能量逐步升高从内层排起,即:排满K层排L层,排满L层排M层
②
每个电子层最多可容纳2n2个电子(n表示电子层序数)
③最外层可容纳的电子数不能超过8个(K层是最外层时,最多不超过2个),次外层不能超过18个,倒数第三层不能超过32个。
?随着原子序数的递增,元素化合价呈现由低逐渐升高的周期性变化
?主族元素最高正价=主族序数=最外层电子数=价电子数
元素的金属性和非金属性是否也随着原子序数的变化呈现周期性变化呢?
【思考】金属性强弱的判断依据
2.置换反应
3.最高价氧化物对应水化物的碱性强弱
1.金属与H2O或与酸反应难易程度
合作探究
探究对象
——
第三周期元素
Na
Mg
Al
Si
P
S
Cl
Ar
【合作探究一】
Mg、Al与滴有酚酞的水的反应
【合作探究二】Mg、Al与盐酸的反应
【合作探究三】Mg(OH)2的性质
【合作探究四】Al(OH)3的性质
2
Na+
2H2O
==
2NaOH
+
H2↑
Mg+
2H2O
==
Mg(OH)2
+
H2↑
“浮
融
游
响
红”
与冷水反应缓慢,镁带表面有气泡,镁带表面变红
Na与冷水剧烈反应,
Mg与沸水迅速反应,
Al与水不反应
【合作探究一】Mg、Al与水的反应
Na
Mg
Al
与滴有酚酞的
冷水(沸水)反应
现象
化学方程式
结论
2
Al+
6HCl
==
2AlCl3
+
3H2↑
反应剧烈,放出大量氢气
反应迅速,放出大量H2
【合作探究二】Mg、Al与盐酸的反应
Mg+
2HCl
==
MgCl2
+
H2↑
Mg与Al均易与稀盐酸反应,放出H2,但Mg比Al反应更剧烈
Mg
Al
与稀盐酸
现象
化学方程式
结论
沉淀不溶解
沉淀溶解
【合作探究三】Mg(OH)2的性质
Mg(OH)2不能溶于NaOH
Mg(OH)2+
2HCl
==
MgCl2
+
2H2O
Mg(OH)2能溶于稀盐酸
加入NaOH
加入稀盐酸
现象
化学方程式
结论
沉淀溶解
沉淀溶解
【合作探究四】Al(OH)3的性质
Al(OH)3既能溶于NaOH
Al(OH)3+
3HCl
==
AlCl3
+
3H2O
又能溶于稀盐酸
Al(OH)3+
NaOH
==
NaAlO2
+
2H2O
加入NaOH
加入稀盐酸
现象
化学方程式
结论
NaOH
Mg(OH)2
Al(OH)3
强碱
中强碱
两性氢氧化物
同一周期,随着原子序数的递增,金属性:Na>Mg>Al
与冷水剧烈反应放出H2
与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出H2
与酸剧烈反应放出氢气
Na
Mg
Al
单质与水(酸)反应
最高价氧化物对应的水化物
碱性强弱比较
结论
【链接高考】
1、用元素符号回答原子序数11—18的元素的有关问题
(1)除稀有气体外,原子半径最大的是______
;
(2)最高价氧化物的水化物碱性最强的是___;
(3)最高价氧化物的水化物呈两性的是____;
Na
Na
Al
【思考】非金属性强弱的判断依据
1.单质与与氢气反应难易程度
2.最高价氧化物对应水化物的酸性强弱
【自主学习】结合学过的知识,完成学案表格
3.非金属气态氢化物越稳定,
非金属性越强
H2SiO3
同周期元素,随原子序数递增,非金属性:
Si
磷蒸汽与H2能反应
加热
光照或点燃时发生爆炸而化合
H2SO4
HClO4
弱酸
强酸
最强含氧酸
H3PO4
中强酸
Si
P
S
Cl
单质与H2反应的条件
气态氢化物的稳定性
最高价氧化物对应的水化物酸性强弱
结论
【学习反思】通过合作探究,得出什么结论?
1.同周期元素性质递变
同一周期,随原子序数的递增,
元素的金属性逐渐减弱,
元素的非金属性逐渐增强
【学习反思】这节课我们学习了什么内容?
2.元素周期律
?定义:
元素性质随原子序数的递增而呈周期性变化的规律
?实质:
核外电子排布的周期性变化
【链接高考】
2、下列说法能够证明氯元素的非金属性比硫元素强的是(
)
A.
HClO3的酸性比H2SO3
B.
HCl的酸性比H2S强
C.
HCl的稳定性比H2S强
D.
氯气与氢气化合的条件要比硫与氢气化合的条件更容易。
CD
3.
下列各组物质性质的比较中,不正确的是(
)
A、氢氧化物的碱性:
RbOH>KOH>NaOH>LiOH
B、最高价氧化物对应水化物的酸性:
HClO4
CH4
【练一练】
作业:
1.课本P19第六题
2.写出Al2O3、Al(OH)3分别与强酸强碱反应的离子方程式
