沪教版九年级下册化学 第7章 第3节 几种重要的盐--复分解反应及其应用课件(共64张PPT)
文档属性
| 名称 | 沪教版九年级下册化学 第7章 第3节 几种重要的盐--复分解反应及其应用课件(共64张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-27 17:57:36 | ||
图片预览








文档简介
(共64张PPT)
复分解反应及其应用
2019-1-30
2019-1-30
2019-1-30
盐酸
硫酸
硝酸
物
理
性
质
纯净的盐酸是无色、有刺激性气味,易挥发。
无色、粘稠、油状液体,不易挥发。
无色液体
用
途
金属除锈
吸水性,做干燥剂
物理性质-酸
H2SO4
(硫酸)
HCl
(盐酸)
1、无色、粘稠、油状液体
2、吸水性
1、无色透明有刺激性气味的液体
2、挥发性
化学性质-H2SO4
使紫色石蕊试液变红色,无色酚酞试液不变色
与Fe、Zn等金属反应(用于制氢气)
与金属氧化物反应(酸洗)
与碱反应
与盐反应
Fe
+
H2SO4
—
FeSO4
+
H2↑
Fe2O3
+
3H2SO4
—
Fe2(SO4)3
+
3H2O
Cu(OH)2
+
H2SO4
—
CuSO4
+
2H2O
BaCl2
+
H2SO4
—
BaSO4
↓+
2HCl
化学性质-HCl
使紫色石蕊试液变红色,无色酚酞试液不变色
与Fe、Zn等金属反应
与金属氧化物反应(酸洗)
与碱反应
与盐反应
Zn
+
2HCl
—
ZnCl2
+
H2↑
CuO
+
HCl
—
CuCl2
+
H2O
Fe(OH)3
+
3HCl
—
FeCl3+
3H2O
AgNO3+
HCl
—
AgCl
↓+
HNO3
盐+氢气
盐+水
新盐+新酸
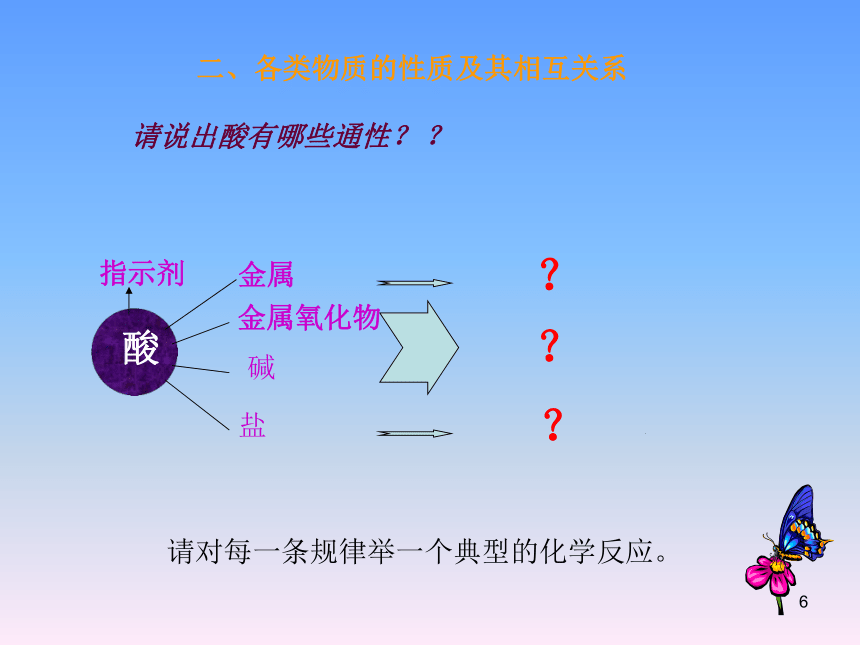
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出酸有哪些通性?
?
?
?
?
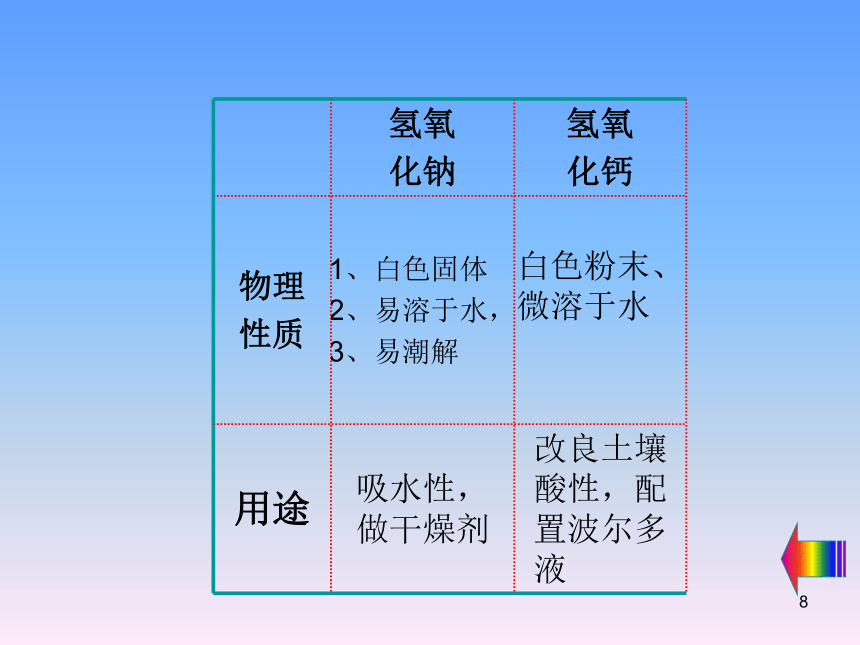
常见的碱及其物理性质和用途
氢氧
化钠
氢氧
化钙
物理
性质
1、白色固体
2、易溶于水,
3、易潮解
白色粉末、微溶于水
用途
吸水性,做干燥剂
改良土壤酸性,配置波尔多液
物理性质-碱
NaOH(俗称“烧碱、火碱、苛性钠”)
Ca(OH)2(俗称“熟石灰、消石灰”)
1、白色固体
2、易溶于水
3、易潮解
白色粉末、微溶于水
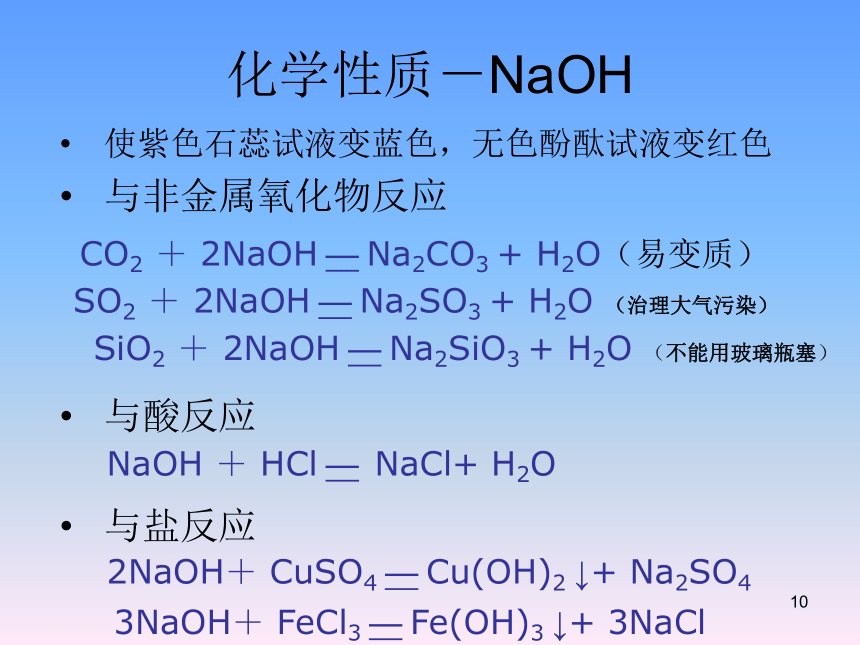
化学性质-NaOH
使紫色石蕊试液变蓝色,无色酚酞试液变红色
与非金属氧化物反应
与酸反应
与盐反应
CO2
+
2NaOH
—
Na2CO3
+
H2O(易变质)
NaOH
+
HCl
—
NaCl+
H2O
2NaOH+
CuSO4
—
Cu(OH)2
↓+
Na2SO4
SO2
+
2NaOH
—
Na2SO3
+
H2O
(治理大气污染)
SiO2
+
2NaOH
—
Na2SiO3
+
H2O
(不能用玻璃瓶塞)
3NaOH+
FeCl3
—
Fe(OH)3
↓+
3NaCl
化学性质-Ca(OH)2
使紫色石蕊试液变蓝色,无色酚酞试液变红色
与非金属氧化物反应
与酸反应
与盐反应
CO2
+
Ca(OH)2
—
CaCO3↓
+
H2O(检验CO2)
Ca(OH)2
+
H2SO4
—
CaSO4+
2H2O
Ca(OH)2+
Na2CO3
—
CaCO3
↓+
2NaOH
SO2
+
Ca(OH)2
—
CaSO3
+
H2O
(治理大气污染)
盐+水
盐+碱
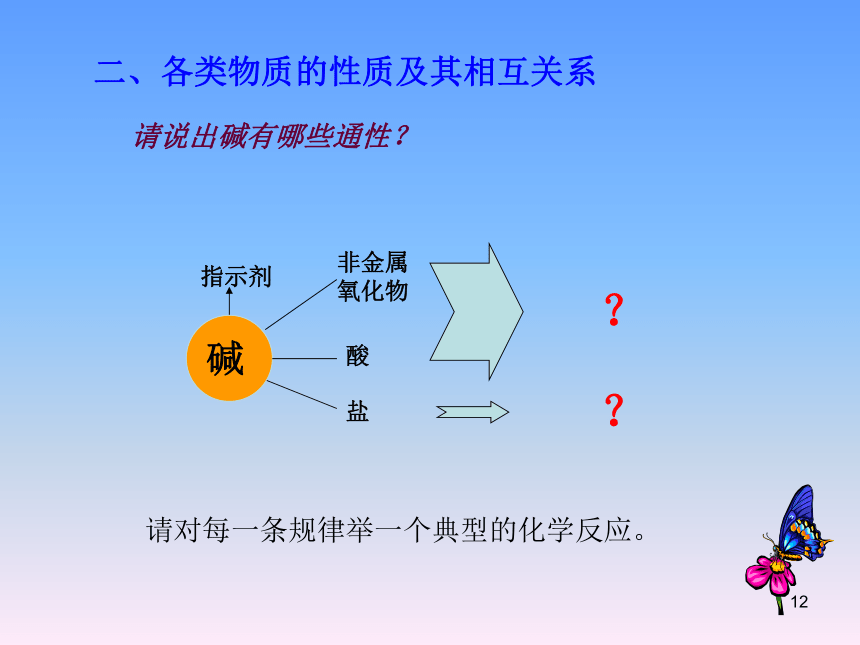
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出碱有哪些通性?
?
?
A、可溶性碱
①与酸碱指示剂作用:使无色酚酞试液变
红色,使紫色石蕊试液变蓝色
②碱+酸性氧化物→盐+水
③碱+酸→盐+水(中和反应)
④碱+某些可溶性盐→新碱+新盐
B、不溶性碱
①不能使指示剂发生变色反应
②不能和酸性氧化物及盐反应
③能和酸反应生成盐+水(中和反应)
二、碱的通性:
物理性质-盐
NaCl(俗称“食盐”)
Na2CO3(俗称“纯碱、苏打”)
1、无色透明的晶体
2、粗盐因含MgCl2、CaCl2等杂质,易潮解
1、白色粉末
2、易溶于水,
(3、其水溶液呈碱性能使酚酞溶液变红色)
(4、与盐酸反应有二氧化碳生成
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出盐有哪些化学性质?
盐类的化学性质
与酸反应
例:CaCO3
+
2HCl
—
CaCl2
+
H2O
+
CO2↑
与可溶性碱反应
例:
2NaOH+
CuSO4
—
Cu(OH)2
↓+
Na2SO4
与金属反应
例:Fe
+
CuSO4
—
Cu
+
FeSO4
与另一种可溶性盐反应生成两种新盐
例:NaCl
+
AgNO3
—
AgCl↓+
NaNO3
CuSO4
+
BaCl2
—
BaSO4↓
+
CuCl2
复分解反应发生的条件:
生成沉淀
生成气体
或生成水
复分解反应是酸、碱、盐、氧化物之间互相交换成分的反应。它们的化合价均不改变。其中碱与盐的反应必须都要是可溶的。
下列哪几组物质在水溶液里能发生复分解反应:
KNO3+NaCl???
?
Na2CO3+KNO3
BaCl2+Na2SO4?
FeCl3+NaOH
Zn+H2SO4(稀)?
CaCO3+HCl
判断下列反应能否发生?为什么?
A.①NaOH+H2SO4===
②
CaCO3+HCl
=
==
B.①
FeCl3+NaOH===
②
Cu(OH)2+FeCl3===
C.
①
AgNO3+NaCl===
②AgCl+Na2CO3===
D.①H2SO4+BaCl2===
②H2SO4+NaCl—
①
CO2+Ca(OH)2—
②
SO3+
NaOH—
A.①2NaOH+H2SO4
=
Na2SO4+2H2O
②
CaCO3+2HCl
=
CaCl
2
+
H2O
+CO2↑
B.
①
2FeCl3+3Ca(OH)2
=
2Fe
(OH)
3
↓+
3CaCl
2
②
Cu(OH)2+FeCl3
C.
①
AgNO3+
NaCl
=
AgCl↓+
NaNO3
②AgCl+
Na2CO3
D.①H2SO4+
BaCl2
=
BaSO4
↓
+
2HCl
②
H2SO4+
NaCl
E.
①
CO2+
Ca(OH)2
=
Ca
CO3
↓
+
H2O
②
SO3+
2NaOH
=
Na2SO4
+
H2O
例:
①Cu+AgNO3
——
②Fe+CuCO3——
③ZnSO4+NaCl——
④BaSO4+KOH——
⑤BaSO4+CaCO3——
⑥Cu(OH)2
+Fe——
√
×
×
×
×
×
运用酸、碱、盐的溶解性去判断复分解反应能否发生
先判断反应物:有酸不管,无酸双溶。
再判断生成物:水、气体、沉淀最少有一个
钾钠铵硝都要溶
盐酸盐中要除银
硫酸铅钡它不溶
硫酸钙银是微溶
溶碱氨钡钾钠钙
常见的酸都要溶
助记口诀
比较:四种基本反应类型
两种或两种以上
两种或两种以上
两种化合物
一种单质和一种化合物
一种
一种
两种新化合物
一种新单质和一种新化合物
反应类型
反应物
生成物
化合反应
分解反应
复分解反应
置换反应
复分解反应(五类)
1、酸+碱性氧化物——盐+水
2、酸+碱——盐+水(中和反应)
3、酸+盐——新酸+新盐
4、碱+盐——新碱+新盐
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3=CaCO3↓+2NaH
5、盐+盐——新盐+新盐
NaCl+AgNO3=AgCl↓+NaNO3
Na2SO4+BaCl2=BaSO4↓+2NaCl
6HCl+Fe2O3=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
1.下列各组物质的稀溶液,不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2????????B.Na2CO3和H2SO4
C.AgNO3和BaCl2??????
D.KCl和CuSO4
2.下列物质的转变,不能通过一步反应实现的是
A.K2SO4→KOH?????????????B.CO2→CaCO3
C.Cu(NO3)2
→CuCl2?????
D.FeCl3→Fe(OH)3
3.下列物质可用作复合肥料的是( )
A.NH4Cl?????????
B.NH4NO3?????
C.NaH2PO4????????????
D.KNO3
D
C
D
在一种溶液中加入氯化钡溶液,产生白色沉淀,再加酸,沉淀不溶解,则这种溶液中
(
)
B
A
一定含有SO42-
B
可能含有SO42-或
Ag+
C
一定含有SO42-和
Ag+
D
一定含有SO42-或CO32-
分析:溶液中加入氯化钡能产生白色沉淀,这沉淀有可能是氯离子引起的,也有可能是钡离子引起的。
练习一
4.不能与氯化钡反应的盐是( )
A.硫酸钠?????B.硝酸镁????
C.碳酸钠?????
D.硝酸银
5.有一次性区别氯化钠、氯化钡、碳酸钾三种物质的溶液,应选用( )
A.硝酸银溶液?????????????B.稀硫酸
C.稀盐酸?????????????????
D.石灰水
6.下列物质通常不能与其他物质发生复分解反应的是( )
A.Na2CO3
????B.KNO3???
C.NaCl?
D.Cu(OH)2
B
B
B
7.下列各组物质能同时存在于同一溶液中的是( )
A.AgNO3、NaCl、KNO3
B.CuSO4、KNO3、Na2CO3
C.NaOH、KCl、Fe(NO3)3
D.KCl、NaOH、Na2CO3
8.在氯化钠、碳酸钠、硫酸铜三种固体中,通常用来调味的是_____________,通常用作家用洗涤剂的是_____________,农业上用来配制波尔多液的是_____________,溶液呈蓝色的是_______________,溶液呈现碱性的是_______________。
D
NaCl
Na2CO3
CuSO4
CuSO4
Na2CO3
按下列要求,从①烧碱 ②盐酸 ③熟石灰 ④固体二氧化碳 ⑤硫酸中选出选出适当的物质,填 在相应的横线上(填标号):
(1)少量存在于人体的胃液中,能帮助消化的物质是____;
(2)能降低土壤酸性和用于配制农药波尔多液的是____;
(3)既有强烈的腐蚀性和极易溶于水的性质,又可作某些气体干燥剂的固体物质是___;
(4)可用作致冷剂的是___。
②
③
①
④
9.氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互反应,就生成了氢氧化钾。请按要求写出上述制备过程的有关反应方程式:
(1)分解反应________________________________
(2)化合反应_______________________________
(3)复分解反应_______________________________
CaCO3=CaO+CO2↑
CaO+H2O=Ca(OH)2
Ca(OH)2+K2CO3=2KOH+CaCO3↓
高温
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫
B.变红后颜色不再改变
C.先变无色后变红
D.先变红后变紫
D
鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是(
)。
A、水
B、食盐
C、纯碱
D、食醋
C
食用松花皮蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好(
)。
A、食盐
B、酱油
C、香油
D、食醋
D
某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量(
)。
A、紫色石蕊试液
B、酸溶液
C、碱溶液
D、蒸馏水
C
一定条件下,同一化学反应进行的快慢与反应物的质量分数成正比。现用100克溶液质质量分数为30%的盐酸溶液与过量的锌粉反应,为了使反应慢点进行而又不生成氢气的总量,可向所用的盐酸中加入适量的(
)。
A、氢氧化钠
B、水
C、氧化镁
D、碳酸钙
B
在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是(
)。
A、ZnO
B、Fe
C、Cu(OH)2
D、Fe2O3
A
苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是(
)
A、苯甲酸能使石蕊试液变红色
B、苯甲酸不能使酚酞变色
C、苯甲酸溶液的pH>7
D、苯甲酸溶液的pH<7
C
下列物质放置在空气中,质量不会发生变化的是( )
A、纯净的食盐和生石灰
B、纯净的食盐和石灰石
C、碳酸钠晶体和胆矾
D、碳酸钠晶体和生石灰
日常生活中的下列物质,不属于盐的是( )
A、调味用的食盐 B、消毒用的高锰酸钾
C、洗涤用的纯碱 D、食用的蔗糖
B
D
这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl
3
+3H2O
发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,是馒头内生成许多小洞,因此馒头疏松多孔。
现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。实验的过程如下:先用洁净的毛笔蘸
(填序号,下同)在白纸上画上花,再用
画上叶,将白纸挂上墙壁,晾干后用
向纸上喷即成。
A、酚酞试液
B、石蕊试液
C、氢氧化钠溶液
D、稀盐酸
食品公司通常在“
雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下:
干燥剂
DESICCANT
请勿食用
DO
NOT
EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用
(3)万一误入眼睛,请先用水清洗后,
求诊于医师、
(4)请慎防取玩
请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是
。
(2)“请勿食用”是因为干燥剂吸水后具
。
(3)如果误食入口应该
CaO+H2O==Ca(OH)2
腐蚀性
服用食醋并大量饮水
六种常见离子的鉴别方法
1、学会六种离子的鉴别方法,知道选用什么样的试剂及反应过程中的现象特征。
2、综合运用这些基本方法去解决一组物质的鉴别,培养综合分析能力。
3、学会运用化学方法分离酸、碱、盐等物质中混有杂质与除杂问题。
硝酸银、稀硝酸
氯化钡、稀硝酸
指示剂、Zn或Fe
指示剂、硫酸铜
稀盐酸、石灰水
NaOH、石蕊试纸
离子
所需试剂
现
象
结论
H+
OH-
Cl-
SO42-
CO32-
NH4+
练习一:
1、下列各组物质能够共存的是:
(
)
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
练习--化学性质
下列物质可共存于水溶液中的是( )
A、硝酸银和氯化钠 B、氯化铜和氢氧化钠
C、氯化钙和硝酸铜 D、碳酸钠和盐酸
下列方法:①金属溶于酸 ②碳酸盐溶于酸 ③氧化物溶于碱 ④氢氧化物溶于水 ⑤氧化物溶于水,肯定得不到盐的是( )
A、①② B、④⑤ C、③④⑤ D、④
C
B
1、
向某无色溶液中加入稀HCl,产生气体,将气体通入澄清的石灰水中,石灰水变浑浊,证明原溶液中可能有_______离子。
2、向某无色溶液中加入硝酸银溶液,出现白色沉淀,再加几滴稀硝酸,沉淀不消失,证明原溶液中有________离子。
CO32-
Cl-
3、无色溶液中加BaCl2溶液,出现白色沉淀,再加入几滴稀硝酸,沉淀不消失,证明原溶液中含有
离子;沉淀消失,则原溶液中可能含有
离子。
SO42-
CO32-
1、只用一种试剂就能将NH4Cl、NaCl、(NH4)2SO4、Na2SO4、CuSO4、FeCl3六种物质的溶液鉴别开来,这种试剂是________________。
2、只用酚酞就能鉴别出的一组溶液是(可以用先鉴别出的物质)
A、NaOH、HCl、NaCl
B、NaOH、BaCl2、NaNO3
C、NaOH、NaCl、MgCl2
D、NaOH、KOH、HCl
Ba(OH)2
1、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有
,一定不含有
。
Na2SO4
、BaCl2
CaCO3、CuSO4
溶液酸碱度的表示方法—pH
0
7
14
酸性增强
碱性增强
思考:什么情况下才会出现A、B、C、D各图中PH
变化?
基本概念:
1、电离:物质溶解于水离解成自由移动的离子的过程称为电离。
2、酸:电离时生成的阳离子全部是氢离子的化合物叫做酸。
3、碱:电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
4、盐:电离时生成金属离子和酸根离子的化合物叫做盐。
5、酸性氧化物:凡能跟碱反应生成盐和水的氧化物,叫做酸性氧化物。
6、碱性氧化物:凡能跟酸反应生成盐和水的氧化物,叫做酸性氧化物。
7、中和反应:酸跟碱作用而生成盐和水的反应,叫做中和反应。
8、复分解反应:两种化合物在溶液中相互交换离子,生成另外两种化合物的反应,叫做复分解反应。
制取盐的可能方法
1、金属+非金属——盐
2、金属+酸——盐+氢气
3、金属+盐——盐+金属
4、碱性氧化物+酸性氧化物——盐
5、碱性氧化物+酸——盐+水
6、酸性氧化物+碱——盐+水
7、酸+碱——盐+水
8、酸+盐——新酸+新盐
9、碱+盐——新碱+新盐
10、盐+盐——新盐+新盐
1、废液中含有ZnCl2、FeCl2、CuCl2。要全部回收金属铜,某同学先向其中加入稍过量的铁粉,充分反应后过滤,滤液中含有的阳离子是_________,滤渣中含有_________,要得到纯净的金属铜,这位同学需要继续完成的实验是____________________________________
。
备战中考
(2002金华市中考)
Zn2+
Fe2+
Fe
Cu
在滤渣中加入适量的稀盐酸,再过滤、洗涤、干燥(其他正确答案也可)
2.为了证明长期暴露在空气中的氢氧化钠溶液
已经部分变质,实验前请选用三种不同物质
类别的试剂.
实验方案
方案一
方案二
方案三
步骤一
取样2ml于
试管中
取样2ml于
试管中
取样2ml于
试管中
步骤二(选用试剂并写出相关化学方程式)
稀硫酸或稀盐酸
氢氧化钙或氢氧化钡溶液
氯化钡或硝酸钡溶液
备战中考
3、
在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组对实现调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。
请推测这四座工厂废液里的污染物
Ca(OH)2是微溶的,所以是甲厂排放的
Ca(OH)2
乙处的河水呈红褐色,说明生成了氢氧
化铁沉淀。乙工厂排放的废液含有FeCl
3
FeCl3
从上流下的不溶物是Ca(OH)2和Fe(OH)3,
丙处变清了,说明发生反应,能与之反应
的是HCl
HCl
丁处产生气泡,说明碳酸钠与盐酸反应
Na2CO3
用锌粒和盐酸反应制取的氢气中,常混有水蒸气和氯化氢气体,为了除去气体杂质,可使混合气体通过右图A、B两装置,气体通过两瓶的导管顺序正确的是(
)
A、abcd
B、dcba
C、cdab
D、bacd
a
b
c
d
浓硫酸
NaOH溶液
C
A
B
下列四种物质中,能和其他三种物质反应的是(
)。
A、盐酸
B、锌
C、铁锈
D、氢氧化铜
A
氯化钙溶液中含有少量盐酸,欲中和盐酸使溶液呈中性,且不引入新物质,在没有指示剂的条件下,可以选用下列物质中的(
)。
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
C
3、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有
,一定不含有
。
Na2SO4
、BaCl2
CaCO3、CuSO4
3、除去下列物质中的杂质(括号中为杂质),
应选
什么试剂
?写出有关反应方程式
①NaOH〖Ca(OH)2〗
②HCl〖H2SO4〗
③NaCl〖Na2CO3〗
④KNO3〖KCl〗
⑤BaSO4〖BaCO3〗
⑥NaCl〖MgSO4〗
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
BaCl2+H2SO4=BaSO4↓+2HCl
2HCl+Na2CO3=2NaCl+CO2↑+H2O
KCl+AgNO3=AgCl↓+KNO3
H2SO4+BaCO3=BaSO4↓+CO2↑+H2O
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠,为了确定它们各是什么,进行了一系列实验,其中观察到如下现象:
(1)B跟C两溶液混合,产生白色沉淀。
(2)B跟D两溶液混合,产生白色沉淀。
(3)B跟E两溶液混和,产生气泡。
(4)C溶液能使红色石蕊试纸变蓝。
分析上述实验现象,推出A、B、C、D、E的化学式:
A
B
C
D
E
。
Na2CO3
Ca(OH)2
CaCl2
HCl
NaCl
复分解反应及其应用
2019-1-30
2019-1-30
2019-1-30
盐酸
硫酸
硝酸
物
理
性
质
纯净的盐酸是无色、有刺激性气味,易挥发。
无色、粘稠、油状液体,不易挥发。
无色液体
用
途
金属除锈
吸水性,做干燥剂
物理性质-酸
H2SO4
(硫酸)
HCl
(盐酸)
1、无色、粘稠、油状液体
2、吸水性
1、无色透明有刺激性气味的液体
2、挥发性
化学性质-H2SO4
使紫色石蕊试液变红色,无色酚酞试液不变色
与Fe、Zn等金属反应(用于制氢气)
与金属氧化物反应(酸洗)
与碱反应
与盐反应
Fe
+
H2SO4
—
FeSO4
+
H2↑
Fe2O3
+
3H2SO4
—
Fe2(SO4)3
+
3H2O
Cu(OH)2
+
H2SO4
—
CuSO4
+
2H2O
BaCl2
+
H2SO4
—
BaSO4
↓+
2HCl
化学性质-HCl
使紫色石蕊试液变红色,无色酚酞试液不变色
与Fe、Zn等金属反应
与金属氧化物反应(酸洗)
与碱反应
与盐反应
Zn
+
2HCl
—
ZnCl2
+
H2↑
CuO
+
HCl
—
CuCl2
+
H2O
Fe(OH)3
+
3HCl
—
FeCl3+
3H2O
AgNO3+
HCl
—
AgCl
↓+
HNO3
盐+氢气
盐+水
新盐+新酸
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出酸有哪些通性?
?
?
?
?
常见的碱及其物理性质和用途
氢氧
化钠
氢氧
化钙
物理
性质
1、白色固体
2、易溶于水,
3、易潮解
白色粉末、微溶于水
用途
吸水性,做干燥剂
改良土壤酸性,配置波尔多液
物理性质-碱
NaOH(俗称“烧碱、火碱、苛性钠”)
Ca(OH)2(俗称“熟石灰、消石灰”)
1、白色固体
2、易溶于水
3、易潮解
白色粉末、微溶于水
化学性质-NaOH
使紫色石蕊试液变蓝色,无色酚酞试液变红色
与非金属氧化物反应
与酸反应
与盐反应
CO2
+
2NaOH
—
Na2CO3
+
H2O(易变质)
NaOH
+
HCl
—
NaCl+
H2O
2NaOH+
CuSO4
—
Cu(OH)2
↓+
Na2SO4
SO2
+
2NaOH
—
Na2SO3
+
H2O
(治理大气污染)
SiO2
+
2NaOH
—
Na2SiO3
+
H2O
(不能用玻璃瓶塞)
3NaOH+
FeCl3
—
Fe(OH)3
↓+
3NaCl
化学性质-Ca(OH)2
使紫色石蕊试液变蓝色,无色酚酞试液变红色
与非金属氧化物反应
与酸反应
与盐反应
CO2
+
Ca(OH)2
—
CaCO3↓
+
H2O(检验CO2)
Ca(OH)2
+
H2SO4
—
CaSO4+
2H2O
Ca(OH)2+
Na2CO3
—
CaCO3
↓+
2NaOH
SO2
+
Ca(OH)2
—
CaSO3
+
H2O
(治理大气污染)
盐+水
盐+碱
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出碱有哪些通性?
?
?
A、可溶性碱
①与酸碱指示剂作用:使无色酚酞试液变
红色,使紫色石蕊试液变蓝色
②碱+酸性氧化物→盐+水
③碱+酸→盐+水(中和反应)
④碱+某些可溶性盐→新碱+新盐
B、不溶性碱
①不能使指示剂发生变色反应
②不能和酸性氧化物及盐反应
③能和酸反应生成盐+水(中和反应)
二、碱的通性:
物理性质-盐
NaCl(俗称“食盐”)
Na2CO3(俗称“纯碱、苏打”)
1、无色透明的晶体
2、粗盐因含MgCl2、CaCl2等杂质,易潮解
1、白色粉末
2、易溶于水,
(3、其水溶液呈碱性能使酚酞溶液变红色)
(4、与盐酸反应有二氧化碳生成
请对每一条规律举一个典型的化学反应。
二、各类物质的性质及其相互关系
请说出盐有哪些化学性质?
盐类的化学性质
与酸反应
例:CaCO3
+
2HCl
—
CaCl2
+
H2O
+
CO2↑
与可溶性碱反应
例:
2NaOH+
CuSO4
—
Cu(OH)2
↓+
Na2SO4
与金属反应
例:Fe
+
CuSO4
—
Cu
+
FeSO4
与另一种可溶性盐反应生成两种新盐
例:NaCl
+
AgNO3
—
AgCl↓+
NaNO3
CuSO4
+
BaCl2
—
BaSO4↓
+
CuCl2
复分解反应发生的条件:
生成沉淀
生成气体
或生成水
复分解反应是酸、碱、盐、氧化物之间互相交换成分的反应。它们的化合价均不改变。其中碱与盐的反应必须都要是可溶的。
下列哪几组物质在水溶液里能发生复分解反应:
KNO3+NaCl???
?
Na2CO3+KNO3
BaCl2+Na2SO4?
FeCl3+NaOH
Zn+H2SO4(稀)?
CaCO3+HCl
判断下列反应能否发生?为什么?
A.①NaOH+H2SO4===
②
CaCO3+HCl
=
==
B.①
FeCl3+NaOH===
②
Cu(OH)2+FeCl3===
C.
①
AgNO3+NaCl===
②AgCl+Na2CO3===
D.①H2SO4+BaCl2===
②H2SO4+NaCl—
①
CO2+Ca(OH)2—
②
SO3+
NaOH—
A.①2NaOH+H2SO4
=
Na2SO4+2H2O
②
CaCO3+2HCl
=
CaCl
2
+
H2O
+CO2↑
B.
①
2FeCl3+3Ca(OH)2
=
2Fe
(OH)
3
↓+
3CaCl
2
②
Cu(OH)2+FeCl3
C.
①
AgNO3+
NaCl
=
AgCl↓+
NaNO3
②AgCl+
Na2CO3
D.①H2SO4+
BaCl2
=
BaSO4
↓
+
2HCl
②
H2SO4+
NaCl
E.
①
CO2+
Ca(OH)2
=
Ca
CO3
↓
+
H2O
②
SO3+
2NaOH
=
Na2SO4
+
H2O
例:
①Cu+AgNO3
——
②Fe+CuCO3——
③ZnSO4+NaCl——
④BaSO4+KOH——
⑤BaSO4+CaCO3——
⑥Cu(OH)2
+Fe——
√
×
×
×
×
×
运用酸、碱、盐的溶解性去判断复分解反应能否发生
先判断反应物:有酸不管,无酸双溶。
再判断生成物:水、气体、沉淀最少有一个
钾钠铵硝都要溶
盐酸盐中要除银
硫酸铅钡它不溶
硫酸钙银是微溶
溶碱氨钡钾钠钙
常见的酸都要溶
助记口诀
比较:四种基本反应类型
两种或两种以上
两种或两种以上
两种化合物
一种单质和一种化合物
一种
一种
两种新化合物
一种新单质和一种新化合物
反应类型
反应物
生成物
化合反应
分解反应
复分解反应
置换反应
复分解反应(五类)
1、酸+碱性氧化物——盐+水
2、酸+碱——盐+水(中和反应)
3、酸+盐——新酸+新盐
4、碱+盐——新碱+新盐
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3=CaCO3↓+2NaH
5、盐+盐——新盐+新盐
NaCl+AgNO3=AgCl↓+NaNO3
Na2SO4+BaCl2=BaSO4↓+2NaCl
6HCl+Fe2O3=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
1.下列各组物质的稀溶液,不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2????????B.Na2CO3和H2SO4
C.AgNO3和BaCl2??????
D.KCl和CuSO4
2.下列物质的转变,不能通过一步反应实现的是
A.K2SO4→KOH?????????????B.CO2→CaCO3
C.Cu(NO3)2
→CuCl2?????
D.FeCl3→Fe(OH)3
3.下列物质可用作复合肥料的是( )
A.NH4Cl?????????
B.NH4NO3?????
C.NaH2PO4????????????
D.KNO3
D
C
D
在一种溶液中加入氯化钡溶液,产生白色沉淀,再加酸,沉淀不溶解,则这种溶液中
(
)
B
A
一定含有SO42-
B
可能含有SO42-或
Ag+
C
一定含有SO42-和
Ag+
D
一定含有SO42-或CO32-
分析:溶液中加入氯化钡能产生白色沉淀,这沉淀有可能是氯离子引起的,也有可能是钡离子引起的。
练习一
4.不能与氯化钡反应的盐是( )
A.硫酸钠?????B.硝酸镁????
C.碳酸钠?????
D.硝酸银
5.有一次性区别氯化钠、氯化钡、碳酸钾三种物质的溶液,应选用( )
A.硝酸银溶液?????????????B.稀硫酸
C.稀盐酸?????????????????
D.石灰水
6.下列物质通常不能与其他物质发生复分解反应的是( )
A.Na2CO3
????B.KNO3???
C.NaCl?
D.Cu(OH)2
B
B
B
7.下列各组物质能同时存在于同一溶液中的是( )
A.AgNO3、NaCl、KNO3
B.CuSO4、KNO3、Na2CO3
C.NaOH、KCl、Fe(NO3)3
D.KCl、NaOH、Na2CO3
8.在氯化钠、碳酸钠、硫酸铜三种固体中,通常用来调味的是_____________,通常用作家用洗涤剂的是_____________,农业上用来配制波尔多液的是_____________,溶液呈蓝色的是_______________,溶液呈现碱性的是_______________。
D
NaCl
Na2CO3
CuSO4
CuSO4
Na2CO3
按下列要求,从①烧碱 ②盐酸 ③熟石灰 ④固体二氧化碳 ⑤硫酸中选出选出适当的物质,填 在相应的横线上(填标号):
(1)少量存在于人体的胃液中,能帮助消化的物质是____;
(2)能降低土壤酸性和用于配制农药波尔多液的是____;
(3)既有强烈的腐蚀性和极易溶于水的性质,又可作某些气体干燥剂的固体物质是___;
(4)可用作致冷剂的是___。
②
③
①
④
9.氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互反应,就生成了氢氧化钾。请按要求写出上述制备过程的有关反应方程式:
(1)分解反应________________________________
(2)化合反应_______________________________
(3)复分解反应_______________________________
CaCO3=CaO+CO2↑
CaO+H2O=Ca(OH)2
Ca(OH)2+K2CO3=2KOH+CaCO3↓
高温
“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )
A.先变蓝后变紫
B.变红后颜色不再改变
C.先变无色后变红
D.先变红后变紫
D
鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是(
)。
A、水
B、食盐
C、纯碱
D、食醋
C
食用松花皮蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好(
)。
A、食盐
B、酱油
C、香油
D、食醋
D
某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量(
)。
A、紫色石蕊试液
B、酸溶液
C、碱溶液
D、蒸馏水
C
一定条件下,同一化学反应进行的快慢与反应物的质量分数成正比。现用100克溶液质质量分数为30%的盐酸溶液与过量的锌粉反应,为了使反应慢点进行而又不生成氢气的总量,可向所用的盐酸中加入适量的(
)。
A、氢氧化钠
B、水
C、氧化镁
D、碳酸钙
B
在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是(
)。
A、ZnO
B、Fe
C、Cu(OH)2
D、Fe2O3
A
苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是(
)
A、苯甲酸能使石蕊试液变红色
B、苯甲酸不能使酚酞变色
C、苯甲酸溶液的pH>7
D、苯甲酸溶液的pH<7
C
下列物质放置在空气中,质量不会发生变化的是( )
A、纯净的食盐和生石灰
B、纯净的食盐和石灰石
C、碳酸钠晶体和胆矾
D、碳酸钠晶体和生石灰
日常生活中的下列物质,不属于盐的是( )
A、调味用的食盐 B、消毒用的高锰酸钾
C、洗涤用的纯碱 D、食用的蔗糖
B
D
这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl
3
+3H2O
发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,是馒头内生成许多小洞,因此馒头疏松多孔。
现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。实验的过程如下:先用洁净的毛笔蘸
(填序号,下同)在白纸上画上花,再用
画上叶,将白纸挂上墙壁,晾干后用
向纸上喷即成。
A、酚酞试液
B、石蕊试液
C、氢氧化钠溶液
D、稀盐酸
食品公司通常在“
雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下:
干燥剂
DESICCANT
请勿食用
DO
NOT
EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用
(3)万一误入眼睛,请先用水清洗后,
求诊于医师、
(4)请慎防取玩
请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是
。
(2)“请勿食用”是因为干燥剂吸水后具
。
(3)如果误食入口应该
CaO+H2O==Ca(OH)2
腐蚀性
服用食醋并大量饮水
六种常见离子的鉴别方法
1、学会六种离子的鉴别方法,知道选用什么样的试剂及反应过程中的现象特征。
2、综合运用这些基本方法去解决一组物质的鉴别,培养综合分析能力。
3、学会运用化学方法分离酸、碱、盐等物质中混有杂质与除杂问题。
硝酸银、稀硝酸
氯化钡、稀硝酸
指示剂、Zn或Fe
指示剂、硫酸铜
稀盐酸、石灰水
NaOH、石蕊试纸
离子
所需试剂
现
象
结论
H+
OH-
Cl-
SO42-
CO32-
NH4+
练习一:
1、下列各组物质能够共存的是:
(
)
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3
C
练习--化学性质
下列物质可共存于水溶液中的是( )
A、硝酸银和氯化钠 B、氯化铜和氢氧化钠
C、氯化钙和硝酸铜 D、碳酸钠和盐酸
下列方法:①金属溶于酸 ②碳酸盐溶于酸 ③氧化物溶于碱 ④氢氧化物溶于水 ⑤氧化物溶于水,肯定得不到盐的是( )
A、①② B、④⑤ C、③④⑤ D、④
C
B
1、
向某无色溶液中加入稀HCl,产生气体,将气体通入澄清的石灰水中,石灰水变浑浊,证明原溶液中可能有_______离子。
2、向某无色溶液中加入硝酸银溶液,出现白色沉淀,再加几滴稀硝酸,沉淀不消失,证明原溶液中有________离子。
CO32-
Cl-
3、无色溶液中加BaCl2溶液,出现白色沉淀,再加入几滴稀硝酸,沉淀不消失,证明原溶液中含有
离子;沉淀消失,则原溶液中可能含有
离子。
SO42-
CO32-
1、只用一种试剂就能将NH4Cl、NaCl、(NH4)2SO4、Na2SO4、CuSO4、FeCl3六种物质的溶液鉴别开来,这种试剂是________________。
2、只用酚酞就能鉴别出的一组溶液是(可以用先鉴别出的物质)
A、NaOH、HCl、NaCl
B、NaOH、BaCl2、NaNO3
C、NaOH、NaCl、MgCl2
D、NaOH、KOH、HCl
Ba(OH)2
1、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有
,一定不含有
。
Na2SO4
、BaCl2
CaCO3、CuSO4
溶液酸碱度的表示方法—pH
0
7
14
酸性增强
碱性增强
思考:什么情况下才会出现A、B、C、D各图中PH
变化?
基本概念:
1、电离:物质溶解于水离解成自由移动的离子的过程称为电离。
2、酸:电离时生成的阳离子全部是氢离子的化合物叫做酸。
3、碱:电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
4、盐:电离时生成金属离子和酸根离子的化合物叫做盐。
5、酸性氧化物:凡能跟碱反应生成盐和水的氧化物,叫做酸性氧化物。
6、碱性氧化物:凡能跟酸反应生成盐和水的氧化物,叫做酸性氧化物。
7、中和反应:酸跟碱作用而生成盐和水的反应,叫做中和反应。
8、复分解反应:两种化合物在溶液中相互交换离子,生成另外两种化合物的反应,叫做复分解反应。
制取盐的可能方法
1、金属+非金属——盐
2、金属+酸——盐+氢气
3、金属+盐——盐+金属
4、碱性氧化物+酸性氧化物——盐
5、碱性氧化物+酸——盐+水
6、酸性氧化物+碱——盐+水
7、酸+碱——盐+水
8、酸+盐——新酸+新盐
9、碱+盐——新碱+新盐
10、盐+盐——新盐+新盐
1、废液中含有ZnCl2、FeCl2、CuCl2。要全部回收金属铜,某同学先向其中加入稍过量的铁粉,充分反应后过滤,滤液中含有的阳离子是_________,滤渣中含有_________,要得到纯净的金属铜,这位同学需要继续完成的实验是____________________________________
。
备战中考
(2002金华市中考)
Zn2+
Fe2+
Fe
Cu
在滤渣中加入适量的稀盐酸,再过滤、洗涤、干燥(其他正确答案也可)
2.为了证明长期暴露在空气中的氢氧化钠溶液
已经部分变质,实验前请选用三种不同物质
类别的试剂.
实验方案
方案一
方案二
方案三
步骤一
取样2ml于
试管中
取样2ml于
试管中
取样2ml于
试管中
步骤二(选用试剂并写出相关化学方程式)
稀硫酸或稀盐酸
氢氧化钙或氢氧化钡溶液
氯化钡或硝酸钡溶液
备战中考
3、
在一条鱼虾绝迹的小河边,有四座工厂:甲、乙、丙、丁。他们排放的废液里,每厂只有碳酸钠、氯化铁、氢氧化钙、盐酸的一种。某中学环保小组对实现调查的情况如图。甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生。
请推测这四座工厂废液里的污染物
Ca(OH)2是微溶的,所以是甲厂排放的
Ca(OH)2
乙处的河水呈红褐色,说明生成了氢氧
化铁沉淀。乙工厂排放的废液含有FeCl
3
FeCl3
从上流下的不溶物是Ca(OH)2和Fe(OH)3,
丙处变清了,说明发生反应,能与之反应
的是HCl
HCl
丁处产生气泡,说明碳酸钠与盐酸反应
Na2CO3
用锌粒和盐酸反应制取的氢气中,常混有水蒸气和氯化氢气体,为了除去气体杂质,可使混合气体通过右图A、B两装置,气体通过两瓶的导管顺序正确的是(
)
A、abcd
B、dcba
C、cdab
D、bacd
a
b
c
d
浓硫酸
NaOH溶液
C
A
B
下列四种物质中,能和其他三种物质反应的是(
)。
A、盐酸
B、锌
C、铁锈
D、氢氧化铜
A
氯化钙溶液中含有少量盐酸,欲中和盐酸使溶液呈中性,且不引入新物质,在没有指示剂的条件下,可以选用下列物质中的(
)。
A、Ca(OH)2
B、CaO
C、CaCO3
D、AgNO3
C
3、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有
,一定不含有
。
Na2SO4
、BaCl2
CaCO3、CuSO4
3、除去下列物质中的杂质(括号中为杂质),
应选
什么试剂
?写出有关反应方程式
①NaOH〖Ca(OH)2〗
②HCl〖H2SO4〗
③NaCl〖Na2CO3〗
④KNO3〖KCl〗
⑤BaSO4〖BaCO3〗
⑥NaCl〖MgSO4〗
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
BaCl2+H2SO4=BaSO4↓+2HCl
2HCl+Na2CO3=2NaCl+CO2↑+H2O
KCl+AgNO3=AgCl↓+KNO3
H2SO4+BaCO3=BaSO4↓+CO2↑+H2O
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
现有A、B、C、D、E五瓶无色溶液,它们是盐酸、氯化钠、氯化钙、氢氧化钙和碳酸钠,为了确定它们各是什么,进行了一系列实验,其中观察到如下现象:
(1)B跟C两溶液混合,产生白色沉淀。
(2)B跟D两溶液混合,产生白色沉淀。
(3)B跟E两溶液混和,产生气泡。
(4)C溶液能使红色石蕊试纸变蓝。
分析上述实验现象,推出A、B、C、D、E的化学式:
A
B
C
D
E
。
Na2CO3
Ca(OH)2
CaCl2
HCl
NaCl
