高中化学鲁科版 必修2 1.3元素周期表的应用 (2)(共15张PPT)
文档属性
| 名称 | 高中化学鲁科版 必修2 1.3元素周期表的应用 (2)(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 479.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 00:00:00 | ||
图片预览


文档简介
(共15张PPT)
第一章第三节
元素周期表的应用第2课时
预测同主族元素的性质
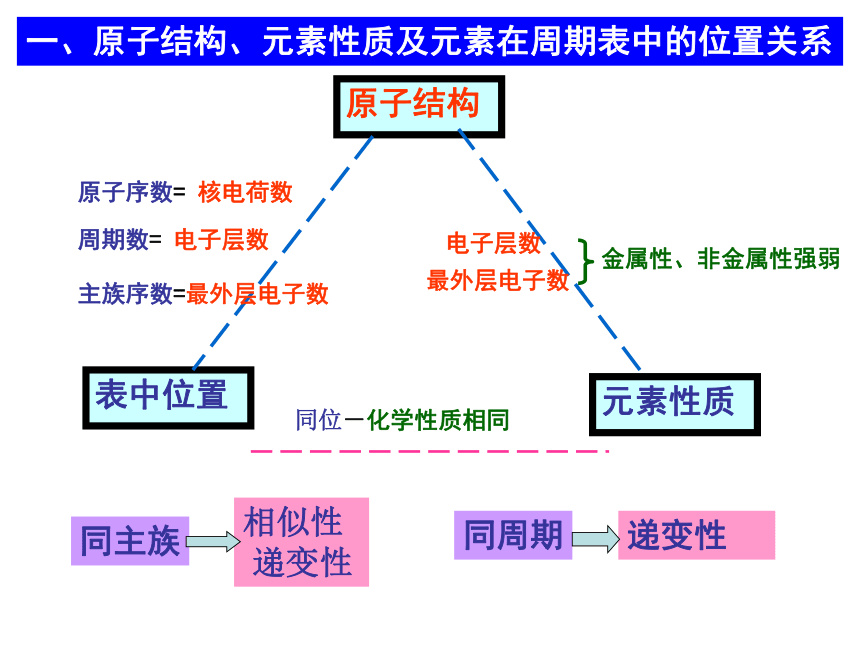
原子结构
表中位置
元素性质
原子序数=
核电荷数
周期数=
电子层数
主族序数=最外层电子数
同位-化学性质相同
电子层数
最外层电子数
金属性、非金属性强弱
一、原子结构、元素性质及元素在周期表中的位置关系
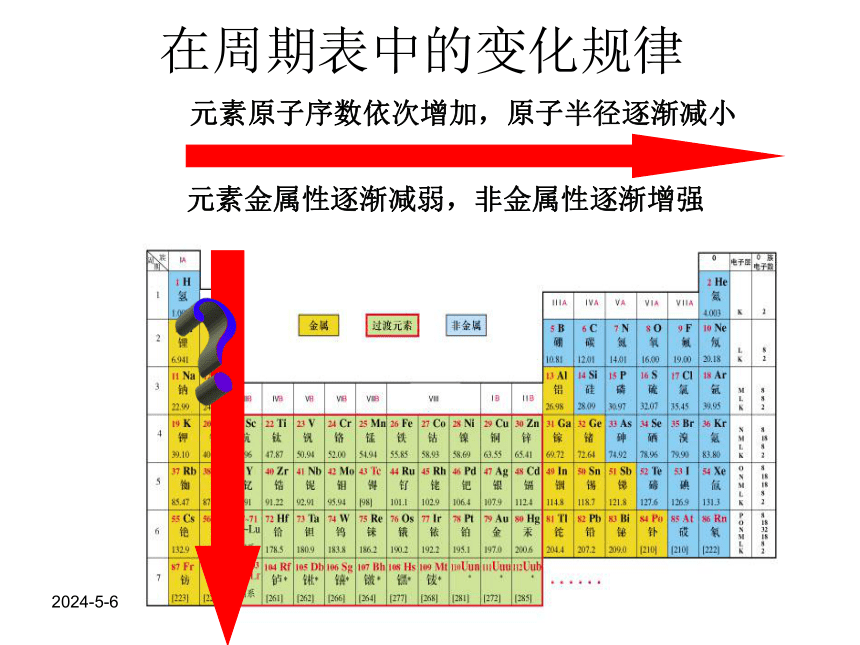
在周期表中的变化规律
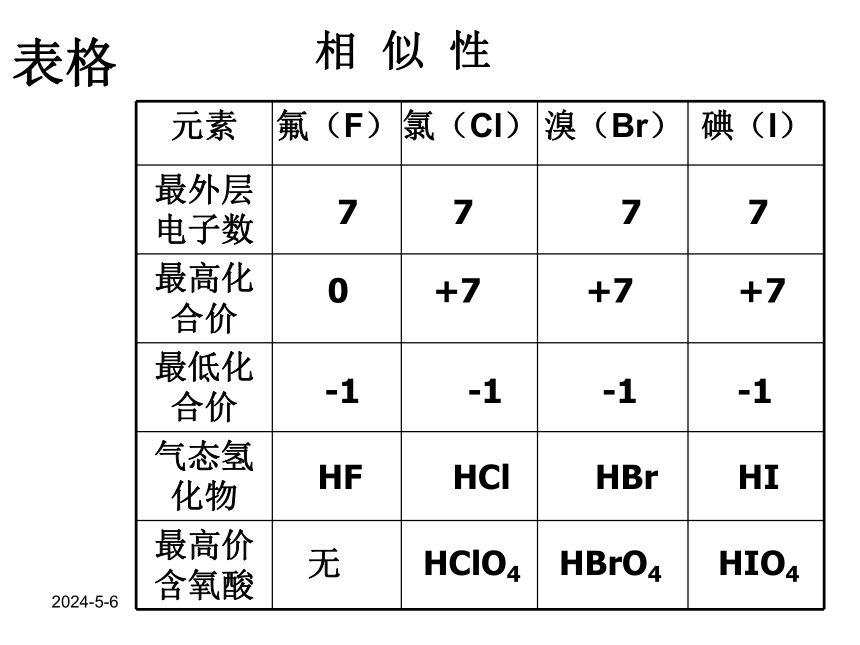
表格
7
7
7
7
0
+7
+7
+7
-1
-1
-1
-1
HF
HCl
HBr
HI
无
HClO4
HBrO4
HIO4
相
似
性
元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
最外层电子数
最高化合价
最低化合价
气态氢化物
最高价含氧酸
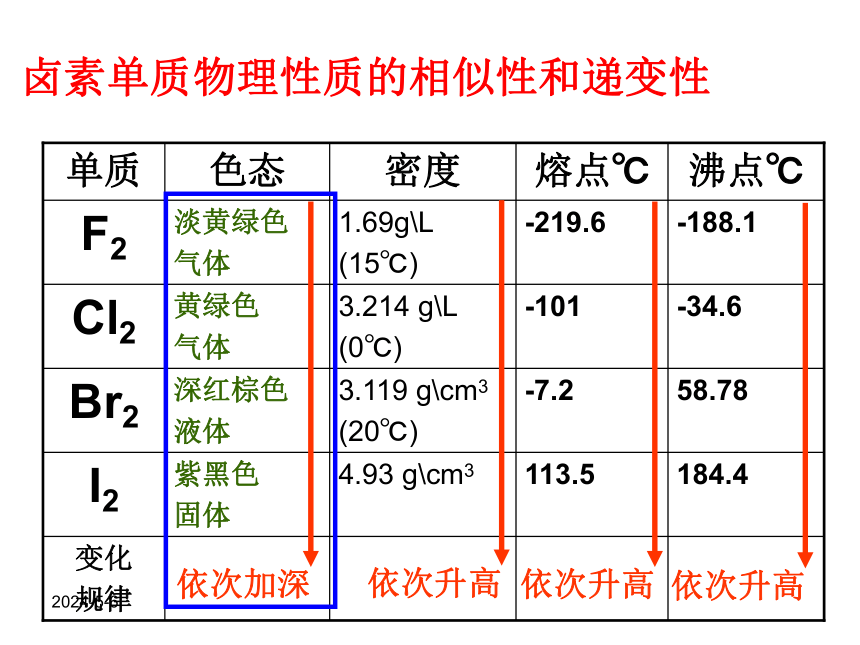
卤素单质物理性质的相似性和递变性
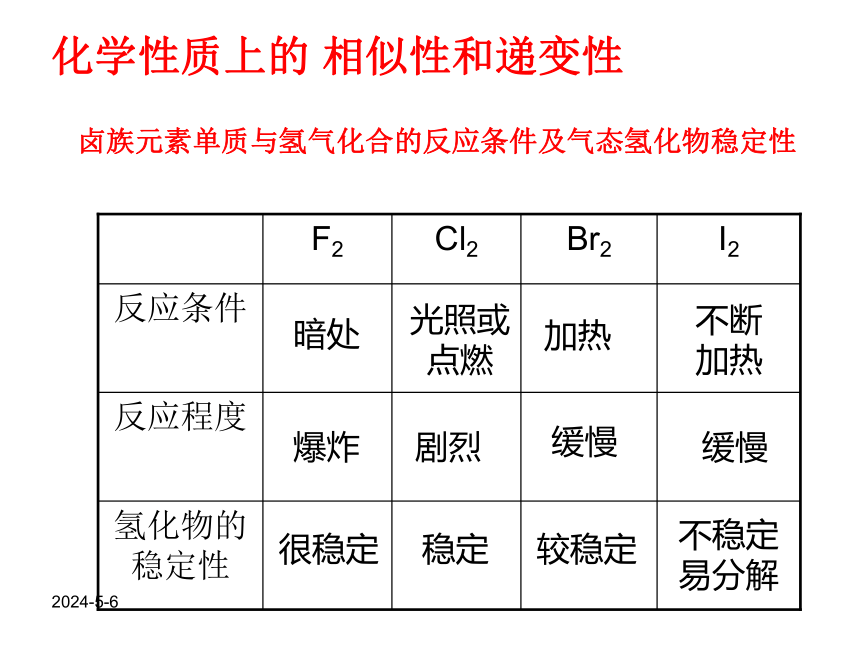
卤族元素单质与氢气化合的反应条件及气态氢化物稳定性
化学性质上的
相似性和递变性
小结
对ⅦA族元素原子从上到下,电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。其单质的熔、沸点在依次的增大。
对其它的主族而言适应吗?
预测金属钾的性质
观察钾元素在元素周期表中的位置,预测金属钾的性质,并与钠的性质进行比较。
视频K
视频Li
视频Cs
实验现象
钠跟水剧烈反应,钠浮在水的表面,并迅速的熔成一个闪亮的小球,在水面四处游动,发出“嘶嘶”声,但未见爆炸现象,加入酚酞后,溶液显红色。
2
Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
钾跟水反应更剧烈,钾浮在水的表面,
在水面四处游动,熔成一个闪亮的火球,发出紫色的火焰,并伴有轻微的爆炸现象,加入酚酞后,溶液显红色。
碱金属元素(第ⅠA族元素,除氢)
①易失去最外层的1个电子,达稳定结构。最高正价是+1,对应的碱是ROH
,碱性强。
②随原子序数的递增,失电子的能力逐渐增强。ROH的碱性逐渐增强。
总
结
最外层电子数相同→性质相似。
随着原子序数的增加,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减小,元素原子得电子的能力逐渐减弱,失电子能力逐渐增强,非金属性逐渐减弱,金属性逐渐增强。
二、同主族元素性质
元素性质递变规律
三、元素周期表的应用
(1)根据元素在周期表中的位置,推测元素的____
______,预测其主要_________。
(2)研究合成新物质
①在金属和非金属的分界线附近寻找________材料(如______________等);
②在_______元素中寻找各种优良的催化剂及耐高温、耐腐蚀的合金材料。
原子
结构
性质
半导体
Si、Ge、Se
过渡
随堂练习
1.
第四周期某主族元素的原子,它的最外电子层上有2个电子,下列关于此元素的叙述正确的是(
)
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径小
D.碳酸盐难溶于水
D
3
下列氧化物按其形成的含氧酸酸性递增的顺序排列的是(
)
A.SiO2
<
CO2
<
SO3
<
P2O5
B.SiO2
<
CO2
<
P2O5
<
SO3
C.
CO2
<
SiO2
<
P2O5
<
SO3
D.
CO2
<
P2O5
<
SO3<
SiO2
B
第一章第三节
元素周期表的应用第2课时
预测同主族元素的性质
原子结构
表中位置
元素性质
原子序数=
核电荷数
周期数=
电子层数
主族序数=最外层电子数
同位-化学性质相同
电子层数
最外层电子数
金属性、非金属性强弱
一、原子结构、元素性质及元素在周期表中的位置关系
在周期表中的变化规律
表格
7
7
7
7
0
+7
+7
+7
-1
-1
-1
-1
HF
HCl
HBr
HI
无
HClO4
HBrO4
HIO4
相
似
性
元素
氟(F)
氯(Cl)
溴(Br)
碘(I)
最外层电子数
最高化合价
最低化合价
气态氢化物
最高价含氧酸
卤素单质物理性质的相似性和递变性
卤族元素单质与氢气化合的反应条件及气态氢化物稳定性
化学性质上的
相似性和递变性
小结
对ⅦA族元素原子从上到下,电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。其单质的熔、沸点在依次的增大。
对其它的主族而言适应吗?
预测金属钾的性质
观察钾元素在元素周期表中的位置,预测金属钾的性质,并与钠的性质进行比较。
视频K
视频Li
视频Cs
实验现象
钠跟水剧烈反应,钠浮在水的表面,并迅速的熔成一个闪亮的小球,在水面四处游动,发出“嘶嘶”声,但未见爆炸现象,加入酚酞后,溶液显红色。
2
Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
钾跟水反应更剧烈,钾浮在水的表面,
在水面四处游动,熔成一个闪亮的火球,发出紫色的火焰,并伴有轻微的爆炸现象,加入酚酞后,溶液显红色。
碱金属元素(第ⅠA族元素,除氢)
①易失去最外层的1个电子,达稳定结构。最高正价是+1,对应的碱是ROH
,碱性强。
②随原子序数的递增,失电子的能力逐渐增强。ROH的碱性逐渐增强。
总
结
最外层电子数相同→性质相似。
随着原子序数的增加,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减小,元素原子得电子的能力逐渐减弱,失电子能力逐渐增强,非金属性逐渐减弱,金属性逐渐增强。
二、同主族元素性质
元素性质递变规律
三、元素周期表的应用
(1)根据元素在周期表中的位置,推测元素的____
______,预测其主要_________。
(2)研究合成新物质
①在金属和非金属的分界线附近寻找________材料(如______________等);
②在_______元素中寻找各种优良的催化剂及耐高温、耐腐蚀的合金材料。
原子
结构
性质
半导体
Si、Ge、Se
过渡
随堂练习
1.
第四周期某主族元素的原子,它的最外电子层上有2个电子,下列关于此元素的叙述正确的是(
)
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径小
D.碳酸盐难溶于水
D
3
下列氧化物按其形成的含氧酸酸性递增的顺序排列的是(
)
A.SiO2
<
CO2
<
SO3
<
P2O5
B.SiO2
<
CO2
<
P2O5
<
SO3
C.
CO2
<
SiO2
<
P2O5
<
SO3
D.
CO2
<
P2O5
<
SO3<
SiO2
B
