高中化学鲁科版 必修2 1.2元素周期律与元素周期表2(共19张PPT)
文档属性
| 名称 | 高中化学鲁科版 必修2 1.2元素周期律与元素周期表2(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
元素周期律
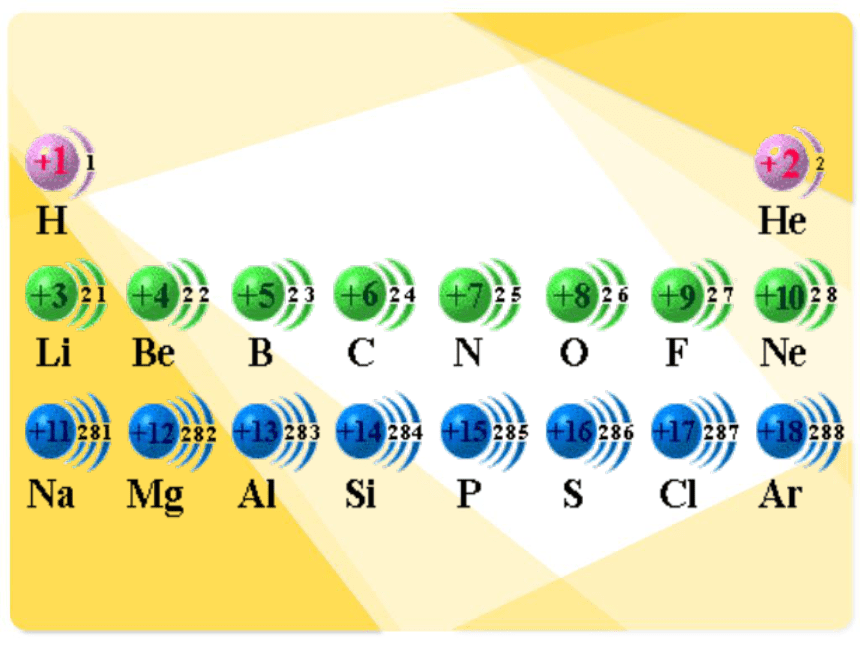
随原子序数的递增,原子最外层电子呈现什么规律性的变化?
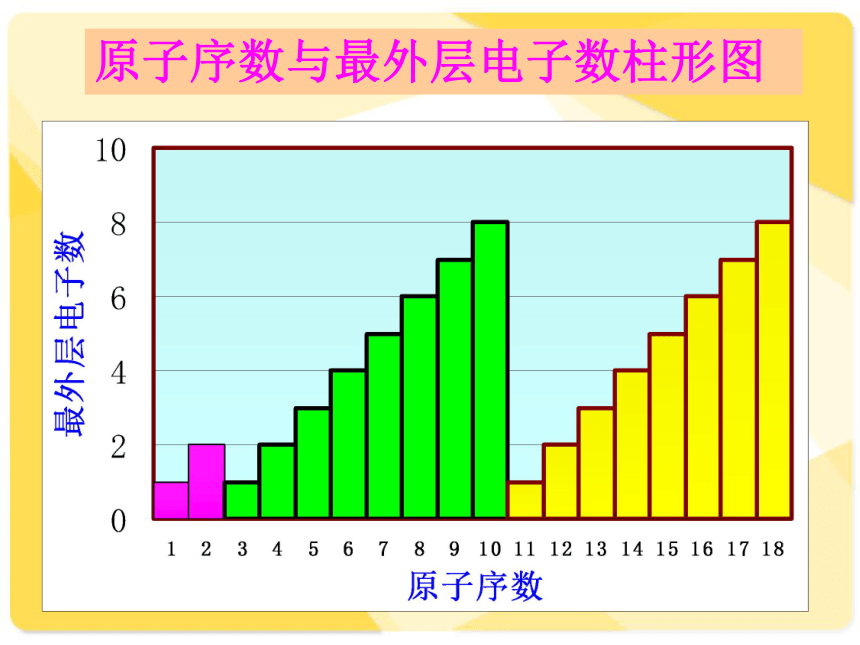
原子序数与最外层电子数柱形图
二、元素化合价规律
1、随原子序数的递增,元素化合价呈现什么规律性的变化?
2、通过观察原子结构示意图我们还可以发现什么规律?
元素主要化合价的周期性变化
三、元素原子半径的周期性变化
元素原子半径的周期性变化
随原子序数的递增,原子半径呈现什么规律性的变化?
比较下列微粒半径的大小
(1)O
和F
(2)Na和Mg
(3)Na+和Mg2+
(4)Cl和F
(5)Na和Na+
(6)Cl和Cl-
(1)同周期,原子序数越大,半径越小。
如
O>F
,
Na>Mg,Na+>Mg2+。
(2)同主族,电子层数越多,半径越大。
如Cl>F。
(3)同种元素的原子半径>阳离子半径。
Na>Na+
(4)同种元素的原子半径<阴离子。如Cl<Cl-。
1.下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层
电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期
性变化
C.随着元素原子序数的递增,元素的最高化
合价从+1到+7,最低化合价从-7到-1
重复出现
D.元素性质的周期性变化仅指原子核外电子
排布的周期性变化、原子半径的周期性变
化及元素主要化合价的周期性变化
B
2.下列各组元素中,按最高正价递增顺序排列的是( )
A.C、N、O、F
B.K、Mg、C、S
C.F、Cl、Br、I
D.Li、Na、K、Rb
3、下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数逐渐增多
B
C
4、X原子获得3个电子或Y原子失去2个电子后形成的离子都与OH-具有相同的电子数,X与Y两单质反应得到的化合物的化学式为( )
A.Y3X2
B.X3Y2
C.X2Y3
D.Y2X3
A
随着原子序数核电荷数递增:
①原子核外电子排布呈周期性变化
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
元素性质的周期性变化的实质是:元素原子的核外电子排布的周期性变化。
元素周期律
随原子序数的递增,原子最外层电子呈现什么规律性的变化?
原子序数与最外层电子数柱形图
二、元素化合价规律
1、随原子序数的递增,元素化合价呈现什么规律性的变化?
2、通过观察原子结构示意图我们还可以发现什么规律?
元素主要化合价的周期性变化
三、元素原子半径的周期性变化
元素原子半径的周期性变化
随原子序数的递增,原子半径呈现什么规律性的变化?
比较下列微粒半径的大小
(1)O
和F
(2)Na和Mg
(3)Na+和Mg2+
(4)Cl和F
(5)Na和Na+
(6)Cl和Cl-
(1)同周期,原子序数越大,半径越小。
如
O>F
,
Na>Mg,Na+>Mg2+。
(2)同主族,电子层数越多,半径越大。
如Cl>F。
(3)同种元素的原子半径>阳离子半径。
Na>Na+
(4)同种元素的原子半径<阴离子。如Cl<Cl-。
1.下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层
电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期
性变化
C.随着元素原子序数的递增,元素的最高化
合价从+1到+7,最低化合价从-7到-1
重复出现
D.元素性质的周期性变化仅指原子核外电子
排布的周期性变化、原子半径的周期性变
化及元素主要化合价的周期性变化
B
2.下列各组元素中,按最高正价递增顺序排列的是( )
A.C、N、O、F
B.K、Mg、C、S
C.F、Cl、Br、I
D.Li、Na、K、Rb
3、下列各组元素性质的递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数逐渐增多
B
C
4、X原子获得3个电子或Y原子失去2个电子后形成的离子都与OH-具有相同的电子数,X与Y两单质反应得到的化合物的化学式为( )
A.Y3X2
B.X3Y2
C.X2Y3
D.Y2X3
A
随着原子序数核电荷数递增:
①原子核外电子排布呈周期性变化
②原子半径呈周期性变化
③元素主要化合价呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
元素性质的周期性变化的实质是:元素原子的核外电子排布的周期性变化。
