高中化学鲁科版 必修2 2.2 化学反应的快慢和限度 课件(19张PPT)
文档属性
| 名称 | 高中化学鲁科版 必修2 2.2 化学反应的快慢和限度 课件(19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
高炉炼铁的主要反应是:
2C(焦炭)+O2(空气)=2CO(放出热量)
Fe2O3+3CO==2Fe+3CO2
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体。
炼铁高炉尾气之谜
什么原因呢?如何改进呢
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体,开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变。
炼铁高炉尾气之谜
课题:
化学反应的限度
在以前的学习中,我们所接触的化学反应一般都进行得很完全。如:
镁条燃烧后只剩白色氧化镁
钠与水反应最终只得到澄清溶液
那么,是不是所有的化学反应都能如上述反应一样,反应物间按照化学方程式中的计量数完全转化为生成物呢?
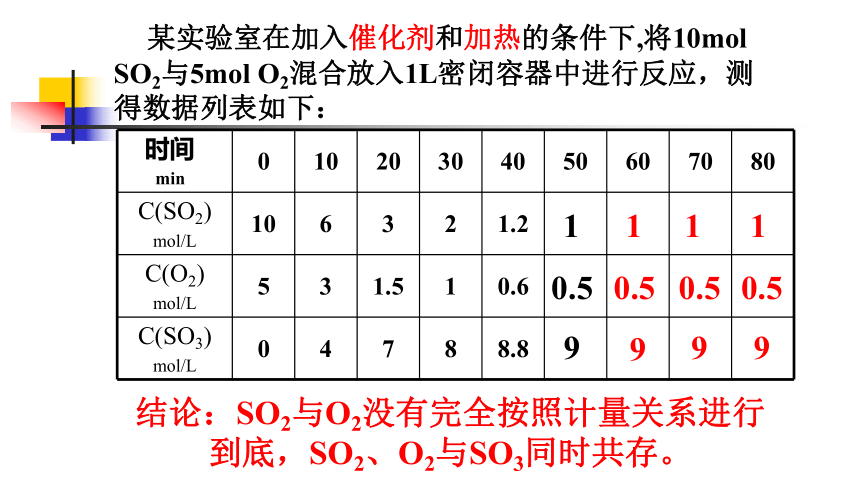
某实验室在加入催化剂和加热的条件下,将10mol
SO2与5mol
O2混合放入1L密闭容器中进行反应,测得数据列表如下:
结论:SO2与O2没有完全按照计量关系进行到底,SO2、O2与SO3同时共存。
时间
min
0
10
20
30
40
50
60
70
80
C(SO2)
mol/L
10
6
3
2
1.2
C(O2)
mol/L
5
3
1.5
1
0.6
C(SO3)
mol/L
0
4
7
8
8.8
SO2
催化剂
加热
催化剂
加热
催化剂
加热
正反应
逆反应
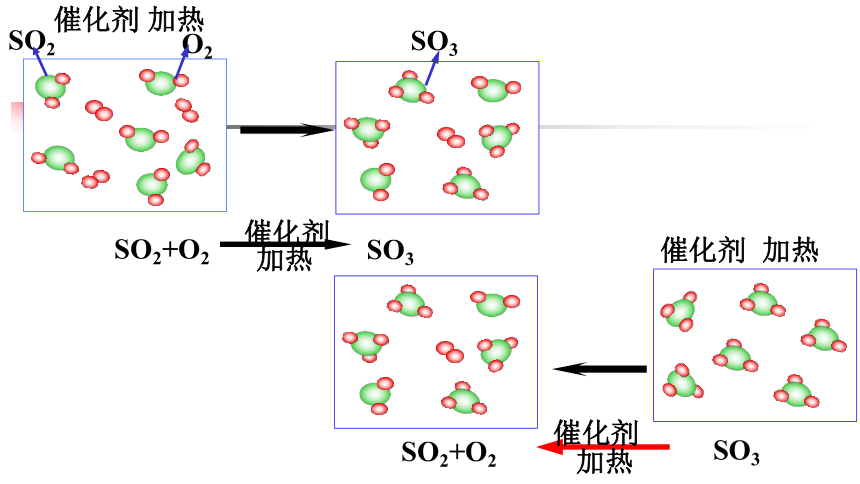
可逆反应
在同一条件下,同时向正、反两个方向进行的反应
两同:同一条件下;正、逆反应同时进行。
特
征
共存:反应不可能进行到底,即反应体系中反应物与生成物共同存在。
注意
:
在表示时,用“
”
小试牛刀:
下列不属于可逆反应的是(
)
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2在一定条件下可以生成NH3,同
时NH3又可以分解为N2和H2
C.电解水生成H2和O2,H2和O2转化成H2O
D.SO2溶于水和H2SO3分解
C
某实验室在加入催化剂和加热的条件下,将10mol
SO2与5mol
O2混合放入1L密闭容器中进行反应,测得数据列表如下:
时间
min
0
10
20
30
40
50
60
70
80
C(SO2)
mol/L
10
6
3
2
1.2
C(O2)
mol/L
5
3
1.5
1
0.6
C(SO3)
mol/L
0
4
7
8
8.8
80
0
10
20
30
40
50
60
70
C/mol/L
t/min
各物质的浓度如何变化?
正逆反应速率如何变化
50—80min
C(SO2)
、C(O2)
、
C(SO3)不再变化
正逆反应仍然在进行
化学平衡状态
正反应速率等于逆反应速率
化学平衡:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
研究对象:可逆反应
正反应速率等于逆反应速率(V正=V逆)
动态平衡
反应物、生成物浓度不再变化(固定)
学生实验
已知:
2NO2
N2O4
实验操作过程:
同时放入到冰水和热水中,观察体系颜色如何变化?
现象:一端颜色变浅,一端颜色加深。
结论:改变条件,改变可逆反应的平衡状态。
化学平衡:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
研究对象:可逆反应
正反应速率等于逆反应速率(V正=V逆)
动态平衡
反应物、生成物浓度不再变化(固定)
条件发生改变,平衡发生改变
N2+3H2
2NH3
反应达到平衡时,下列说法错误的是(
)
A.
N2和H2不再化合了。
B.
N2、NH3的浓度相等。
C.
平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了。
D.
N2、H2、NH3的浓度保持不变。
ABC
练习与活动
小结
化学平衡的概念:
化学平衡的特征:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
逆
等
动
定
变
学以致用
讨论分析解答炼铁高炉尾气之谜
高炉炼铁的主要反应是:
2C(焦炭)+O2(空气)=2CO(放出热量)
Fe2O3+3CO==2Fe+3CO2
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体。
炼铁高炉尾气之谜
什么原因呢?如何改进呢
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体,开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变。
炼铁高炉尾气之谜
课题:
化学反应的限度
在以前的学习中,我们所接触的化学反应一般都进行得很完全。如:
镁条燃烧后只剩白色氧化镁
钠与水反应最终只得到澄清溶液
那么,是不是所有的化学反应都能如上述反应一样,反应物间按照化学方程式中的计量数完全转化为生成物呢?
某实验室在加入催化剂和加热的条件下,将10mol
SO2与5mol
O2混合放入1L密闭容器中进行反应,测得数据列表如下:
结论:SO2与O2没有完全按照计量关系进行到底,SO2、O2与SO3同时共存。
时间
min
0
10
20
30
40
50
60
70
80
C(SO2)
mol/L
10
6
3
2
1.2
C(O2)
mol/L
5
3
1.5
1
0.6
C(SO3)
mol/L
0
4
7
8
8.8
SO2
催化剂
加热
催化剂
加热
催化剂
加热
正反应
逆反应
可逆反应
在同一条件下,同时向正、反两个方向进行的反应
两同:同一条件下;正、逆反应同时进行。
特
征
共存:反应不可能进行到底,即反应体系中反应物与生成物共同存在。
注意
:
在表示时,用“
”
小试牛刀:
下列不属于可逆反应的是(
)
A.氯气与水反应生成盐酸与次氯酸
B.N2与H2在一定条件下可以生成NH3,同
时NH3又可以分解为N2和H2
C.电解水生成H2和O2,H2和O2转化成H2O
D.SO2溶于水和H2SO3分解
C
某实验室在加入催化剂和加热的条件下,将10mol
SO2与5mol
O2混合放入1L密闭容器中进行反应,测得数据列表如下:
时间
min
0
10
20
30
40
50
60
70
80
C(SO2)
mol/L
10
6
3
2
1.2
C(O2)
mol/L
5
3
1.5
1
0.6
C(SO3)
mol/L
0
4
7
8
8.8
80
0
10
20
30
40
50
60
70
C/mol/L
t/min
各物质的浓度如何变化?
正逆反应速率如何变化
50—80min
C(SO2)
、C(O2)
、
C(SO3)不再变化
正逆反应仍然在进行
化学平衡状态
正反应速率等于逆反应速率
化学平衡:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
研究对象:可逆反应
正反应速率等于逆反应速率(V正=V逆)
动态平衡
反应物、生成物浓度不再变化(固定)
学生实验
已知:
2NO2
N2O4
实验操作过程:
同时放入到冰水和热水中,观察体系颜色如何变化?
现象:一端颜色变浅,一端颜色加深。
结论:改变条件,改变可逆反应的平衡状态。
化学平衡:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
研究对象:可逆反应
正反应速率等于逆反应速率(V正=V逆)
动态平衡
反应物、生成物浓度不再变化(固定)
条件发生改变,平衡发生改变
N2+3H2
2NH3
反应达到平衡时,下列说法错误的是(
)
A.
N2和H2不再化合了。
B.
N2、NH3的浓度相等。
C.
平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了。
D.
N2、H2、NH3的浓度保持不变。
ABC
练习与活动
小结
化学平衡的概念:
化学平衡的特征:
指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再变化的状态。
逆
等
动
定
变
学以致用
讨论分析解答炼铁高炉尾气之谜
