高中化学鲁科版 必修2 3.3 饮食中的有机化合物——乙醇(共24张PPT)
文档属性
| 名称 | 高中化学鲁科版 必修2 3.3 饮食中的有机化合物——乙醇(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-29 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
悲时--陆机说:
置酒高堂,悲歌临觞。人寿几何,逝如朝霜。
欢时--李白说:
人生得意须尽欢,莫使金樽空对月。
离时--王维说:
劝君更尽一杯酒,西出阳关无故人。
合时--欧阳修说:
十载相逢酒一卮,故人才见便开颜。
喜时--杜甫说:
白日放歌须纵酒,青春作伴好还乡。
愁时--李白说:
抽刀断水水更流,举杯消愁愁更愁。
丰富多彩的酒文化
第三节
饮食中的有机化合物
第1课时
乙醇
知识竞猜:
下列应用体现了乙醇的哪些性质和用途。
1、用乙醇汽油替代普通汽油-“中国汽车要喝酒”;
2、高烧病人擦拭酒精或白酒降温;
3、碘酒、医用酒精(含乙醇75%);
4、酒精灯和固体酒精
5、洗发时,在水中加入适量的啤酒,洗起来清新爽头,油污一洗即净。
乙醇的用途
乙
醇
饮
料
化工原料
溶
剂
医
药
燃料
活动探究一
通过观察无水乙醇,从颜色、状态、气味、密度、水溶性、熔沸点等方面总结它的物理性质。
(书本76页)
有特殊香味
颜色:
状态:
气味:
密度:
溶解性:
挥发性:
熔沸点:
无色透明
液体
0.789g/cm3(20℃),比水小
沸点是78.5℃,熔点是-117.3℃
能跟水以任意比互溶;
易挥发
乙醇能溶解多种有机物和无机物;
是常用的有机溶剂。
(密封保存!)
思考:如何检验酒精是否含有水?
一
、乙醇的物理性质
用无水CuSO4固体(白色),遇水后变成蓝色。
(乙醇溶液的浓度越大,密度越__)
小
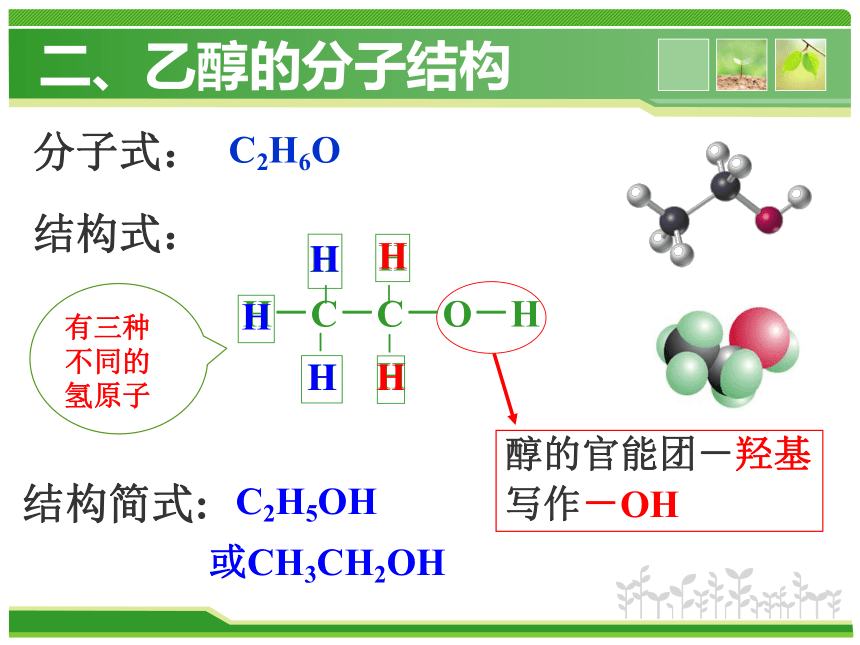
结构式:
H-C-C-O-H
-
H
-
H
-
-
H
H
结构简式:
C2H5OH
或CH3CH2OH
分子式:
C2H6O
醇的官能团-羟基
写作-OH
H
H
H
H
H
有三种不同的
氢原子
二、乙醇的分子结构
氢氧根
羟
基
电子式
电
性
带负电
电中性
稳定性
稳定
不稳定
存
在
能独立存在于溶液或离子化合物中
不能独立存在,必须和其他”基”或原子相结合
官能团:决定有机物化学特性的原子或原子团。如烯烃的碳碳双键、芳香烃的苯环等。
实
验
步
骤
实
验
现
象
1、向两支小试管中各加入1mL的水、无水乙醇;
2、向上述两种试剂中投入同样颗粒大小的金属
钠,观察并记录实验现象。
钠+水
钠+乙醇
活动探究二
钠
与
水
钠
与
乙
醇
浮在水面
?
2Na+2H2O=
2
NaOH
+H2↑
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
剧烈
熔成小球
发出嘶声
放出气泡
缓慢
放出气泡
没有声音
仍为块状
沉在底部
1、对比乙醇与乙烷、与水分子结构的异同点,推测钠与乙醇反应时断裂什么键?放出的气体是什么?
H-O-H
水
[结论]
1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
乙醇
三、乙醇的化学性质
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
[活学活用]其它活泼金属如钾、钙、镁等也可与乙醇反应,均可产生H2
。
1、乙醇与钠的反应
乙醇与钠反应时的断键位置?
(乙醇钠)
—取代反应
2CH3CH2OH+Ca→(CH3CH2O)2Ca+H2↑
三、乙醇的化学性质
精品课件
2CO2
+3H2O
C2H5OH
+
3
O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
2、乙醇的氧化反应
(1)、乙醇燃烧
实验步骤
实验现象
原因或结论
1.取3~4mL无水乙醇于试管中
2.将铜丝在酒精灯外焰上灼烧至红热
铜丝颜色:
3.趁热将铜丝插入乙醇中
铜丝颜色:
4.重复2、3步操作4~5次后闻试管中液体气味
实
验
二
红→黑
黑→红
有刺激性气味
Cu→CuO
CuO→Cu
?
Cu
2CH3CH2OH+O2
2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2
2CuO
催化剂
乙
醛
(2)、乙醇的催化氧化(去氢)
问题思考
1.铜在整个过程中起什么作用?
2.乙醇分子中有哪些化学键断裂?又生成了
哪些化学键?
CuO+
CH3CH2OH
Cu+
CH3CHO+
H2O
2
2
2
2
2
Cu
(2)乙醇催化氧化:
工业上利用此原理生产乙醛
催化剂
?
2CH3CH2OH+O2
2CH3CHO+2H2O
Cu或Ag
C2H6O
C2H4O
在有机化学中常用反应物的得氧或得氢来判断氧化还原反应。
有机物得氢或失氧的反应叫做还原反应。
有机物得氧或失氢的反应叫做氧化反应;
CH2=
CH2+H2
CH3-CH3
一定条件
思考:
乙醇能使酸性KMnO4溶液褪色吗?
利用乙醇能被强氧化剂氧化这性质,可作为判断酒后驾车的方法。
三氧化铬
硫酸铬
反应原理:
3C2H5OH+2CrO3+3H2SO4→3CH3CHO
+
Cr2
(
SO4
)3
+6H2O
了解酒对人体的影响:
如果在短时间内饮用大量酒,开始酒精会像轻度镇静剂一样,使人兴奋、减轻抑郁程度,因为酒精压抑了某些大脑中枢的活动,这些中枢在平时对极兴奋行为起抑制作用。这个阶段不会维持很久,接下来,大部分人会变得安静、忧郁、恍惚、直到不省人事,严重时甚至会因心脏被麻醉或呼吸中枢失去功能而造成窒息死亡。
小
结
2CO2
+3H2O
点燃
Cu
物理
性质:
无色、透明,具有特殊香味的液体,密度小于水,沸点低于水,易挥发,可做溶剂。
化学性质:
与金属
反应:
氧化
反应:
2CH3CH2OH+O2
2CH3CHO+2H2O
C2H5
OH
+
3
O2
2C2H5OH
+
2Na
2CH3CH2ONa
+
H2
结构式:
C—C—O—H
H
H
H
H
H
乙醇
分子式:
C2H6O
△
1、能证明乙醇分子中有一个羟基的是(
)
A、乙醇完全燃烧生成CO2和H2O
B、乙醇能与水以任意比混溶
C、0.1
mol乙醇与足量钠反应只能生成0.05
mol氢气
D、乙醇在铜催化下可被氧化
C
2、乙醇分子中不同的化学键如下图:
当乙醇与钠反应时,
键
断裂;当乙醇与氧气反应
(Cu作催化剂)时,
键断裂。
④
②
①
③
①
①③
3、把质量为mg的铜丝灼烧变黑,立即趁热放入下列物质中,能使铜丝变红,而且质量仍为mg的是(
)
A、稀硫酸
B、酒
精
C、稀硝酸
D、CO
BD
4、等物质的量的下列有机物完全燃烧,消耗氧气最多的是(
)
A、C2H6
B、C2H4
C、C2H2
D、C2H5OH
A
5、A、B、C
三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则
A、B、C
三种醇分子中羟基数之比是
(
)
A、3:2:1
B、2:6:3
C、3:6:2
D、2:1:3
D
Thank
You!
练习写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
(CH3)3CCH2OH
醇氧化机理:
①-③位断键
①
③
R2—C—O—H
R1
H
+
O2
2
生成醛或酮
+
2H2
O
—C=O
R1
R2
2
Cu
△
原理
②
悲时--陆机说:
置酒高堂,悲歌临觞。人寿几何,逝如朝霜。
欢时--李白说:
人生得意须尽欢,莫使金樽空对月。
离时--王维说:
劝君更尽一杯酒,西出阳关无故人。
合时--欧阳修说:
十载相逢酒一卮,故人才见便开颜。
喜时--杜甫说:
白日放歌须纵酒,青春作伴好还乡。
愁时--李白说:
抽刀断水水更流,举杯消愁愁更愁。
丰富多彩的酒文化
第三节
饮食中的有机化合物
第1课时
乙醇
知识竞猜:
下列应用体现了乙醇的哪些性质和用途。
1、用乙醇汽油替代普通汽油-“中国汽车要喝酒”;
2、高烧病人擦拭酒精或白酒降温;
3、碘酒、医用酒精(含乙醇75%);
4、酒精灯和固体酒精
5、洗发时,在水中加入适量的啤酒,洗起来清新爽头,油污一洗即净。
乙醇的用途
乙
醇
饮
料
化工原料
溶
剂
医
药
燃料
活动探究一
通过观察无水乙醇,从颜色、状态、气味、密度、水溶性、熔沸点等方面总结它的物理性质。
(书本76页)
有特殊香味
颜色:
状态:
气味:
密度:
溶解性:
挥发性:
熔沸点:
无色透明
液体
0.789g/cm3(20℃),比水小
沸点是78.5℃,熔点是-117.3℃
能跟水以任意比互溶;
易挥发
乙醇能溶解多种有机物和无机物;
是常用的有机溶剂。
(密封保存!)
思考:如何检验酒精是否含有水?
一
、乙醇的物理性质
用无水CuSO4固体(白色),遇水后变成蓝色。
(乙醇溶液的浓度越大,密度越__)
小
结构式:
H-C-C-O-H
-
H
-
H
-
-
H
H
结构简式:
C2H5OH
或CH3CH2OH
分子式:
C2H6O
醇的官能团-羟基
写作-OH
H
H
H
H
H
有三种不同的
氢原子
二、乙醇的分子结构
氢氧根
羟
基
电子式
电
性
带负电
电中性
稳定性
稳定
不稳定
存
在
能独立存在于溶液或离子化合物中
不能独立存在,必须和其他”基”或原子相结合
官能团:决定有机物化学特性的原子或原子团。如烯烃的碳碳双键、芳香烃的苯环等。
实
验
步
骤
实
验
现
象
1、向两支小试管中各加入1mL的水、无水乙醇;
2、向上述两种试剂中投入同样颗粒大小的金属
钠,观察并记录实验现象。
钠+水
钠+乙醇
活动探究二
钠
与
水
钠
与
乙
醇
浮在水面
?
2Na+2H2O=
2
NaOH
+H2↑
钠是否浮在液面上
钠的形状是否变化
有无声音
有无气泡
剧烈程度
反应方程式
剧烈
熔成小球
发出嘶声
放出气泡
缓慢
放出气泡
没有声音
仍为块状
沉在底部
1、对比乙醇与乙烷、与水分子结构的异同点,推测钠与乙醇反应时断裂什么键?放出的气体是什么?
H-O-H
水
[结论]
1、羟基决定乙醇能和钠反应生成氢气
2、羟基中的H原子的活泼性:醇<水
乙醇
三、乙醇的化学性质
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
[活学活用]其它活泼金属如钾、钙、镁等也可与乙醇反应,均可产生H2
。
1、乙醇与钠的反应
乙醇与钠反应时的断键位置?
(乙醇钠)
—取代反应
2CH3CH2OH+Ca→(CH3CH2O)2Ca+H2↑
三、乙醇的化学性质
精品课件
2CO2
+3H2O
C2H5OH
+
3
O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
2、乙醇的氧化反应
(1)、乙醇燃烧
实验步骤
实验现象
原因或结论
1.取3~4mL无水乙醇于试管中
2.将铜丝在酒精灯外焰上灼烧至红热
铜丝颜色:
3.趁热将铜丝插入乙醇中
铜丝颜色:
4.重复2、3步操作4~5次后闻试管中液体气味
实
验
二
红→黑
黑→红
有刺激性气味
Cu→CuO
CuO→Cu
?
Cu
2CH3CH2OH+O2
2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2
2CuO
催化剂
乙
醛
(2)、乙醇的催化氧化(去氢)
问题思考
1.铜在整个过程中起什么作用?
2.乙醇分子中有哪些化学键断裂?又生成了
哪些化学键?
CuO+
CH3CH2OH
Cu+
CH3CHO+
H2O
2
2
2
2
2
Cu
(2)乙醇催化氧化:
工业上利用此原理生产乙醛
催化剂
?
2CH3CH2OH+O2
2CH3CHO+2H2O
Cu或Ag
C2H6O
C2H4O
在有机化学中常用反应物的得氧或得氢来判断氧化还原反应。
有机物得氢或失氧的反应叫做还原反应。
有机物得氧或失氢的反应叫做氧化反应;
CH2=
CH2+H2
CH3-CH3
一定条件
思考:
乙醇能使酸性KMnO4溶液褪色吗?
利用乙醇能被强氧化剂氧化这性质,可作为判断酒后驾车的方法。
三氧化铬
硫酸铬
反应原理:
3C2H5OH+2CrO3+3H2SO4→3CH3CHO
+
Cr2
(
SO4
)3
+6H2O
了解酒对人体的影响:
如果在短时间内饮用大量酒,开始酒精会像轻度镇静剂一样,使人兴奋、减轻抑郁程度,因为酒精压抑了某些大脑中枢的活动,这些中枢在平时对极兴奋行为起抑制作用。这个阶段不会维持很久,接下来,大部分人会变得安静、忧郁、恍惚、直到不省人事,严重时甚至会因心脏被麻醉或呼吸中枢失去功能而造成窒息死亡。
小
结
2CO2
+3H2O
点燃
Cu
物理
性质:
无色、透明,具有特殊香味的液体,密度小于水,沸点低于水,易挥发,可做溶剂。
化学性质:
与金属
反应:
氧化
反应:
2CH3CH2OH+O2
2CH3CHO+2H2O
C2H5
OH
+
3
O2
2C2H5OH
+
2Na
2CH3CH2ONa
+
H2
结构式:
C—C—O—H
H
H
H
H
H
乙醇
分子式:
C2H6O
△
1、能证明乙醇分子中有一个羟基的是(
)
A、乙醇完全燃烧生成CO2和H2O
B、乙醇能与水以任意比混溶
C、0.1
mol乙醇与足量钠反应只能生成0.05
mol氢气
D、乙醇在铜催化下可被氧化
C
2、乙醇分子中不同的化学键如下图:
当乙醇与钠反应时,
键
断裂;当乙醇与氧气反应
(Cu作催化剂)时,
键断裂。
④
②
①
③
①
①③
3、把质量为mg的铜丝灼烧变黑,立即趁热放入下列物质中,能使铜丝变红,而且质量仍为mg的是(
)
A、稀硫酸
B、酒
精
C、稀硝酸
D、CO
BD
4、等物质的量的下列有机物完全燃烧,消耗氧气最多的是(
)
A、C2H6
B、C2H4
C、C2H2
D、C2H5OH
A
5、A、B、C
三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则
A、B、C
三种醇分子中羟基数之比是
(
)
A、3:2:1
B、2:6:3
C、3:6:2
D、2:1:3
D
Thank
You!
练习写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
(CH3)3CCH2OH
醇氧化机理:
①-③位断键
①
③
R2—C—O—H
R1
H
+
O2
2
生成醛或酮
+
2H2
O
—C=O
R1
R2
2
Cu
△
原理
②
