元素符号表示的量(共3课时)
图片预览









文档简介
(共52张PPT)
第 7 节
第一课时
浙江省台州初级中学
徐中勇
2009年2月
课时分配:3课时
第1课时:相对原子质量
第2课时:相对分子质量、元素质量分数和质量比的确定
第3课:测定硫酸铜晶体中结晶水的含量(学生实验)
教学目标剖析:
【认知目标:】
1、知道相对原子质量是一个相对量,而不是原子的实际质量。
2、知道相对原子质量是一个比值。
3、知道相对分子质量、元素质量分数和物质中各元素质量比的涵义。
4、知道在一定条件下,分解物质是分析物质组成的一种方法。
5、了解硫酸铜晶体中结晶水的含量是一定的,从而加深对硫酸铜晶体是纯净物的认识。
【能力目标:】
1、会查阅相对原子质量表。能说出相对原子质量、质子数、中子数之间的数值关系。
2、练习借助数据表获得信息的方法。
3、能根据化学式计算物质的相对分子质量;能根据化学式计算元素含量、所含元素质量比。
4、能看懂某些商品标签或说明书上标出的物质成分和含量。
5、学会在坩埚里灼烧物质的实验方法,提高实验观察和分析能力。
6、能初步进行实验误差存在可能原因的分析。
【情感和价值观目标:】
1、了解张青莲教授在测定相对原子质量方面作出的突出贡献,激发学生的爱国主义情感和对科学研究的兴趣。
2、体验相对分子质量、根据化学式计算元素含量和物质中所含元素质量比的计算的成功乐趣。
3、实事求是的科学态度对待实验,逐步养成能客观分析失败原因的学习习惯。
教学重难点:
重点:相对原子质量。相对分子质量、根据化学式计算元素含量和物质中所含元素质量比的计算。实验仪器的规范操作和实验数据的分析。
难点:相对原子质量。根据化学式计算元素含量、物质中所含元素质量比的规范解题格式。实验仪器的规范操作和实验数据的分析
本节内容的课程标准描述:
●会查阅相对原子质量表。能根据化学式计算物质的相对分子质量。
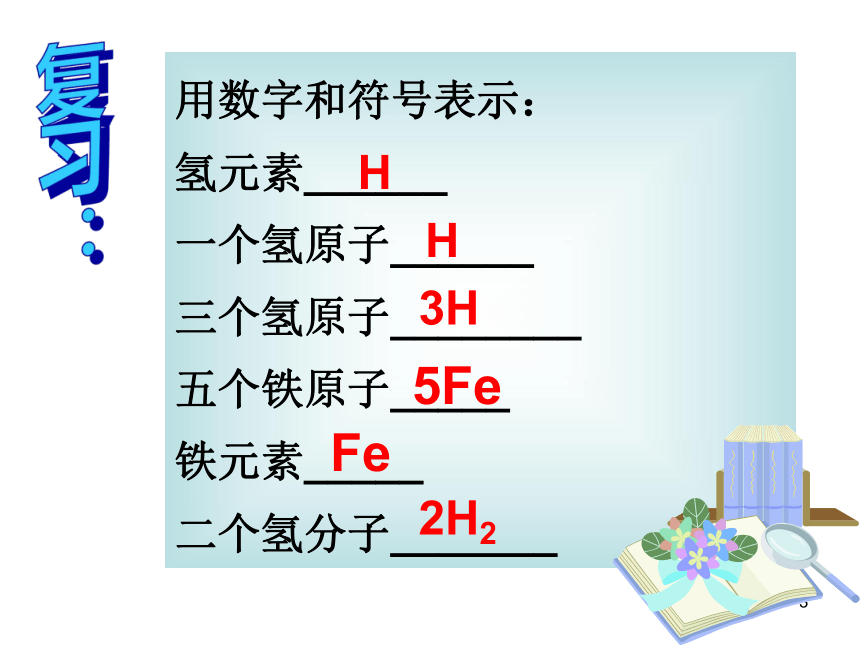
用数字和符号表示:
氢元素______
一个氢原子______
三个氢原子________
五个铁原子_____
铁元素_____
二个氢分子_______
H
H
3H
5Fe
Fe
2H2
1.993×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001993千克
一个氢原子的质量:
1.674×10-27 千克
你能算出一个甲烷分子的质量是多少吗?
一个氧原子的质量:
2.657×10-26 千克
一个二氧化碳分子的质量是多少?
看到 “ C”能想到什么?
12
6
谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
国际上规定:采用相对原子质量来表示原子的质量关系。
一、相对原子质量
探讨:如何求相对原子质量?
碳原子
碳原子的1/12
1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克
2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。
=
某原子的质量
一个碳12原子的质量
×12
相对原子质量
2.657×10-26千克
氧的相对原子质量=
氢的相对原子质量=
碳的相对原子质量=
1.661×10-27千克
1.674×10-27千克
=16
1.661×10-27千克
1.993×10-26千克
=1
1.661×10-27千克
=12
求出氧、氢、碳的相对原子质量
C—12原子的质量分为12等份,即一份为1.661×10 千克
-27
我们要用到某原子的相对质量,是否都需要进行计算?
1、从元素周期表(附录5)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cu__________
40
27
35.5
108
1
12
16
64
元素周期表
相对原子质量表
1、相对原子质量最小的是什么原子?
H
2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?
不是,但能体现实际质量。相对原子质量越大,原子的实际质量越大。
3、相对原子质量与原子的实际质量相比,有什么优点?
数值比较简单,便于书写、运算、记忆。
4、相对原子质量有没有单位?
相对原子质量不是原子的真实质量,而是一个比值,没有单位。计算采用相对原子质量的近似值。
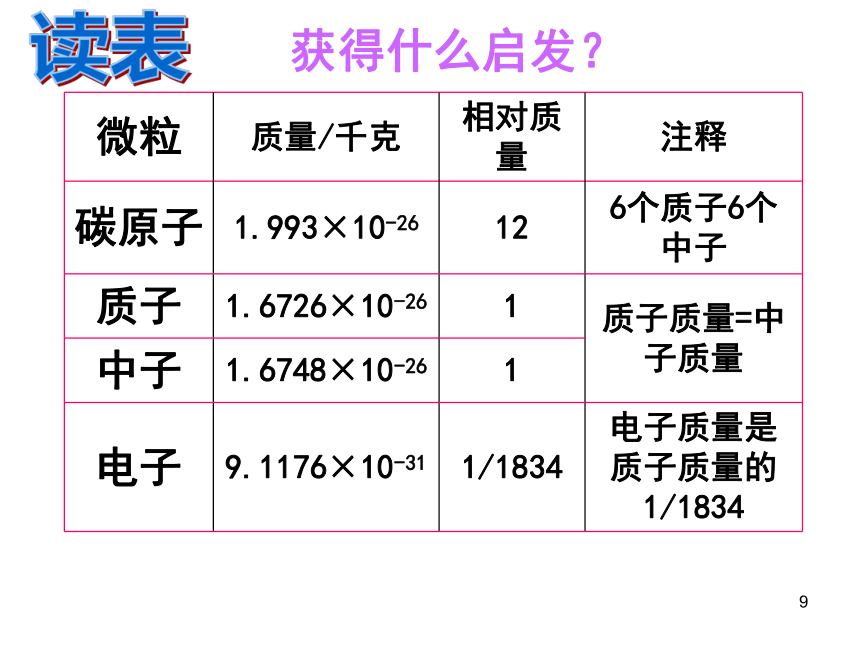
获得什么启发?
微粒 质量/千克 相对质量 注释
碳原子 1.993×10-26 12 6个质子6个中子
质子 1.6726×10-26 1 质子质量=中子质量
中子 1.6748×10-26 1
电子 9.1176×10-31 1/1834 电子质量是质子质量的1/1834
m质子 + m中子 = m原子
(3)m质子 = m中子= C-12原子质量的1/12
(1)电子的质量相对于原子质量来说很小
(4)一个质子和中子的相对质量是 1
(5)相对原子质量 = 质子数 + 中子数
归纳:
(2)原子几乎全部的质量都集中在原子核上
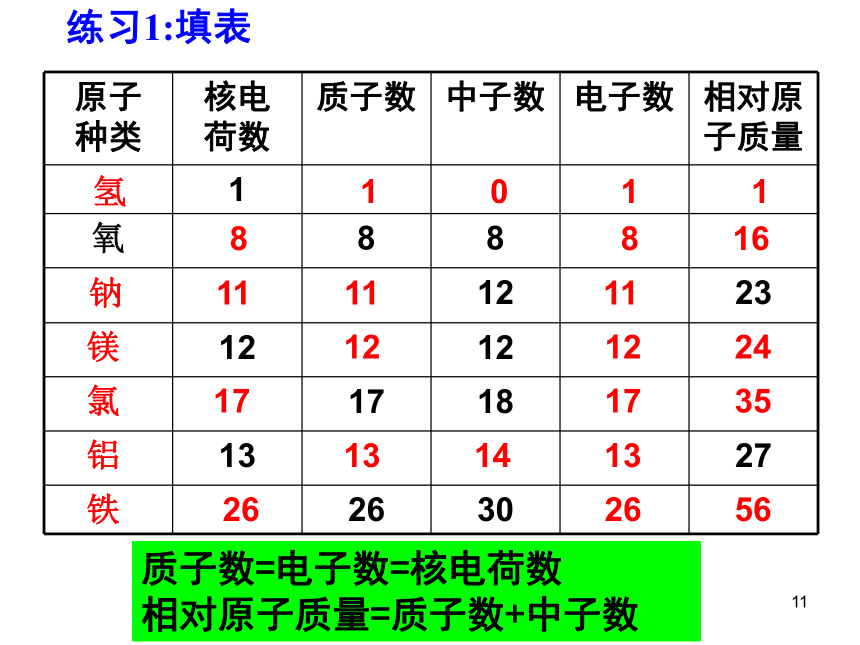
原子 种类 核电 荷数 质子数 中子数 电子数 相对原子质量
1
氧 8 8
12 23
12 12
17 18
13 27
26 30
氢 1 0 1 1
8 8 16
钠 11 11 11
镁 12 12 24
氯 17 17 35
铝 13 14 13
铁 26 26 56
练习1:填表
质子数=电子数=核电荷数 相对原子质量=质子数+中子数
1.如果碳-12原子的质量为M千克,X原子的质量为N千克,则X原子的相对原子质量为( )
M/12N B. 12M/N C. N/12M D.12N/M
变式1:已知1个碳-12原子的质量为m千克,某元素的1个原子的质量8m千克,则该元素的相对原子质量_____.
96
D
变式2:甲原子与乙原子的质量之比为x:y,而乙原子与12C原子的质量之比为n:m,则甲原子的相对原子质量为_______.
第二课时
浙江省台州初级中学
徐中勇
2009年2月
相对分子质量:一个分子中各原子的相对原子质量总和 .
二、相对分子质量(式量)
原子质量可以用相对质量表示,分子质量也可以用相对分子质量表示。
即:相对原子质量×原子个数之和
求二氧化碳、硫酸的相对分子质量
步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和 注意:若分子式中有括号,计算相对分子质量应带括号运算。
求二氧化碳、硫酸的相对分子质量
CO2(二氧化碳分子)的相对分子质量:
M=12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
M=1×2 + 32 + 16×4 = 98
Ca(OH)2
求:氢氧化钙的相对分子质量
M=40+(16+1)×2=40+34=74
求:CuSO4.5H2O的相对分子质量
M=64+32+16×4+5×(1×2+16)=250
已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24
求出下列相对分子质量:
CH4_____ Ca(OH)2_____
(NH4)2SO4______ 3H2O_____ 4CO2_____ 5Mg(OH)2_____
16
74
132
54
176
290
相对原子质量和相对分子质量有没有单位?
什么物质的相对分子质量最小?
H2
没有单位
化学式表示什么?
(1)
(2)
(3)
(4)
(5)
CO2
(1)表示该种物质(二氧化碳气体)
(2)表示该物质的一个分子的构成(一个CO2分子由一个碳原子和二个氧原子构成)
(3)表示这种物质的组成(二氧化碳由碳元素和氧元素组成)
(4)表示该物质的一个分子(一个二氧化碳分子)
(5)表示构成该物质一个分子的原子种类
(6)表示该物质的相对分子质量
1、某原子核内有n个中子,相对原子质量是N,该原子的核电荷数是________,原子核外的电子数是______.
2、制造原子弹的原料为铀-235,这种铀原子的相对原子质量为_____,若其核电荷数为92,则其核内的中子数为_____,质子数为_____,核外电子数为______.
N-n
N-n
92
92
143
235
练习:
甲原子质量
乙原子质量
甲相对原子质量
乙相对原子质量
=
3、已知氧和硫的相对原子质量分别为16和32,则一个氧原子和一个硫原子的质量比为 。
4、变题:铁与镁的质量比为M:N,则两种物
质中铁原子和镁原子的个数比为 。
3M/7N
练习:
5、已知元素A和B的化合价分别是+3和-2,相对原子质量分别是56和16,则两种元素组成的化合物的相对分子质量为多少?
6、变化题:某化合物(HnRO2n)的相对分子质量是M,则:元素R的化合价是________,R的相对原子质量是_________;
练习:
(1)计算二氧化碳中各元素的质量比。
(2)计算硫酸铵[(NH4 ) 2SO4)]中各元素的质量比。
(3)计算碳酸氢铵(NH4HCO3)中各元素的质量比。
第 7 节
元素质量分数和质量比的确定
第三课时
浙江省台州初级中学
徐中勇
2009年2月
=
某原子的质量
一个碳12原子的质量
×12
1、相对原子质量
一、知识回顾!
2、相对分子质量(式量)
相对分子质量:一个分子中各原子的 相对原子质量总和
3、原子个数的计算
4、原分子个数的计算
原子个数
原子的总质量
相对原子质量
=
分子个数
物质的总质量
相对分子质量
=
二、课前热身!
1、写出下列物质(或微粒)的化学式并计算它的相对分子质量。
SO2
64
Na2CO3
106
FeCl3
162.5
4CO2
176
氯化铁( )
碳酸钠( )
二氧化硫( )
4个二氧化碳分子( )
你能求出水中氢元素和氧元素的质量比吗
解:水的化学式:H2O
1、根据化学式计算组成物质的各元素的质量比
mH:mO=(1×2):16=1:8
如:化合物AxBy
A、B元素质量比=(a×x):(b×y)
注意:ab是相对原子质量;xy是原子个数
(1)计算二氧化碳中各元素的质量比。
(2)计算硝酸铵中各元素的质量比。
CO2
NH4NO3
特别提醒:(1)规范解题格式
(2)看清题中所求各元素的顺序
解:mN:mH:mO=(14×2):(1×4):(16×3)=28:4:48=7:1:12
你能算出水中氢元素的质量分数吗
氢元素的相对原子质量(总)
水的相对分子质量
=
2H
H2O
=
2×1
18
=
11.1%(或0.11)
水中氧元素的质量分数是多少
2、根据化学式,计算物质中某一元素的质量分数。
O%=1-H%
解:水中氢元素质量分数H% =
2、计算碳酸氢铵中各元素的质量比
氢元素的质量分数
氮元素的质量分数
NH4HCO3
练一练:
变化题:某厂生产碳酸氢氨(NH4HCO3)化肥,打出“本厂生产的碳酸氢氨,属国际首创,含氮量全球最高,达到20.1%的广告”,试通过计算说明该广告的真实性
X100%
2、A的质量分数=—————————
A的相对原子质量×m
AmBn的相对分子质量
1、计算NH4NO3中氮元素的质量分数
14×2
14×2+1×4+16×3
×100%
=
×100%
N×2
NH4NO3
=
解:N%
(1)硫酸铵的相对分子质量。
(2)硫酸铵中氢元素的质量分数.
(3)66克硫酸铵中含氮元素的质量.
(4)多少克硫酸铵中含氮元素质量为28克
(5)多少克硫酸铵中含氮元素质量与60克尿素[ CO(NH2)2 ]所含氮的质量相等
(NH4)2SO4
3、有关不纯物质的计算
元素的质量
不纯物质质量
×
=
该物质的质量分数
×
纯物质中该元素的质量分数
1:现有含氧化铁80%的铁矿石500吨,问最多可冶炼出铁多少吨?
2:世界卫生组织把铝列为污染源之一,成人每天摄入铝元素的质量控制在0.004g以下.油条是中国北方常用的食品之一,每270g油条中含有0.9g明矾,它的化学式是KAl(SO4)2.12H2O,求:(1)明矾的相对分子质量 (2)明矾中硫、氢、氧元素的质量比?(3)如果一个成人每天食用142.2g油条,铝的摄入量是否超标 (4)在日常生活中你该如何做
练一练:
1、经检测一份尿样中含尿素CO(NH2)2 的质量分数为2%,假定其他成分不含氮,求:此尿样中氮元素的质量分数?
2、某尿样中含氮的质量分数为0.91%,如果这些氮存在于尿素中,则尿中尿素的质量分数?
3、在CO与X的混合气体中,氧元素的质量分数是58%,则:X可能是( )
A、CO2 B、N2 C、NO D、SO2
A
1、氮肥是含有氮元素的物质,经测定某种硝酸铵(NH4NO3)化肥中氮元素质量分数是38.4%,则:该硝酸铵化肥中可能含有下列哪种物质( )
A、NH4HCO3
C、CO(NH2)2
B、(NH4)2SO4
C
第 7 节
第四课时
浙江省台州初级中学
徐中勇
2009年2月
分子式的涵义(以H2SO4例)
质的含义
量的含义
①物质
②分子
③构成
元素
④组成
原子
⑤构成
⑴该分子的相对分子质量
⑵该物质的各元素质量比
⑶该物质中某元素的质量分数
计算关系式(以化合物AmBn为例)
⑴相对分子质量=A的相对原子质量×m+B的相对原子质量×n
X100%
(3)A的质量分数=—————————
A的相对原子质量×m
AmBn的相对分子质量
(2)AB元素质量比=A的相对原子质量×m:B的相对原子质量×n
计算CuSO4·5H2O的式量
解:CuSO4·5H2O式量=64+32+16×4+(1×2+16)×5=250
计算NH4NO3中所含各元素的质量比
解:mN:mH:mO=(14×2):(1×4):(16×3)=28:4:48=7:1:12
=35%
计算NH4NO3中氮元素的质量分数
14×2
14×2+1×4+16×3
×100%
=
×100%
N×2
NH4NO3
=
解:N%
1.足球烯“C60”的相对分子质量为 ,“60”的意义是 ,这种物质是由 组成,由 构成,“C60”分子又是由 构成,它在分类上属于 . (填“混合物.化合物.单质”),它与金刚石.石墨化学性质相似,但物理性质差别很大的原因是 .
2.某种藻类的分子式为C106H263O110N16P,问该藻类由 种元素组成,各元素的质量比为 ,相对分子质量为 ,碳元素的质量分数为 ,该藻类分子由 种原子构成,原子总数 个,各原子的个数比为 .
5
1272:263:1760:224:31
3550
35.8%
5
496
106:263:110:16:1
(4)A元素质量=化合物AmBn的质量× A的质量分数
(5)化合物AmBn的质量=——————————
A(或B)的质量分数
A(或B)元素质量
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A.3.80g B.6.95g C.10g D.3.04g
多少克的硝酸铵与474克的碳铵的含氮量相等?
x×28/80 == 474×14/79
X == 240克
== 474×————
x×————
2N
NH4NO3
N
NH4HCO3
解:
(6)混合物中某元素的实际质量分数
=纯净物中这种元素的质量分数×纯度
杂质不含这种元素
2、有一不纯尿素[CO(NH2)2]样品,测知含氮元素44.8%,若已知杂质不含氮元素,此化肥的有效成分尿素的质量分数为__________。
96%
1、某黄铁矿中含FeS2为72%,计算该黄铁矿中硫元素的质量分数( )(已知杂质不含铁元素) A.36% B.38.4% C.42.6% D.48%
B
1.血红蛋白是一个大分子,它的相对分子质量是68000,已知其中铁元素的质量分数为0.33%,则每个血红蛋白分子中含铁原子的个数是( )
A.2 B.3 C.4 D.5
2.医药上的阿司匹林的式量为180,其中含4.5%的氢.35.5%氧.60%碳(以上均为质量分数),则阿司匹林的化学式是 .(从左到右按C.H.O顺序)
(7)由元素的质量分数倒求化学式
1.在公共场所有广告如下:
请回答下列问题:
(1)该化肥中所含的植物营养元素是______,
(2)证明该化肥是氮肥的实验步骤是_______,
(3)NH4HCO3中氮元素的质量分数是 ,
该广告宣称其含氮量是 ,因此这是一
则 .(填“真实或虚假”)广告。
化肥广告
———国 际 首 创————
优质化肥:碳酸氢铵 (NH4HCO3)
含氮量全球最高:(24.1%)
根据包装袋或产品说明书标示的元素含量推算它的纯度
2.此表是某“加碘食盐”包装袋上的部分文字说明.根据此表,结合所学知识,回答下列问题。
(1)碘元素的化合价 。
(2)从2000年10月1日起,我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐含碘酸钾 g(结果保留到0.001g)
(3)若成人每天食用7g碘盐,从中摄取0.15mg碘,那么1kg碘盐中含碘多少毫克?
配料表 精制海盐、碘酸钾
含碘量/Kg 20g~40g
分装日期 见封底
储藏方法 密封、避光、防潮
使用方法 烹调时,待食品熟后加入碘盐
+5
0.059
4.香烟燃烧发生复杂的物理化学变化。产生的烟气中含有四百多种致癌物质10多种会促进癌发展的物质,其中对人体危害最大的是烟碱(尼古丁).焦油.氰化物等。尼古丁的化学
_________.氮元素的质量分数为_______
结构式如右图,它的化学式是
解:碳铵中氮元素的质量分数为14/79×100%=17.7%
尿素中氮元素的质量分数为:28/60×100%=46.7%。
则100元钱买得的氮肥中氮元素的质量分别为:
碳铵.100/0.54×17.7%=32.8千克
尿素.100/1.25×46.7%=37.4千克
3.商店中有碳铵(NH4HCO3).尿素[CO(NH2)2]两种氮肥,标价为:碳铵0.54元/千克,尿素1.25元/千克。赵大伯要用100元钱买氮肥,试通过计算论证理论上赵大伯买哪种氮肥合算?
C10H14N2
17.3%
5:某市场中硫酸铵和尿素两种化肥,每千克的售价分别为1.3元和1.8元,根据它们所含氮的比例分析,买哪种化肥更经济?
比较哪种化肥更经济实际比较:价格/ 氮元素质量,其比值越小的更经济;或计算出:氮元素质量/价格,其比值越大的更经济.
1、相同质量的SO2和SO3中,氧元素的质量比是________.
四、其它题型:
5:6
2、相同质量的CO和CO2中,氧元素的质量比是________.
11:14
3.某氧化物的化学式为NxOy ,其中氮元素和氧元素的质量比为7:4,此氧化物化学式中X与Y的比为_____,此化学式是________。(N-14 O-16)
4、某碳氢化合物中,碳元素与氢元素的质量比为3:1,则其化学式中碳原子与氢原子的个数比是_________,此化学式是________。(C-12 H-1)
2:1
N2O
1:4
CH4
5、常温下,乙烷(C2H6)气体和酒精(C2H6O)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数是( )
(C-12 H-1 O-16)
解析 混合物中,O%=a%则C、H%=(100—a)%,
由化学式C2H6、C2H6O可知混合物中
碳、氢元素的质量之比等于4:1,
所以C%= %
7、苏丹红1号(C16H12N2O)是一种红色染料,具有至癌性,禁止食用,几个同学展开如下讨论:①苏丹红1号的相对分子质量是248克②苏丹红1号分子有4种原子③苏丹红1号分子由碳、氢、氧、氮四种元素组成④苏丹红1号由分子构成⑤苏丹红1号分子中碳、氢、氧、氮原子的个数比是16:12:2:1⑥苏丹红1号分子由16个碳原子、12个氢原子、1个氧原子、2个氮原子构成⑦苏丹红1号是一种混合物⑧苏丹红1号是氧化物;其中不正确的有——————————。
135678
8.为满足生产需要,要使每公顷地增加2 kg的氮元素,问在50公顷地上应施加硝酸铵肥料多少千克 若改施碳酸氢铵(NH4HCO3),问需碳酸氢铵肥料多少千克
9.经分析测得在2.5克的某铜矿中含有0.5克氧化铜,计算在这种铜矿中含铜元素的质量分数?
(Cu-64 O-16)
(N-14 H-1 C-12 O-16)
第 7 节
第一课时
浙江省台州初级中学
徐中勇
2009年2月
课时分配:3课时
第1课时:相对原子质量
第2课时:相对分子质量、元素质量分数和质量比的确定
第3课:测定硫酸铜晶体中结晶水的含量(学生实验)
教学目标剖析:
【认知目标:】
1、知道相对原子质量是一个相对量,而不是原子的实际质量。
2、知道相对原子质量是一个比值。
3、知道相对分子质量、元素质量分数和物质中各元素质量比的涵义。
4、知道在一定条件下,分解物质是分析物质组成的一种方法。
5、了解硫酸铜晶体中结晶水的含量是一定的,从而加深对硫酸铜晶体是纯净物的认识。
【能力目标:】
1、会查阅相对原子质量表。能说出相对原子质量、质子数、中子数之间的数值关系。
2、练习借助数据表获得信息的方法。
3、能根据化学式计算物质的相对分子质量;能根据化学式计算元素含量、所含元素质量比。
4、能看懂某些商品标签或说明书上标出的物质成分和含量。
5、学会在坩埚里灼烧物质的实验方法,提高实验观察和分析能力。
6、能初步进行实验误差存在可能原因的分析。
【情感和价值观目标:】
1、了解张青莲教授在测定相对原子质量方面作出的突出贡献,激发学生的爱国主义情感和对科学研究的兴趣。
2、体验相对分子质量、根据化学式计算元素含量和物质中所含元素质量比的计算的成功乐趣。
3、实事求是的科学态度对待实验,逐步养成能客观分析失败原因的学习习惯。
教学重难点:
重点:相对原子质量。相对分子质量、根据化学式计算元素含量和物质中所含元素质量比的计算。实验仪器的规范操作和实验数据的分析。
难点:相对原子质量。根据化学式计算元素含量、物质中所含元素质量比的规范解题格式。实验仪器的规范操作和实验数据的分析
本节内容的课程标准描述:
●会查阅相对原子质量表。能根据化学式计算物质的相对分子质量。
用数字和符号表示:
氢元素______
一个氢原子______
三个氢原子________
五个铁原子_____
铁元素_____
二个氢分子_______
H
H
3H
5Fe
Fe
2H2
1.993×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001993千克
一个氢原子的质量:
1.674×10-27 千克
你能算出一个甲烷分子的质量是多少吗?
一个氧原子的质量:
2.657×10-26 千克
一个二氧化碳分子的质量是多少?
看到 “ C”能想到什么?
12
6
谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
国际上规定:采用相对原子质量来表示原子的质量关系。
一、相对原子质量
探讨:如何求相对原子质量?
碳原子
碳原子的1/12
1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克
2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。
=
某原子的质量
一个碳12原子的质量
×12
相对原子质量
2.657×10-26千克
氧的相对原子质量=
氢的相对原子质量=
碳的相对原子质量=
1.661×10-27千克
1.674×10-27千克
=16
1.661×10-27千克
1.993×10-26千克
=1
1.661×10-27千克
=12
求出氧、氢、碳的相对原子质量
C—12原子的质量分为12等份,即一份为1.661×10 千克
-27
我们要用到某原子的相对质量,是否都需要进行计算?
1、从元素周期表(附录5)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cu__________
40
27
35.5
108
1
12
16
64
元素周期表
相对原子质量表
1、相对原子质量最小的是什么原子?
H
2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?
不是,但能体现实际质量。相对原子质量越大,原子的实际质量越大。
3、相对原子质量与原子的实际质量相比,有什么优点?
数值比较简单,便于书写、运算、记忆。
4、相对原子质量有没有单位?
相对原子质量不是原子的真实质量,而是一个比值,没有单位。计算采用相对原子质量的近似值。
获得什么启发?
微粒 质量/千克 相对质量 注释
碳原子 1.993×10-26 12 6个质子6个中子
质子 1.6726×10-26 1 质子质量=中子质量
中子 1.6748×10-26 1
电子 9.1176×10-31 1/1834 电子质量是质子质量的1/1834
m质子 + m中子 = m原子
(3)m质子 = m中子= C-12原子质量的1/12
(1)电子的质量相对于原子质量来说很小
(4)一个质子和中子的相对质量是 1
(5)相对原子质量 = 质子数 + 中子数
归纳:
(2)原子几乎全部的质量都集中在原子核上
原子 种类 核电 荷数 质子数 中子数 电子数 相对原子质量
1
氧 8 8
12 23
12 12
17 18
13 27
26 30
氢 1 0 1 1
8 8 16
钠 11 11 11
镁 12 12 24
氯 17 17 35
铝 13 14 13
铁 26 26 56
练习1:填表
质子数=电子数=核电荷数 相对原子质量=质子数+中子数
1.如果碳-12原子的质量为M千克,X原子的质量为N千克,则X原子的相对原子质量为( )
M/12N B. 12M/N C. N/12M D.12N/M
变式1:已知1个碳-12原子的质量为m千克,某元素的1个原子的质量8m千克,则该元素的相对原子质量_____.
96
D
变式2:甲原子与乙原子的质量之比为x:y,而乙原子与12C原子的质量之比为n:m,则甲原子的相对原子质量为_______.
第二课时
浙江省台州初级中学
徐中勇
2009年2月
相对分子质量:一个分子中各原子的相对原子质量总和 .
二、相对分子质量(式量)
原子质量可以用相对质量表示,分子质量也可以用相对分子质量表示。
即:相对原子质量×原子个数之和
求二氧化碳、硫酸的相对分子质量
步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和 注意:若分子式中有括号,计算相对分子质量应带括号运算。
求二氧化碳、硫酸的相对分子质量
CO2(二氧化碳分子)的相对分子质量:
M=12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
M=1×2 + 32 + 16×4 = 98
Ca(OH)2
求:氢氧化钙的相对分子质量
M=40+(16+1)×2=40+34=74
求:CuSO4.5H2O的相对分子质量
M=64+32+16×4+5×(1×2+16)=250
已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24
求出下列相对分子质量:
CH4_____ Ca(OH)2_____
(NH4)2SO4______ 3H2O_____ 4CO2_____ 5Mg(OH)2_____
16
74
132
54
176
290
相对原子质量和相对分子质量有没有单位?
什么物质的相对分子质量最小?
H2
没有单位
化学式表示什么?
(1)
(2)
(3)
(4)
(5)
CO2
(1)表示该种物质(二氧化碳气体)
(2)表示该物质的一个分子的构成(一个CO2分子由一个碳原子和二个氧原子构成)
(3)表示这种物质的组成(二氧化碳由碳元素和氧元素组成)
(4)表示该物质的一个分子(一个二氧化碳分子)
(5)表示构成该物质一个分子的原子种类
(6)表示该物质的相对分子质量
1、某原子核内有n个中子,相对原子质量是N,该原子的核电荷数是________,原子核外的电子数是______.
2、制造原子弹的原料为铀-235,这种铀原子的相对原子质量为_____,若其核电荷数为92,则其核内的中子数为_____,质子数为_____,核外电子数为______.
N-n
N-n
92
92
143
235
练习:
甲原子质量
乙原子质量
甲相对原子质量
乙相对原子质量
=
3、已知氧和硫的相对原子质量分别为16和32,则一个氧原子和一个硫原子的质量比为 。
4、变题:铁与镁的质量比为M:N,则两种物
质中铁原子和镁原子的个数比为 。
3M/7N
练习:
5、已知元素A和B的化合价分别是+3和-2,相对原子质量分别是56和16,则两种元素组成的化合物的相对分子质量为多少?
6、变化题:某化合物(HnRO2n)的相对分子质量是M,则:元素R的化合价是________,R的相对原子质量是_________;
练习:
(1)计算二氧化碳中各元素的质量比。
(2)计算硫酸铵[(NH4 ) 2SO4)]中各元素的质量比。
(3)计算碳酸氢铵(NH4HCO3)中各元素的质量比。
第 7 节
元素质量分数和质量比的确定
第三课时
浙江省台州初级中学
徐中勇
2009年2月
=
某原子的质量
一个碳12原子的质量
×12
1、相对原子质量
一、知识回顾!
2、相对分子质量(式量)
相对分子质量:一个分子中各原子的 相对原子质量总和
3、原子个数的计算
4、原分子个数的计算
原子个数
原子的总质量
相对原子质量
=
分子个数
物质的总质量
相对分子质量
=
二、课前热身!
1、写出下列物质(或微粒)的化学式并计算它的相对分子质量。
SO2
64
Na2CO3
106
FeCl3
162.5
4CO2
176
氯化铁( )
碳酸钠( )
二氧化硫( )
4个二氧化碳分子( )
你能求出水中氢元素和氧元素的质量比吗
解:水的化学式:H2O
1、根据化学式计算组成物质的各元素的质量比
mH:mO=(1×2):16=1:8
如:化合物AxBy
A、B元素质量比=(a×x):(b×y)
注意:ab是相对原子质量;xy是原子个数
(1)计算二氧化碳中各元素的质量比。
(2)计算硝酸铵中各元素的质量比。
CO2
NH4NO3
特别提醒:(1)规范解题格式
(2)看清题中所求各元素的顺序
解:mN:mH:mO=(14×2):(1×4):(16×3)=28:4:48=7:1:12
你能算出水中氢元素的质量分数吗
氢元素的相对原子质量(总)
水的相对分子质量
=
2H
H2O
=
2×1
18
=
11.1%(或0.11)
水中氧元素的质量分数是多少
2、根据化学式,计算物质中某一元素的质量分数。
O%=1-H%
解:水中氢元素质量分数H% =
2、计算碳酸氢铵中各元素的质量比
氢元素的质量分数
氮元素的质量分数
NH4HCO3
练一练:
变化题:某厂生产碳酸氢氨(NH4HCO3)化肥,打出“本厂生产的碳酸氢氨,属国际首创,含氮量全球最高,达到20.1%的广告”,试通过计算说明该广告的真实性
X100%
2、A的质量分数=—————————
A的相对原子质量×m
AmBn的相对分子质量
1、计算NH4NO3中氮元素的质量分数
14×2
14×2+1×4+16×3
×100%
=
×100%
N×2
NH4NO3
=
解:N%
(1)硫酸铵的相对分子质量。
(2)硫酸铵中氢元素的质量分数.
(3)66克硫酸铵中含氮元素的质量.
(4)多少克硫酸铵中含氮元素质量为28克
(5)多少克硫酸铵中含氮元素质量与60克尿素[ CO(NH2)2 ]所含氮的质量相等
(NH4)2SO4
3、有关不纯物质的计算
元素的质量
不纯物质质量
×
=
该物质的质量分数
×
纯物质中该元素的质量分数
1:现有含氧化铁80%的铁矿石500吨,问最多可冶炼出铁多少吨?
2:世界卫生组织把铝列为污染源之一,成人每天摄入铝元素的质量控制在0.004g以下.油条是中国北方常用的食品之一,每270g油条中含有0.9g明矾,它的化学式是KAl(SO4)2.12H2O,求:(1)明矾的相对分子质量 (2)明矾中硫、氢、氧元素的质量比?(3)如果一个成人每天食用142.2g油条,铝的摄入量是否超标 (4)在日常生活中你该如何做
练一练:
1、经检测一份尿样中含尿素CO(NH2)2 的质量分数为2%,假定其他成分不含氮,求:此尿样中氮元素的质量分数?
2、某尿样中含氮的质量分数为0.91%,如果这些氮存在于尿素中,则尿中尿素的质量分数?
3、在CO与X的混合气体中,氧元素的质量分数是58%,则:X可能是( )
A、CO2 B、N2 C、NO D、SO2
A
1、氮肥是含有氮元素的物质,经测定某种硝酸铵(NH4NO3)化肥中氮元素质量分数是38.4%,则:该硝酸铵化肥中可能含有下列哪种物质( )
A、NH4HCO3
C、CO(NH2)2
B、(NH4)2SO4
C
第 7 节
第四课时
浙江省台州初级中学
徐中勇
2009年2月
分子式的涵义(以H2SO4例)
质的含义
量的含义
①物质
②分子
③构成
元素
④组成
原子
⑤构成
⑴该分子的相对分子质量
⑵该物质的各元素质量比
⑶该物质中某元素的质量分数
计算关系式(以化合物AmBn为例)
⑴相对分子质量=A的相对原子质量×m+B的相对原子质量×n
X100%
(3)A的质量分数=—————————
A的相对原子质量×m
AmBn的相对分子质量
(2)AB元素质量比=A的相对原子质量×m:B的相对原子质量×n
计算CuSO4·5H2O的式量
解:CuSO4·5H2O式量=64+32+16×4+(1×2+16)×5=250
计算NH4NO3中所含各元素的质量比
解:mN:mH:mO=(14×2):(1×4):(16×3)=28:4:48=7:1:12
=35%
计算NH4NO3中氮元素的质量分数
14×2
14×2+1×4+16×3
×100%
=
×100%
N×2
NH4NO3
=
解:N%
1.足球烯“C60”的相对分子质量为 ,“60”的意义是 ,这种物质是由 组成,由 构成,“C60”分子又是由 构成,它在分类上属于 . (填“混合物.化合物.单质”),它与金刚石.石墨化学性质相似,但物理性质差别很大的原因是 .
2.某种藻类的分子式为C106H263O110N16P,问该藻类由 种元素组成,各元素的质量比为 ,相对分子质量为 ,碳元素的质量分数为 ,该藻类分子由 种原子构成,原子总数 个,各原子的个数比为 .
5
1272:263:1760:224:31
3550
35.8%
5
496
106:263:110:16:1
(4)A元素质量=化合物AmBn的质量× A的质量分数
(5)化合物AmBn的质量=——————————
A(或B)的质量分数
A(或B)元素质量
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A.3.80g B.6.95g C.10g D.3.04g
多少克的硝酸铵与474克的碳铵的含氮量相等?
x×28/80 == 474×14/79
X == 240克
== 474×————
x×————
2N
NH4NO3
N
NH4HCO3
解:
(6)混合物中某元素的实际质量分数
=纯净物中这种元素的质量分数×纯度
杂质不含这种元素
2、有一不纯尿素[CO(NH2)2]样品,测知含氮元素44.8%,若已知杂质不含氮元素,此化肥的有效成分尿素的质量分数为__________。
96%
1、某黄铁矿中含FeS2为72%,计算该黄铁矿中硫元素的质量分数( )(已知杂质不含铁元素) A.36% B.38.4% C.42.6% D.48%
B
1.血红蛋白是一个大分子,它的相对分子质量是68000,已知其中铁元素的质量分数为0.33%,则每个血红蛋白分子中含铁原子的个数是( )
A.2 B.3 C.4 D.5
2.医药上的阿司匹林的式量为180,其中含4.5%的氢.35.5%氧.60%碳(以上均为质量分数),则阿司匹林的化学式是 .(从左到右按C.H.O顺序)
(7)由元素的质量分数倒求化学式
1.在公共场所有广告如下:
请回答下列问题:
(1)该化肥中所含的植物营养元素是______,
(2)证明该化肥是氮肥的实验步骤是_______,
(3)NH4HCO3中氮元素的质量分数是 ,
该广告宣称其含氮量是 ,因此这是一
则 .(填“真实或虚假”)广告。
化肥广告
———国 际 首 创————
优质化肥:碳酸氢铵 (NH4HCO3)
含氮量全球最高:(24.1%)
根据包装袋或产品说明书标示的元素含量推算它的纯度
2.此表是某“加碘食盐”包装袋上的部分文字说明.根据此表,结合所学知识,回答下列问题。
(1)碘元素的化合价 。
(2)从2000年10月1日起,我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐含碘酸钾 g(结果保留到0.001g)
(3)若成人每天食用7g碘盐,从中摄取0.15mg碘,那么1kg碘盐中含碘多少毫克?
配料表 精制海盐、碘酸钾
含碘量/Kg 20g~40g
分装日期 见封底
储藏方法 密封、避光、防潮
使用方法 烹调时,待食品熟后加入碘盐
+5
0.059
4.香烟燃烧发生复杂的物理化学变化。产生的烟气中含有四百多种致癌物质10多种会促进癌发展的物质,其中对人体危害最大的是烟碱(尼古丁).焦油.氰化物等。尼古丁的化学
_________.氮元素的质量分数为_______
结构式如右图,它的化学式是
解:碳铵中氮元素的质量分数为14/79×100%=17.7%
尿素中氮元素的质量分数为:28/60×100%=46.7%。
则100元钱买得的氮肥中氮元素的质量分别为:
碳铵.100/0.54×17.7%=32.8千克
尿素.100/1.25×46.7%=37.4千克
3.商店中有碳铵(NH4HCO3).尿素[CO(NH2)2]两种氮肥,标价为:碳铵0.54元/千克,尿素1.25元/千克。赵大伯要用100元钱买氮肥,试通过计算论证理论上赵大伯买哪种氮肥合算?
C10H14N2
17.3%
5:某市场中硫酸铵和尿素两种化肥,每千克的售价分别为1.3元和1.8元,根据它们所含氮的比例分析,买哪种化肥更经济?
比较哪种化肥更经济实际比较:价格/ 氮元素质量,其比值越小的更经济;或计算出:氮元素质量/价格,其比值越大的更经济.
1、相同质量的SO2和SO3中,氧元素的质量比是________.
四、其它题型:
5:6
2、相同质量的CO和CO2中,氧元素的质量比是________.
11:14
3.某氧化物的化学式为NxOy ,其中氮元素和氧元素的质量比为7:4,此氧化物化学式中X与Y的比为_____,此化学式是________。(N-14 O-16)
4、某碳氢化合物中,碳元素与氢元素的质量比为3:1,则其化学式中碳原子与氢原子的个数比是_________,此化学式是________。(C-12 H-1)
2:1
N2O
1:4
CH4
5、常温下,乙烷(C2H6)气体和酒精(C2H6O)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数是( )
(C-12 H-1 O-16)
解析 混合物中,O%=a%则C、H%=(100—a)%,
由化学式C2H6、C2H6O可知混合物中
碳、氢元素的质量之比等于4:1,
所以C%= %
7、苏丹红1号(C16H12N2O)是一种红色染料,具有至癌性,禁止食用,几个同学展开如下讨论:①苏丹红1号的相对分子质量是248克②苏丹红1号分子有4种原子③苏丹红1号分子由碳、氢、氧、氮四种元素组成④苏丹红1号由分子构成⑤苏丹红1号分子中碳、氢、氧、氮原子的个数比是16:12:2:1⑥苏丹红1号分子由16个碳原子、12个氢原子、1个氧原子、2个氮原子构成⑦苏丹红1号是一种混合物⑧苏丹红1号是氧化物;其中不正确的有——————————。
135678
8.为满足生产需要,要使每公顷地增加2 kg的氮元素,问在50公顷地上应施加硝酸铵肥料多少千克 若改施碳酸氢铵(NH4HCO3),问需碳酸氢铵肥料多少千克
9.经分析测得在2.5克的某铜矿中含有0.5克氧化铜,计算在这种铜矿中含铜元素的质量分数?
(Cu-64 O-16)
(N-14 H-1 C-12 O-16)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
