浙科版 选修1 第四部分 实验13 DNA片段的PCR扩增 教案
文档属性
| 名称 | 浙科版 选修1 第四部分 实验13 DNA片段的PCR扩增 教案 |

|
|
| 格式 | docx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙科版 | ||
| 科目 | 生物学 | ||
| 更新时间 | 2021-01-07 00:00:00 | ||
图片预览




文档简介
1164590012052300通过“PCR扩增DNA片段及凝胶电泳鉴定” 实验
培养学生科学思维和探究能力
一、使用教材及内容分析
浙江科学技术出版社高中《生物学选修1生物技术实践》第四部分实验13《DNA片段的PCR扩增》,适用于高二年级。
2017版《高中生物学课程标准》中,要求学生“阐明基因工程的基本操作程序主要包括目的基因的获取、基因表达载体的构建、目的基因导入受体细胞和目的基因及其表达产物的检测鉴定等步骤”。建议开展“利用聚合酶链式反应(PCR)扩增DNA片段并完成电泳鉴定”的实验活动。
本实验有助于学生理解PCR反应的原理,掌握PCR和琼脂糖凝胶电泳技术,认同现代生物技术的应用价值,培养学生运用数学方法探究生物学问题的能力,提高核心素养,因而是十分重要的内容。
基于北京四中高中部的分子生物学实验室,拥有PCR仪、凝胶电泳成像等先进教学设备;且本校的学生学习能力较强、求知欲高,对现代生物学技术非常感兴趣,会以积极认真的态度参与实验过程。因此,我校开设本实验多年。
二、实验器材
PCR仪、琼脂糖凝胶电泳设备(含梳子、胶盒、水平电泳槽和电泳仪电源)、微量移液器及枪头、微量离心管、培养皿、三角瓶、封口膜、橡皮筋、冰盒、记号笔、三脚架、微波炉或水浴锅(枪头、微量离心管使用前需进行高压蒸汽灭菌)。
材料:食用高活性干酵母(酿酒酵母)。
PCR相关试剂
(以下溶液在-20℃条件下冷冻保存,课前放于冰盒内或冰块上)
市售10×扩增缓冲液(含Mg2+)、市售 10 mmol/L 4种脱氧核苷三磷酸(dNTP)、市售 2 U/μL Taq DNA 聚合酶、10μmol/L引物A溶液:序列为5’-TCCGTAGGTGAACCTGCGG-3’、10μmol/L引物B溶液:序列为5’-TCCTCCGCTTATTGATATGC-3’、无菌水。
电泳相关试剂
Tris-硼酸(TBE)电泳缓冲液:取20 mL市售50×电泳缓冲液,加蒸馏水980 mL、市售6×上样缓冲液(loading buffer)、市售DNA标准溶液(Marker)。
染色相关试剂
0.1% 亚甲基蓝溶液(称取0.1 g 亚甲基蓝溶于100 mL 蒸馏水中,避免接触皮肤和眼睛,避光保存)、75% 乙醇、藏于4℃冰箱的蒸馏水。或使用0.002% 亚甲基蓝溶液(将2 mL 的0.1% 亚甲基蓝溶液加入10 mL电泳缓冲液中,再加88 mL蒸馏水,避光保存)。
其他资料准备:教师进行预实验,录制示范操作的特写视频并拍摄实验操作和结果的照片,编写并印发实验讲义。
三、实验改进要点
本实验选用的实验材料是市售的λ噬菌体DNA或大肠杆菌,前者较为昂贵,后者需进行培养。该实验流程约为3课时,其中的电泳和染色需安排2节课连堂,教师调课有困难。此外,课本对实验数据的处理没有具体要求,通过实验培养学生科学思维的预期目标也难以实现。
针对以上问题,笔者在近年来的教学实践中逐步对该实验进行了些许探索:以易于取得和培养的酵母菌为实验材料,对其部分rDNA片段进行PCR扩增和凝胶电泳。缩短电泳及染色的时间,提供替换的染色方法,不仅能够节约1课时,还能获得理想的实验效果。进一步运用数学方法分析实验结果中蕴含的信息,实施STEM教学。将原本的验证性实验转化为探究性实验,从而培养学生的科学思维,达到预期教学效益。具体改进如下:
表1 实验改进前后对比表
课本中实验操作
尝试性实验探索
PCR
扩增λ噬菌体DNA片段或大肠杆菌的16S rDNA片段
改进1:PCR扩增酵母细胞的核糖体DNA部分片段
①以酵母菌为实验材料
②采用新引物,扩增核糖体DNA部分片段
③设计PCR反应体系
④摸索PCR反应条件
凝胶电泳
电泳40 min
改进2:缩短凝胶电泳时间
电泳 25 min
染色
①用10 mL 0.1%亚甲基蓝液覆盖凝胶表面15~20 min;②加入5 mL 70%乙醇脱色1~2 min;③加入冷水,几分钟后看到条带。
改进3:优化染色方案
方案1:①加入0.1%亚甲基蓝溶液没过凝胶约5 mm,染色8 min;②加入75%乙醇没过凝胶约5 mm,脱色1~1.5min;③加入冷蒸馏水脱色
方案2:倒入0.002% 亚甲基蓝溶液没过凝胶约5 mm,4℃冷藏过夜。
实验结果
观察DNA条带的位置和宽度
改进4:运用数学方法深入分析实验结果中蕴含的信息
①用直尺测量并记录每个DNA条带迁移距离
②借助半对数坐标纸探究DNA片段长度与迁移距离的关系,估计PCR产物大小
③使用条带更多的Marker验证上述实验结果
④运用Excel绘制半对数曲线图精确计算PCR产物大小并验证DNA片段长度与迁移距离的关系
以上4项创新在教学过程中的具体应用,以★在后文标出。
四、实验原理
聚合酶链式反应技术(polymerase chain reaction),简称为PCR技术,是一种体外扩增特定基因或DNA序列的技术,经过多次循环变性、退火、延伸三个步骤,可获得大量的目的基因或DNA片段,广泛应用于医学诊断、法医鉴定、古生物学研究等方面。
电泳是指带电粒子在电场作用下,向与其携带电荷相反的电极迁移的过程,是分离、鉴定、纯化核酸和蛋白质的常用方法。本实验以琼脂糖凝胶为介质进行电泳。核酸是带有负电的生物大分子,在电场作用下会向正电极迁移。在电场强度一定时,核酸分子越大迁移速率越慢。DNA片段根据长度大小在凝胶上分开,形成不连续的条带,每个条带包含的DNA片段长度是相同的。
亚甲基蓝(又名“亚甲蓝”)可以将无色的DNA染成蓝色,且基本无毒。通过使用亚甲基蓝对琼脂糖凝胶进行染色,再用75%的乙醇和蒸馏水进行脱色,就可以观察到琼脂糖凝胶中DNA条带的具体位置。
五、实验教学目标
(一)知识与技能:简述PCR反应、凝胶电泳鉴定的原理与应用。尝试独立完成运用PCR技术扩增DNA片段并用琼脂糖凝胶电泳进行检测的基本操作。
(二)过程与方法:运用已学的生物学知识,结合科学史材料,推理PCR实验原理;独立操作实验并运用绘图、建模、软件分析等数学方法深入分析实验结果,培养学生的科学思维和探究能力。
(三)情感、态度、价值观:认同由揭示科学概念到技术应用,是很多科学家艰苦努力工作的结果;认同现代生物技术的应用价值。
六、实验教学内容
本实验的教学内容主要包括实验原理的解析、实验操作的组织和实验结果分析。实验原理主要包括PCR反应原理、电泳和染色原理。实验操作涵盖了PCR扩增(实验材料的准备、配制反应体系、PCR扩增)、电泳(制备凝胶、制备样品、加样、跑电泳)、染色(亚甲基蓝染色、脱色)的操作。实验分析包括实验现象的观察与交流,运用数学方法深入分析实验结果中蕴含的信息(测量DNA条带迁移距离,绘图探究DNA片段长度与迁移距离的关系并据此推测PCR产物长度,使用不同Marker相互验证,运用Excel绘图精确计算并验证)。从而将STEM(科学、技术、工程和数学)教育与学科教学融合,引导学生解决来自社会、生产和生活的生物学问题。
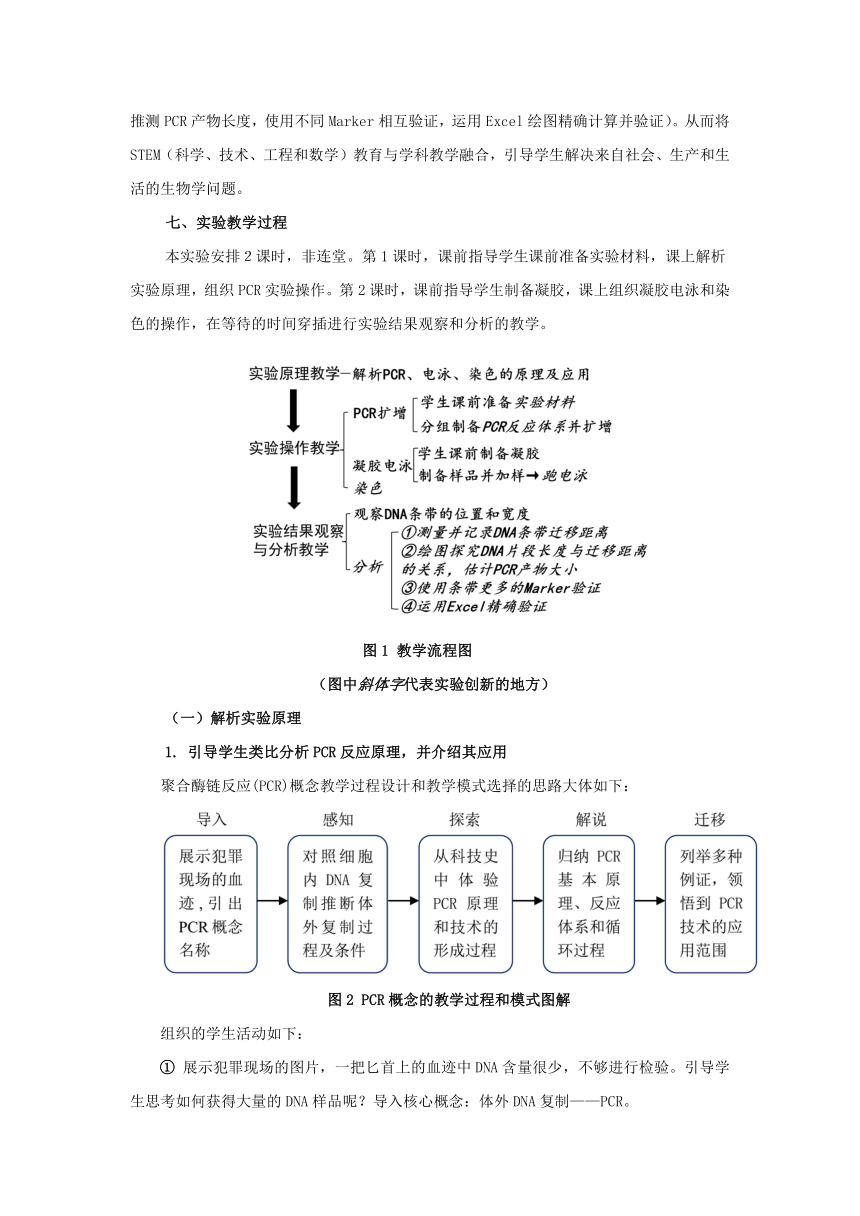
七、实验教学过程
本实验安排2课时,非连堂。第1课时,课前指导学生课前准备实验材料,课上解析实验原理,组织PCR实验操作。第2课时,课前指导学生制备凝胶,课上组织凝胶电泳和染色的操作,在等待的时间穿插进行实验结果观察和分析的教学。
图1 教学流程图
(图中斜体字代表实验创新的地方)
(一)解析实验原理
1. 引导学生类比分析PCR反应原理,并介绍其应用
聚合酶链反应(PCR)概念教学过程设计和教学模式选择的思路大体如下:
图2 PCR概念的教学过程和模式图解
组织的学生活动如下:
① 展示犯罪现场的图片,一把匕首上的血迹中DNA含量很少,不够进行检验。引导学生思考如何获得大量的DNA样品呢?导入核心概念:体外DNA复制——PCR。
② 教师出示体内DNA复制的图片,促使学生在回忆细胞内DNA复制条件的基础上,类比推断体外DNA复制所需的条件——模板、原料、能量、酶和引物等,进而教师加以认定并以表格形式落实板书如下(括号中的内容在后续的课堂教学中逐步进行完善)
表2 体内复制与体外复制条件对比表
体内DNA复制
体外DNA复制
模板
DNA分子
√
原料
dNTP
√
酶
解旋酶
×
聚合酶
√(Taq酶)
连接酶
×
引发酶
×
引物
RNA引物
√(DNA引物)
③ 引导学生从科技史料中体验PCR技术发展过程。 ⑴1957年科恩伯格因发现并提取大肠杆菌DNA聚合酶(最适温度为37℃ )时,曾探讨用此酶在体外进行DNA复制的可能性,因此获1959年诺贝尔医学或生理学奖。⑵1968年科拉纳因破译遗传密码而获诺贝尔生理学和医学奖,期间引导学生体外合成短链DNA(引物)技术,1971年其实验室研究员提出PCR技术的基本原理。
④ 简略介绍穆利斯的生平。展示让穆利斯得到灵感的夜间高速公路的照片,并描述当时情景:1983年的一个夜晚,穆利斯开车回家,加州公路上两排路灯和相对行使的车辆让他感到似曾相识。然后,启发学生结合DNA复制方式与公路上下车道上车辆相对行驶的情景进行联想:⑴两排路灯犹如DNA的双链;⑵反向行驶车辆像是DNA聚合酶,面对面地合成着单链DNA;⑶公路两端在绿灯处起步的两辆车恰似两个引物。在学生联想和小组讨论的基础上,教师绘制板图向学生介绍穆利斯最初的PCR设想,以及简要介绍兰德尔?才木,亨利???厄利克,史蒂文?沙夫等人为PCR技术日趋成熟的贡献。
⑤ 先引导学生思考:高温使DNA双链分开时,会破坏那种生物大分子?带领学生分析出:从大肠杆菌中提取的DNA聚合酶在高温下易失活,使得DNA每次复制都需要加入新酶。结果不仅操作复杂,而且价格非常昂贵。然后,教师展示黄石热泉生态系统图并讲述Taq酶发现史:⑴1969年美国微生物学家托马斯?布洛克就在黄石公园发现了生长于70-75℃ 的水生嗜热菌。⑵1976,华裔女科学家钱嘉韵从Thermus Aquaticus成功分离出嗜热DNA聚合酶。这种酶被命名为Taq DNA聚合酶,最适温度为72℃。⑶1985年成功纯化后,开始应用于PCR。因其耐热性强,特异性高,扩增片段长,使得PCR技术具有真正的实践意义,标志着PCR技术的成功。
⑥启发学生根据PCR技术史话,猜想PCR反应过程的大体步骤,设定每步反应的温度。播放《PCR原理》录像,或者教师可结合向学生阐述PCR技术原理的基本要点。最后,师生共同以板书形式概括PCR技术原理。
⑦教师介绍PCR在法医、亲子鉴定、分析远古DNA、医疗上的应用。使学生理解PCR定向扩增功能,为进一步学习“基因工程”获取目的基因打下基础,同时促使学生认同生物科学技术的价值。
⑧引导学生简略回顾PCR技术原理,思考并讨论:1993年,穆利斯因发明PCR独享诺贝尔化学奖。PCR的原理很简单,为什么穆利斯之前的科学家都没有尝试呢?从PCR概念生成到技术应用,仅穆利斯一个人就能完成么?教师提供科学史资料并组织学生讨论,学生通过讨论达成共识:认同勇于思考、大胆尝试对科学研究的重要意义;科学概念的提出到实际技术的应用,是很多科学家艰苦努力工作的结果;科学技术的发展能够极大地推动社会的生产力。
2. 讲解凝胶电泳及染色观察原理
教师结合模式图,说明电泳的定义、琼脂糖凝胶电泳的化学成分及其作用、和加样孔等基本概念。引导学生思考:什么样的DNA分子在凝胶中迁移得快?从而归纳总结出电泳的原理。并介绍凝胶电泳是分离、鉴定、纯化核酸和蛋白质的常用方法。然后,以Marker 2000和Marker 5000为例,讲解DNA标准溶液(marker)的作用,为后续教学过程中使用这两种marker进行探究埋下伏笔。
然后,向学生阐明亚甲基蓝的染色原理以及优点:无毒、结果肉眼可见、染色结果稳定。
Trans2000 Trans5000
图3 电泳原理示意图 图4 Marker电泳结果照片
(二)组织实验操作
1. PCR扩增
①学生课前准备实验材料。学生课前制备酵母细胞悬液,课上结合教师拍摄的示范视频讲解操作要点:称取0.1 g 干酵母粉,放于盛有100 mL无菌水的三角瓶中,盖上封口膜用皮筋绑好,摇匀后在温暖环境下活化2小时即可。
②制备PCR反应体系并扩增。每4位学生1组,共用1个冰盒,制备1个PCR反应体系。在微量离心管上做好标记后,离心后放入PCR仪进行扩增。
教师提示学生以下操作要点:使用微量移液器将PCR反应体系(见表3)各成分加入到0.2 mL已灭菌的微量离心管中。注意,不可加入过多酵母,否则细胞壁会影响PCR效果;且酵母细胞悬液需摇匀后再吸取。反复吹吸使反应液混合均匀,以3000转/min 的转速离心30 s,使反应液集中于微量离心管的底部。将微量离心管放入PCR仪中,设置反应条件如图5。扩增后的PCR产物可贮存于-20℃冰箱中。
表3 改进后的PCR反应体系配方
图5 改进后的PCR反应条件流程图
★改进1:PCR扩增酵母细胞的核糖体DNA(rDNA)部分片段。
将实验材料改为超市购买的食用高活性干酵母(酿酒酵母)。相较于噬菌体或大肠杆菌,酵母菌不仅更加便宜、安全、实验准备过程也更加简单。
酵母细胞中编码核糖体18S rRNA、5.8S rRNA、25S rRNA的3个DNA序列,中间相隔2个内转录间隔区(Internal Transcribed Spacer),简称ITS。成熟的核糖体RNA中不包括ITS序列,因此自然选择压力较小,能容忍更多变异。本实验使用真菌通用ITS引物(ITS1引物和ITS4引物)扩增5.8S rDNA及其两端的2个ITS的全部序列,以及相邻的18S rDNA和25S rDNA的部分序列,总长度为841 bp。
选择这段DNA进行教学是因为PCR扩增ITS序列,可以鉴定病原真菌,筛选酿酒的酵母菌株,还可以通过测序和比对不同物种的序列建立进化树,体现了PCR技术在医疗、工业和进化研究上的应用价值。ITS序列拷贝数高,长度多在1000 bp以内,容易被PCR扩增出来。此外,笔者根据教学实际,经过多次尝试,设计了适于教学的PCR反应体系和条件。
图6 核糖体DNA部分片段示意图
2. 电泳
①学生课前制备凝胶。指导学生课前制备凝胶,课上学生结合教师拍摄的制备凝胶的示范视频讲解操作要点:称取琼脂糖0.25 g加到盛有25 mL电泳缓冲液的三角瓶中。盖上封口膜并用橡皮筋绑住;用微波炉加热1 min,使琼脂糖熔化呈透明;倒入胶盒。注意避免产生气泡。待凝胶完全凝结,小心拔出梳子,将其从胶盒中取出,放入电泳槽内,加样孔一端朝向负极。向电泳槽中加入电泳缓冲液,并没过凝胶。
②加样。 教师展示加样模式图和特写照片说明加样孔位置,结合示范录像讲解制备样品和加样的操作要点:用微量移液器向50μL PCR产物中加入10μL 6×上样缓冲液,并反复吹吸混合均匀,再吸取10μL样品混合液缓慢加到加样孔内。注意,每加样1次需更换1个枪头。尽量避免使用最外侧的加样孔,其染色效果有时不理想。
教师在示范操作,在每块凝胶上加样10μL DNA marker。学生4人1组制备样品,每个样品混合液可供6人加样,每人至少独立完成加样1次。全班学生分为2大组,同时在2块凝胶上依次加样。
③跑电泳。教师边操作,边向学生讲解:盖上电泳槽盖,连接好电极插头后再接通电源。将直流电泳仪电源的电压设置成80 V,电泳25 min。注意观察溴酚蓝不要迁移出凝胶。
★改进2:缩短凝胶电泳时间。教材上是80V电压下电泳40分钟,现压缩到25分钟亦可看到PCR产物和Marker的条带。
3. 染色
教师结合染色示范录像的播放,讲解染色要点。学生分2组,对2块凝胶进行染色。
★改进3:优化染色方案。
教材中的3步染色法,操作时间较长。笔者通过反复地实践过程,提出两种可行的染色方案,既确保实验效果理想,又顺应教师的排课不同需求。
染色方案1:压缩并改进3步染色法:将染色时间从“15~20 min”压缩为“8 min”, 将“染液覆盖凝胶”改为“没过凝胶约5 mm”。从而,1课时完成电泳和染色,比原有方案减少了1课时,同时染色结果十分清晰。具体方法是:⑴将凝胶放入培养皿里,倒入0.1% 亚甲基蓝溶液没过凝胶约5 mm,染色8 min。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间,不要留有气泡。染色后回收染液,染液需避光保存。⑵倒入75%乙醇没过凝胶约5 mm,不断晃动培养皿1 ~1.5 min。再倒去乙醇。⑶加入冷的蒸馏水进行脱色,当出现清晰的蓝色区带时,倒去蒸馏水终止脱色。此过程中可更换被染蓝的蒸馏水。此外,凝胶在蒸馏水中不宜浸泡过久,否则条带颜色变淡直至无色。
染色方案2:将染色步骤简化为1步,染色效果仍很好。教师可利用剩余时间讲解观察实验现象的时间和方法,由于亚甲基蓝的染色效果较为稳定,可组织学生利用次日的课余时间观察实验结果。具体方法是:向盛有凝胶的培养皿中倒入0.002% 亚甲基蓝溶液,并没过凝胶约5 mm。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间。盖上培养皿盖,4℃冷藏过夜。第二天观察经过染色处理的凝胶板,看到清晰的蓝色区带后,倒去染液,终止染色。
A. 使用Marker 2000 B.使用Marker 5000
图7 改进后染色结果照片 图8改进前染色结果照片
(三)引导观察并分析实验结果
为了有效利用课堂时间,教师利用等待电泳和染色的时间引导学生推测实验结果,然后出示2块课前准备的预实验凝胶,验证学生的推测。然后,将学生分为2组,分别观察并分析这2块使用不同Marker的凝胶,获得的结论可互为验证。学生课下再运用课上习得的分析方法分析自己的实验结果。
1.观察DNA条带的位置和宽度
教师结合示范照片,讲解观察的要点:学生观察凝胶板上呈现的DNA时,可先在桌上铺1张白纸,在光下手持盛有凝胶的培养皿距白纸5 cm以上,找到较为清晰的区带。再将凝胶置于平的透明玻璃板上,放在三脚架上面进行观察和手机拍照。在观察的同时,可在实验报告单上绘制草图,标出DNA蓝色区带的数目和位置。
图9 手持培养皿进行观察 图10 将凝胶放在玻璃板上观察
使用Marker 2000 使用Marker 5000
图11 教师预实验结果局部照片
本实验中,染色凝胶板上呈现的清晰蓝色条带,即为DNA所在位置。PCR产物的长度介于800~1000 bp 之间。
2. 实验结果分析 (★改进4:运用数学方法分析实验结果中蕴含的数据)
在实验教学活动中,引导学生通过分析实验数据得出结论,是进行科学思维训练的最好方式。但以往教学过程中,仅提示学生通过对比Marker条带估出PCR产物的大致长度,却忽略了3个问题:PCR产物条带位于2条Marker条带之间,应该如何科学地估值?估测PCR产物长度只用到了Marker的1个或2个条带,丢弃了Marker其它条带中所蕴含的宝贵信息,应如何科学地分析实验数据?DNA片段长度的对数与迁移距离呈反比,应如何处理与对数相关的实验数据?在学科教研活动中老师们普遍认为,这节实验课获得的数据是培养学生理性思维的极好素材。理性思维是基于论证和逻辑推理的思维过程和方式,引导学生解决以上问题的过程就是对学生进行逻辑思维训练的过程,因此笔者在本实验活动中又进行了如下尝试:
①用直尺测量凝胶电泳后不同DNA片段迁移距离(图12),即凝胶板上每条DNA条带中央与加样孔之间的距离,记录于表4。
Marker 2000 Marker 5000
图12 测量DNA条带的迁移距离照片
②借助半对数坐标纸分析对数数据。如图13所示,迁移距离所在的x轴是分度均匀的普通坐标轴;DNA片段长度所在的Y轴是分度不均匀的对数坐标轴,在此轴上某点与0点的实际距离为该点对应数(即DNA片段长度)的对数值,但是在该点标出的值是DNA片段长度原数值。实际应用时,往往根据需要使用半对数坐标纸的一部分,如下图纵轴的起点就是100而不是0。将Marker 2000清晰的4个条带的数据标到图上,可见所有的点在一条直线上。从而推断“DNA片段长度的对数与迁移距离呈反比”,绘制趋势线(直线)作为标准曲线。据此标准曲线和PCR产物条带的迁移距离,可据图推断出PCR产物的大小约为840 bp。本次估值建立在Marker全部条带信息的基础上,更为科学。半对数曲线图的绘制易于教师展开教学;学生也习得了处理对数的简便方法,绘图和分析图表的能力得到了提升;数据的获取和分析更为深入。
③使用条带更多的Marker 5000验证上述实验结果的正确性。将Marker 5000的8个条带的数据标记在半对数坐标纸上,8个点也位于一条直线上,其趋势线与Marker 2000很接近,且基本平行。根据Marker 5000实验结果中PCR产物的迁移距离和趋势线,推断出PCR产物大小也约为840 bp,从而证明之前实验分析方法和结论的正确性。为了更好地比较两条趋势线,本文中使用Marker 2000的凝胶实际电泳时间为23.5 min,比另一组短1.5 min,从而避免两条线过于重合导致绘图、分析的困难。
④运用Excel绘制半对数曲线图精确计算PCR产物大小。为了获得精确的实验结果,教师指导学生使用Excel汇总并分析全班数据:将表3中Marker条带的信息输入到Excel中,选择绘制“散点图”,将纵坐标轴设置成“对数坐标”。添加趋势线时选择“指数”类型,并显示公式及R2值,从而获得半对数曲线图。可见两条直线接近且基本平行,0.99的R2值说明趋势线与数据的拟合度很好,精确证明了DNA条带的迁移距离与片段长度的对数呈反比。将PCR产物2次实验的迁移距离分别带入公式,计算出其长度约为846 bp及841 bp,与实际长度841 bp很接近。运用软件分析实验结果是信息技术与现代生物技术的结合,不仅实验分析更为精确,也激发学生的学习兴趣,有力地提高了他们的理性思维水平。
表4 DNA片段长度与迁移距离记录表
Marker 5000
PCR产物
DNA片段长度(bp)
5000
3000
2000
1500
1000
800
500
300
估算为846
迁移距离(cm)
1.20
1.46
1.70
1.85
2.08
2.21
2.45
2.65
2.15
Marker 2000
PCR产物
DNA片段长度(bp)
2000
1000
750
500
估算为841
迁移距离(cm)
1.60
1.95
2.10
2.27
2.03
利用半对数坐标纸绘制 运用Excel软件绘制
图13 DNA片段长度与迁移距离曲线图
八、实验效果评价
改进后的实验,实验材料改为酵母菌,更加安全、便宜、准备过程简单。由原来的3课时缩减为2课时,同时也保证了实验效果。
引导学生分析科学史、了解PCR反应在社会实践中的应用、全程参与现代生物学技术的操作和分析过程,尝试运用传统数学方法及现代信息技术处理生物大数据的过程。激发了学生学习生物学的兴趣,认同由揭示科学概念到技术应用,是很多科学家艰苦努力工作的结果,认同PCR技术广泛地应用于法医,医疗等多个方面,推动了社会进步。同时,提高学生的科学思维和探究能力。
教师通过学生课上的实验操作、课堂表现和实验报告对学生的学习效果进行评价。学生通过展示和交流而相互评价。
本实验的数据分析使亮点。半对数曲线图的引入,使原本的验证性实验转变为探究性实验。引导学生用数学模型法分析实验数据,实施STEM教学,其论证过程严谨,逻辑推理结论可信,从而将发展学生的生物核心素养落到实处。
培养学生科学思维和探究能力
一、使用教材及内容分析
浙江科学技术出版社高中《生物学选修1生物技术实践》第四部分实验13《DNA片段的PCR扩增》,适用于高二年级。
2017版《高中生物学课程标准》中,要求学生“阐明基因工程的基本操作程序主要包括目的基因的获取、基因表达载体的构建、目的基因导入受体细胞和目的基因及其表达产物的检测鉴定等步骤”。建议开展“利用聚合酶链式反应(PCR)扩增DNA片段并完成电泳鉴定”的实验活动。
本实验有助于学生理解PCR反应的原理,掌握PCR和琼脂糖凝胶电泳技术,认同现代生物技术的应用价值,培养学生运用数学方法探究生物学问题的能力,提高核心素养,因而是十分重要的内容。
基于北京四中高中部的分子生物学实验室,拥有PCR仪、凝胶电泳成像等先进教学设备;且本校的学生学习能力较强、求知欲高,对现代生物学技术非常感兴趣,会以积极认真的态度参与实验过程。因此,我校开设本实验多年。
二、实验器材
PCR仪、琼脂糖凝胶电泳设备(含梳子、胶盒、水平电泳槽和电泳仪电源)、微量移液器及枪头、微量离心管、培养皿、三角瓶、封口膜、橡皮筋、冰盒、记号笔、三脚架、微波炉或水浴锅(枪头、微量离心管使用前需进行高压蒸汽灭菌)。
材料:食用高活性干酵母(酿酒酵母)。
PCR相关试剂
(以下溶液在-20℃条件下冷冻保存,课前放于冰盒内或冰块上)
市售10×扩增缓冲液(含Mg2+)、市售 10 mmol/L 4种脱氧核苷三磷酸(dNTP)、市售 2 U/μL Taq DNA 聚合酶、10μmol/L引物A溶液:序列为5’-TCCGTAGGTGAACCTGCGG-3’、10μmol/L引物B溶液:序列为5’-TCCTCCGCTTATTGATATGC-3’、无菌水。
电泳相关试剂
Tris-硼酸(TBE)电泳缓冲液:取20 mL市售50×电泳缓冲液,加蒸馏水980 mL、市售6×上样缓冲液(loading buffer)、市售DNA标准溶液(Marker)。
染色相关试剂
0.1% 亚甲基蓝溶液(称取0.1 g 亚甲基蓝溶于100 mL 蒸馏水中,避免接触皮肤和眼睛,避光保存)、75% 乙醇、藏于4℃冰箱的蒸馏水。或使用0.002% 亚甲基蓝溶液(将2 mL 的0.1% 亚甲基蓝溶液加入10 mL电泳缓冲液中,再加88 mL蒸馏水,避光保存)。
其他资料准备:教师进行预实验,录制示范操作的特写视频并拍摄实验操作和结果的照片,编写并印发实验讲义。
三、实验改进要点
本实验选用的实验材料是市售的λ噬菌体DNA或大肠杆菌,前者较为昂贵,后者需进行培养。该实验流程约为3课时,其中的电泳和染色需安排2节课连堂,教师调课有困难。此外,课本对实验数据的处理没有具体要求,通过实验培养学生科学思维的预期目标也难以实现。
针对以上问题,笔者在近年来的教学实践中逐步对该实验进行了些许探索:以易于取得和培养的酵母菌为实验材料,对其部分rDNA片段进行PCR扩增和凝胶电泳。缩短电泳及染色的时间,提供替换的染色方法,不仅能够节约1课时,还能获得理想的实验效果。进一步运用数学方法分析实验结果中蕴含的信息,实施STEM教学。将原本的验证性实验转化为探究性实验,从而培养学生的科学思维,达到预期教学效益。具体改进如下:
表1 实验改进前后对比表
课本中实验操作
尝试性实验探索
PCR
扩增λ噬菌体DNA片段或大肠杆菌的16S rDNA片段
改进1:PCR扩增酵母细胞的核糖体DNA部分片段
①以酵母菌为实验材料
②采用新引物,扩增核糖体DNA部分片段
③设计PCR反应体系
④摸索PCR反应条件
凝胶电泳
电泳40 min
改进2:缩短凝胶电泳时间
电泳 25 min
染色
①用10 mL 0.1%亚甲基蓝液覆盖凝胶表面15~20 min;②加入5 mL 70%乙醇脱色1~2 min;③加入冷水,几分钟后看到条带。
改进3:优化染色方案
方案1:①加入0.1%亚甲基蓝溶液没过凝胶约5 mm,染色8 min;②加入75%乙醇没过凝胶约5 mm,脱色1~1.5min;③加入冷蒸馏水脱色
方案2:倒入0.002% 亚甲基蓝溶液没过凝胶约5 mm,4℃冷藏过夜。
实验结果
观察DNA条带的位置和宽度
改进4:运用数学方法深入分析实验结果中蕴含的信息
①用直尺测量并记录每个DNA条带迁移距离
②借助半对数坐标纸探究DNA片段长度与迁移距离的关系,估计PCR产物大小
③使用条带更多的Marker验证上述实验结果
④运用Excel绘制半对数曲线图精确计算PCR产物大小并验证DNA片段长度与迁移距离的关系
以上4项创新在教学过程中的具体应用,以★在后文标出。
四、实验原理
聚合酶链式反应技术(polymerase chain reaction),简称为PCR技术,是一种体外扩增特定基因或DNA序列的技术,经过多次循环变性、退火、延伸三个步骤,可获得大量的目的基因或DNA片段,广泛应用于医学诊断、法医鉴定、古生物学研究等方面。
电泳是指带电粒子在电场作用下,向与其携带电荷相反的电极迁移的过程,是分离、鉴定、纯化核酸和蛋白质的常用方法。本实验以琼脂糖凝胶为介质进行电泳。核酸是带有负电的生物大分子,在电场作用下会向正电极迁移。在电场强度一定时,核酸分子越大迁移速率越慢。DNA片段根据长度大小在凝胶上分开,形成不连续的条带,每个条带包含的DNA片段长度是相同的。
亚甲基蓝(又名“亚甲蓝”)可以将无色的DNA染成蓝色,且基本无毒。通过使用亚甲基蓝对琼脂糖凝胶进行染色,再用75%的乙醇和蒸馏水进行脱色,就可以观察到琼脂糖凝胶中DNA条带的具体位置。
五、实验教学目标
(一)知识与技能:简述PCR反应、凝胶电泳鉴定的原理与应用。尝试独立完成运用PCR技术扩增DNA片段并用琼脂糖凝胶电泳进行检测的基本操作。
(二)过程与方法:运用已学的生物学知识,结合科学史材料,推理PCR实验原理;独立操作实验并运用绘图、建模、软件分析等数学方法深入分析实验结果,培养学生的科学思维和探究能力。
(三)情感、态度、价值观:认同由揭示科学概念到技术应用,是很多科学家艰苦努力工作的结果;认同现代生物技术的应用价值。
六、实验教学内容
本实验的教学内容主要包括实验原理的解析、实验操作的组织和实验结果分析。实验原理主要包括PCR反应原理、电泳和染色原理。实验操作涵盖了PCR扩增(实验材料的准备、配制反应体系、PCR扩增)、电泳(制备凝胶、制备样品、加样、跑电泳)、染色(亚甲基蓝染色、脱色)的操作。实验分析包括实验现象的观察与交流,运用数学方法深入分析实验结果中蕴含的信息(测量DNA条带迁移距离,绘图探究DNA片段长度与迁移距离的关系并据此推测PCR产物长度,使用不同Marker相互验证,运用Excel绘图精确计算并验证)。从而将STEM(科学、技术、工程和数学)教育与学科教学融合,引导学生解决来自社会、生产和生活的生物学问题。
七、实验教学过程
本实验安排2课时,非连堂。第1课时,课前指导学生课前准备实验材料,课上解析实验原理,组织PCR实验操作。第2课时,课前指导学生制备凝胶,课上组织凝胶电泳和染色的操作,在等待的时间穿插进行实验结果观察和分析的教学。
图1 教学流程图
(图中斜体字代表实验创新的地方)
(一)解析实验原理
1. 引导学生类比分析PCR反应原理,并介绍其应用
聚合酶链反应(PCR)概念教学过程设计和教学模式选择的思路大体如下:
图2 PCR概念的教学过程和模式图解
组织的学生活动如下:
① 展示犯罪现场的图片,一把匕首上的血迹中DNA含量很少,不够进行检验。引导学生思考如何获得大量的DNA样品呢?导入核心概念:体外DNA复制——PCR。
② 教师出示体内DNA复制的图片,促使学生在回忆细胞内DNA复制条件的基础上,类比推断体外DNA复制所需的条件——模板、原料、能量、酶和引物等,进而教师加以认定并以表格形式落实板书如下(括号中的内容在后续的课堂教学中逐步进行完善)
表2 体内复制与体外复制条件对比表
体内DNA复制
体外DNA复制
模板
DNA分子
√
原料
dNTP
√
酶
解旋酶
×
聚合酶
√(Taq酶)
连接酶
×
引发酶
×
引物
RNA引物
√(DNA引物)
③ 引导学生从科技史料中体验PCR技术发展过程。 ⑴1957年科恩伯格因发现并提取大肠杆菌DNA聚合酶(最适温度为37℃ )时,曾探讨用此酶在体外进行DNA复制的可能性,因此获1959年诺贝尔医学或生理学奖。⑵1968年科拉纳因破译遗传密码而获诺贝尔生理学和医学奖,期间引导学生体外合成短链DNA(引物)技术,1971年其实验室研究员提出PCR技术的基本原理。
④ 简略介绍穆利斯的生平。展示让穆利斯得到灵感的夜间高速公路的照片,并描述当时情景:1983年的一个夜晚,穆利斯开车回家,加州公路上两排路灯和相对行使的车辆让他感到似曾相识。然后,启发学生结合DNA复制方式与公路上下车道上车辆相对行驶的情景进行联想:⑴两排路灯犹如DNA的双链;⑵反向行驶车辆像是DNA聚合酶,面对面地合成着单链DNA;⑶公路两端在绿灯处起步的两辆车恰似两个引物。在学生联想和小组讨论的基础上,教师绘制板图向学生介绍穆利斯最初的PCR设想,以及简要介绍兰德尔?才木,亨利???厄利克,史蒂文?沙夫等人为PCR技术日趋成熟的贡献。
⑤ 先引导学生思考:高温使DNA双链分开时,会破坏那种生物大分子?带领学生分析出:从大肠杆菌中提取的DNA聚合酶在高温下易失活,使得DNA每次复制都需要加入新酶。结果不仅操作复杂,而且价格非常昂贵。然后,教师展示黄石热泉生态系统图并讲述Taq酶发现史:⑴1969年美国微生物学家托马斯?布洛克就在黄石公园发现了生长于70-75℃ 的水生嗜热菌。⑵1976,华裔女科学家钱嘉韵从Thermus Aquaticus成功分离出嗜热DNA聚合酶。这种酶被命名为Taq DNA聚合酶,最适温度为72℃。⑶1985年成功纯化后,开始应用于PCR。因其耐热性强,特异性高,扩增片段长,使得PCR技术具有真正的实践意义,标志着PCR技术的成功。
⑥启发学生根据PCR技术史话,猜想PCR反应过程的大体步骤,设定每步反应的温度。播放《PCR原理》录像,或者教师可结合向学生阐述PCR技术原理的基本要点。最后,师生共同以板书形式概括PCR技术原理。
⑦教师介绍PCR在法医、亲子鉴定、分析远古DNA、医疗上的应用。使学生理解PCR定向扩增功能,为进一步学习“基因工程”获取目的基因打下基础,同时促使学生认同生物科学技术的价值。
⑧引导学生简略回顾PCR技术原理,思考并讨论:1993年,穆利斯因发明PCR独享诺贝尔化学奖。PCR的原理很简单,为什么穆利斯之前的科学家都没有尝试呢?从PCR概念生成到技术应用,仅穆利斯一个人就能完成么?教师提供科学史资料并组织学生讨论,学生通过讨论达成共识:认同勇于思考、大胆尝试对科学研究的重要意义;科学概念的提出到实际技术的应用,是很多科学家艰苦努力工作的结果;科学技术的发展能够极大地推动社会的生产力。
2. 讲解凝胶电泳及染色观察原理
教师结合模式图,说明电泳的定义、琼脂糖凝胶电泳的化学成分及其作用、和加样孔等基本概念。引导学生思考:什么样的DNA分子在凝胶中迁移得快?从而归纳总结出电泳的原理。并介绍凝胶电泳是分离、鉴定、纯化核酸和蛋白质的常用方法。然后,以Marker 2000和Marker 5000为例,讲解DNA标准溶液(marker)的作用,为后续教学过程中使用这两种marker进行探究埋下伏笔。
然后,向学生阐明亚甲基蓝的染色原理以及优点:无毒、结果肉眼可见、染色结果稳定。
Trans2000 Trans5000
图3 电泳原理示意图 图4 Marker电泳结果照片
(二)组织实验操作
1. PCR扩增
①学生课前准备实验材料。学生课前制备酵母细胞悬液,课上结合教师拍摄的示范视频讲解操作要点:称取0.1 g 干酵母粉,放于盛有100 mL无菌水的三角瓶中,盖上封口膜用皮筋绑好,摇匀后在温暖环境下活化2小时即可。
②制备PCR反应体系并扩增。每4位学生1组,共用1个冰盒,制备1个PCR反应体系。在微量离心管上做好标记后,离心后放入PCR仪进行扩增。
教师提示学生以下操作要点:使用微量移液器将PCR反应体系(见表3)各成分加入到0.2 mL已灭菌的微量离心管中。注意,不可加入过多酵母,否则细胞壁会影响PCR效果;且酵母细胞悬液需摇匀后再吸取。反复吹吸使反应液混合均匀,以3000转/min 的转速离心30 s,使反应液集中于微量离心管的底部。将微量离心管放入PCR仪中,设置反应条件如图5。扩增后的PCR产物可贮存于-20℃冰箱中。
表3 改进后的PCR反应体系配方
图5 改进后的PCR反应条件流程图
★改进1:PCR扩增酵母细胞的核糖体DNA(rDNA)部分片段。
将实验材料改为超市购买的食用高活性干酵母(酿酒酵母)。相较于噬菌体或大肠杆菌,酵母菌不仅更加便宜、安全、实验准备过程也更加简单。
酵母细胞中编码核糖体18S rRNA、5.8S rRNA、25S rRNA的3个DNA序列,中间相隔2个内转录间隔区(Internal Transcribed Spacer),简称ITS。成熟的核糖体RNA中不包括ITS序列,因此自然选择压力较小,能容忍更多变异。本实验使用真菌通用ITS引物(ITS1引物和ITS4引物)扩增5.8S rDNA及其两端的2个ITS的全部序列,以及相邻的18S rDNA和25S rDNA的部分序列,总长度为841 bp。
选择这段DNA进行教学是因为PCR扩增ITS序列,可以鉴定病原真菌,筛选酿酒的酵母菌株,还可以通过测序和比对不同物种的序列建立进化树,体现了PCR技术在医疗、工业和进化研究上的应用价值。ITS序列拷贝数高,长度多在1000 bp以内,容易被PCR扩增出来。此外,笔者根据教学实际,经过多次尝试,设计了适于教学的PCR反应体系和条件。
图6 核糖体DNA部分片段示意图
2. 电泳
①学生课前制备凝胶。指导学生课前制备凝胶,课上学生结合教师拍摄的制备凝胶的示范视频讲解操作要点:称取琼脂糖0.25 g加到盛有25 mL电泳缓冲液的三角瓶中。盖上封口膜并用橡皮筋绑住;用微波炉加热1 min,使琼脂糖熔化呈透明;倒入胶盒。注意避免产生气泡。待凝胶完全凝结,小心拔出梳子,将其从胶盒中取出,放入电泳槽内,加样孔一端朝向负极。向电泳槽中加入电泳缓冲液,并没过凝胶。
②加样。 教师展示加样模式图和特写照片说明加样孔位置,结合示范录像讲解制备样品和加样的操作要点:用微量移液器向50μL PCR产物中加入10μL 6×上样缓冲液,并反复吹吸混合均匀,再吸取10μL样品混合液缓慢加到加样孔内。注意,每加样1次需更换1个枪头。尽量避免使用最外侧的加样孔,其染色效果有时不理想。
教师在示范操作,在每块凝胶上加样10μL DNA marker。学生4人1组制备样品,每个样品混合液可供6人加样,每人至少独立完成加样1次。全班学生分为2大组,同时在2块凝胶上依次加样。
③跑电泳。教师边操作,边向学生讲解:盖上电泳槽盖,连接好电极插头后再接通电源。将直流电泳仪电源的电压设置成80 V,电泳25 min。注意观察溴酚蓝不要迁移出凝胶。
★改进2:缩短凝胶电泳时间。教材上是80V电压下电泳40分钟,现压缩到25分钟亦可看到PCR产物和Marker的条带。
3. 染色
教师结合染色示范录像的播放,讲解染色要点。学生分2组,对2块凝胶进行染色。
★改进3:优化染色方案。
教材中的3步染色法,操作时间较长。笔者通过反复地实践过程,提出两种可行的染色方案,既确保实验效果理想,又顺应教师的排课不同需求。
染色方案1:压缩并改进3步染色法:将染色时间从“15~20 min”压缩为“8 min”, 将“染液覆盖凝胶”改为“没过凝胶约5 mm”。从而,1课时完成电泳和染色,比原有方案减少了1课时,同时染色结果十分清晰。具体方法是:⑴将凝胶放入培养皿里,倒入0.1% 亚甲基蓝溶液没过凝胶约5 mm,染色8 min。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间,不要留有气泡。染色后回收染液,染液需避光保存。⑵倒入75%乙醇没过凝胶约5 mm,不断晃动培养皿1 ~1.5 min。再倒去乙醇。⑶加入冷的蒸馏水进行脱色,当出现清晰的蓝色区带时,倒去蒸馏水终止脱色。此过程中可更换被染蓝的蒸馏水。此外,凝胶在蒸馏水中不宜浸泡过久,否则条带颜色变淡直至无色。
染色方案2:将染色步骤简化为1步,染色效果仍很好。教师可利用剩余时间讲解观察实验现象的时间和方法,由于亚甲基蓝的染色效果较为稳定,可组织学生利用次日的课余时间观察实验结果。具体方法是:向盛有凝胶的培养皿中倒入0.002% 亚甲基蓝溶液,并没过凝胶约5 mm。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间。盖上培养皿盖,4℃冷藏过夜。第二天观察经过染色处理的凝胶板,看到清晰的蓝色区带后,倒去染液,终止染色。
A. 使用Marker 2000 B.使用Marker 5000
图7 改进后染色结果照片 图8改进前染色结果照片
(三)引导观察并分析实验结果
为了有效利用课堂时间,教师利用等待电泳和染色的时间引导学生推测实验结果,然后出示2块课前准备的预实验凝胶,验证学生的推测。然后,将学生分为2组,分别观察并分析这2块使用不同Marker的凝胶,获得的结论可互为验证。学生课下再运用课上习得的分析方法分析自己的实验结果。
1.观察DNA条带的位置和宽度
教师结合示范照片,讲解观察的要点:学生观察凝胶板上呈现的DNA时,可先在桌上铺1张白纸,在光下手持盛有凝胶的培养皿距白纸5 cm以上,找到较为清晰的区带。再将凝胶置于平的透明玻璃板上,放在三脚架上面进行观察和手机拍照。在观察的同时,可在实验报告单上绘制草图,标出DNA蓝色区带的数目和位置。
图9 手持培养皿进行观察 图10 将凝胶放在玻璃板上观察
使用Marker 2000 使用Marker 5000
图11 教师预实验结果局部照片
本实验中,染色凝胶板上呈现的清晰蓝色条带,即为DNA所在位置。PCR产物的长度介于800~1000 bp 之间。
2. 实验结果分析 (★改进4:运用数学方法分析实验结果中蕴含的数据)
在实验教学活动中,引导学生通过分析实验数据得出结论,是进行科学思维训练的最好方式。但以往教学过程中,仅提示学生通过对比Marker条带估出PCR产物的大致长度,却忽略了3个问题:PCR产物条带位于2条Marker条带之间,应该如何科学地估值?估测PCR产物长度只用到了Marker的1个或2个条带,丢弃了Marker其它条带中所蕴含的宝贵信息,应如何科学地分析实验数据?DNA片段长度的对数与迁移距离呈反比,应如何处理与对数相关的实验数据?在学科教研活动中老师们普遍认为,这节实验课获得的数据是培养学生理性思维的极好素材。理性思维是基于论证和逻辑推理的思维过程和方式,引导学生解决以上问题的过程就是对学生进行逻辑思维训练的过程,因此笔者在本实验活动中又进行了如下尝试:
①用直尺测量凝胶电泳后不同DNA片段迁移距离(图12),即凝胶板上每条DNA条带中央与加样孔之间的距离,记录于表4。
Marker 2000 Marker 5000
图12 测量DNA条带的迁移距离照片
②借助半对数坐标纸分析对数数据。如图13所示,迁移距离所在的x轴是分度均匀的普通坐标轴;DNA片段长度所在的Y轴是分度不均匀的对数坐标轴,在此轴上某点与0点的实际距离为该点对应数(即DNA片段长度)的对数值,但是在该点标出的值是DNA片段长度原数值。实际应用时,往往根据需要使用半对数坐标纸的一部分,如下图纵轴的起点就是100而不是0。将Marker 2000清晰的4个条带的数据标到图上,可见所有的点在一条直线上。从而推断“DNA片段长度的对数与迁移距离呈反比”,绘制趋势线(直线)作为标准曲线。据此标准曲线和PCR产物条带的迁移距离,可据图推断出PCR产物的大小约为840 bp。本次估值建立在Marker全部条带信息的基础上,更为科学。半对数曲线图的绘制易于教师展开教学;学生也习得了处理对数的简便方法,绘图和分析图表的能力得到了提升;数据的获取和分析更为深入。
③使用条带更多的Marker 5000验证上述实验结果的正确性。将Marker 5000的8个条带的数据标记在半对数坐标纸上,8个点也位于一条直线上,其趋势线与Marker 2000很接近,且基本平行。根据Marker 5000实验结果中PCR产物的迁移距离和趋势线,推断出PCR产物大小也约为840 bp,从而证明之前实验分析方法和结论的正确性。为了更好地比较两条趋势线,本文中使用Marker 2000的凝胶实际电泳时间为23.5 min,比另一组短1.5 min,从而避免两条线过于重合导致绘图、分析的困难。
④运用Excel绘制半对数曲线图精确计算PCR产物大小。为了获得精确的实验结果,教师指导学生使用Excel汇总并分析全班数据:将表3中Marker条带的信息输入到Excel中,选择绘制“散点图”,将纵坐标轴设置成“对数坐标”。添加趋势线时选择“指数”类型,并显示公式及R2值,从而获得半对数曲线图。可见两条直线接近且基本平行,0.99的R2值说明趋势线与数据的拟合度很好,精确证明了DNA条带的迁移距离与片段长度的对数呈反比。将PCR产物2次实验的迁移距离分别带入公式,计算出其长度约为846 bp及841 bp,与实际长度841 bp很接近。运用软件分析实验结果是信息技术与现代生物技术的结合,不仅实验分析更为精确,也激发学生的学习兴趣,有力地提高了他们的理性思维水平。
表4 DNA片段长度与迁移距离记录表
Marker 5000
PCR产物
DNA片段长度(bp)
5000
3000
2000
1500
1000
800
500
300
估算为846
迁移距离(cm)
1.20
1.46
1.70
1.85
2.08
2.21
2.45
2.65
2.15
Marker 2000
PCR产物
DNA片段长度(bp)
2000
1000
750
500
估算为841
迁移距离(cm)
1.60
1.95
2.10
2.27
2.03
利用半对数坐标纸绘制 运用Excel软件绘制
图13 DNA片段长度与迁移距离曲线图
八、实验效果评价
改进后的实验,实验材料改为酵母菌,更加安全、便宜、准备过程简单。由原来的3课时缩减为2课时,同时也保证了实验效果。
引导学生分析科学史、了解PCR反应在社会实践中的应用、全程参与现代生物学技术的操作和分析过程,尝试运用传统数学方法及现代信息技术处理生物大数据的过程。激发了学生学习生物学的兴趣,认同由揭示科学概念到技术应用,是很多科学家艰苦努力工作的结果,认同PCR技术广泛地应用于法医,医疗等多个方面,推动了社会进步。同时,提高学生的科学思维和探究能力。
教师通过学生课上的实验操作、课堂表现和实验报告对学生的学习效果进行评价。学生通过展示和交流而相互评价。
本实验的数据分析使亮点。半对数曲线图的引入,使原本的验证性实验转变为探究性实验。引导学生用数学模型法分析实验数据,实施STEM教学,其论证过程严谨,逻辑推理结论可信,从而将发展学生的生物核心素养落到实处。
