2020—2021高中鲁科版(2019)化学必修第二册第二章《化学键 化学反应规律》单元检测题含答案
文档属性
| 名称 | 2020—2021高中鲁科版(2019)化学必修第二册第二章《化学键 化学反应规律》单元检测题含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 168.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-01-27 00:00:00 | ||
图片预览



文档简介
第二章《化学键
化学反应规律》单元检测题
一、单选题(共15小题)
1.将ag块状碳酸钙跟足量的盐酸反应,碳酸钙损失的质量随时间的变化曲线如图中实线所示,在相同的条件下,bg(a、b相差不大,但a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A.
答案A
B.
答案B
C.
答案C
D.
答案D
2.下列物质性质的变化规律与分子间作用力有关的是( )
A.
HF、HCl、HBr、HI的热稳定性依次减弱
B.
金刚石的硬度大于硅,其熔、沸点也高于硅
C.
NaF、NaCl、NaBr、NaI的熔点依次降低
D.
F2、Cl2、Br2、I2的沸点依次升高
3.在体积不变的密闭容器中发生反应N2(g)+3H2(g)2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.
N2、H2、NH3的浓度之比为1∶3∶2
B.
混合气体的密度不随时间变化
C.
当有1
mol
N≡N键断裂时,有6
mol
N—H键断裂
D.
单位时间内生成2amol
NH3,同时消耗amol
N2
4.在一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是( )
A.
单位时间内生成nmol
A2同时生成nmol
AB
B.
容器内气体的总物质的量不随时间而变化
C.
单位时间内生成2nmol
AB的同时生成nmol
B2
D.
单位时间内生成nmol
A2的同时生成nmol
B2
5.在恒温恒容的条件下,能使反应A(g)+B(g)C(g)+D(g)正反应速率增大的措施是( )
A.
减少C或D的浓度
B.
减少A的浓度
C.
减少B的浓度
D.
增大A或B的浓度
6.下列关于原电池的叙述中正确的是( )
A.
把电能转化为化学能的装置
B.
活泼金属作正极,不活泼金属作负极
C.
外电路中电子从负极流向正极
D.
正极发生氧化反应
7.如图所示是锌和铜形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①铜为负极,锌为正极
②铜极上有气泡产生,发生还原反应
③硫酸根离子向铜极移动
④若有0.5
mol电子流经导线,则可产生0.25
mol气体
⑤电子的流向是铜―→锌
⑥正极反应式:Cu+2e-Cu2+,发生氧化反应
A.
①②③
B.
②④
C.
②④⑥
D.
③④⑤
8.在一定温度下体积不变的密闭容器中,可逆反应A(g)+3B(g)2C(g)+2D(g)达到平衡状态的标志是( )
A.
各物质的浓度相等
B.
A、B、C、D的浓度之比为1∶3∶2∶2
C.
正反应速率与逆反应速率均为零
D.
正反应速率与逆反应速率相等
9.对于化学反应的限度的叙述,错误的是( )
A.
任何可逆反应都有一定的限度
B.
化学反应达到限度时,正、逆反应速率相等
C.
化学反应的限度与时间的长短无关
D.
化学反应的限度是不可改变的
10.下列物质的变化过程中,共价键明显被破坏的是( )
A.
从NH4HCO3中闻到了刺激性气味
B.
NaCl熔化
C.
NH3液化
D.
NaOH溶于水
11.某温度下,反应2N2O5(g)4NO2(g)+O2(g)开始时,c(N2O5)=0.040
8
mol·L-1,经1
min后,c(N2O5)=0.030
0
mol·L-1。则该反应的反应速率为( )
A.v(N2O5)=5.4×10-3mol·L-1·min-1
B.v(N2O5)=1.08×10-2mol·L-1·min-1
C.v(NO2)=1.08×10-2mol·L-1·min-1
D.v(O2)=1.08×10-2mol·L-1·min-1
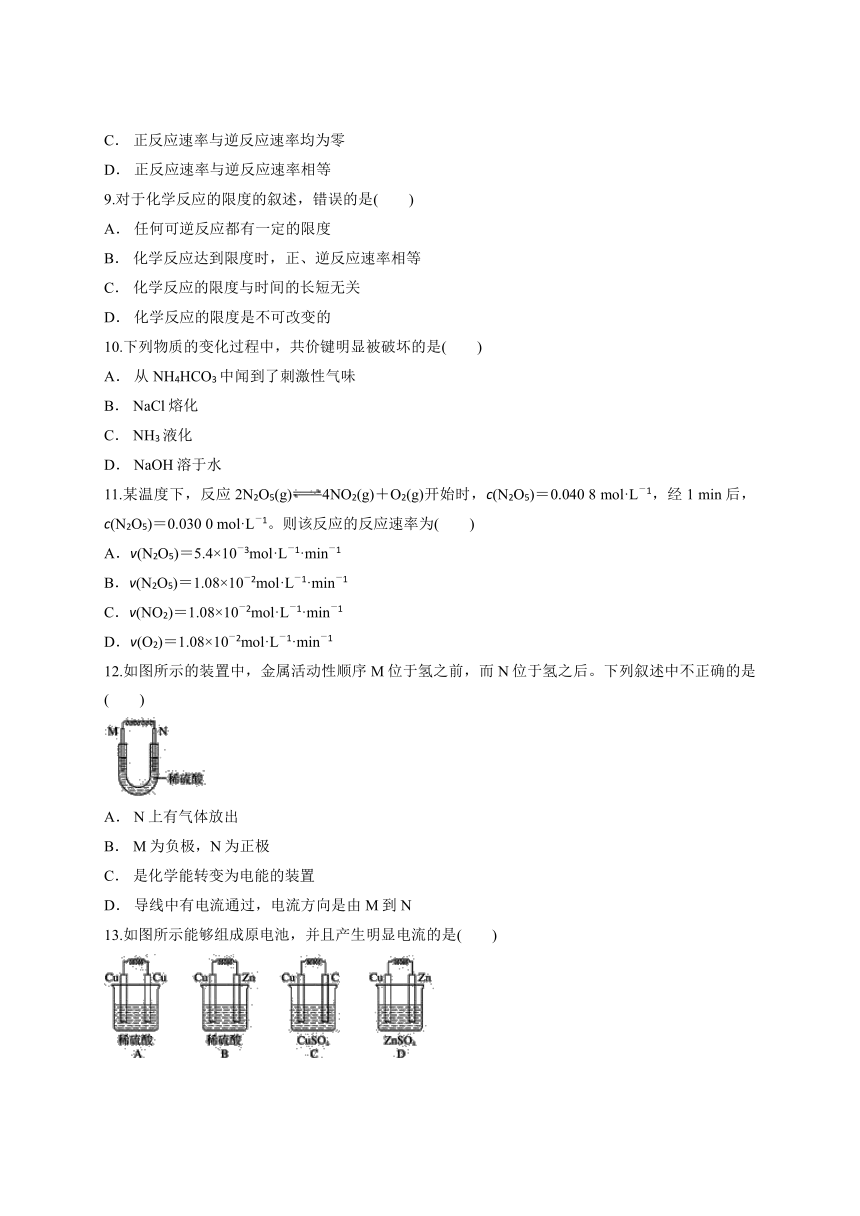
12.如图所示的装置中,金属活动性顺序
M位于氢之前,而N位于氢之后。下列叙述中不正确的是( )
A.
N上有气体放出
B.
M为负极,N为正极
C.
是化学能转变为电能的装置
D.
导线中有电流通过,电流方向是由M到N
13.如图所示能够组成原电池,并且产生明显电流的是( )
A.
A
B.
B
C.
C
D.
D
14.在2
L的密闭容器中,反应物的物质的量为3
mol,经过20
s后,它的物质的量变成了1
mol,在这20s内它的反应速率为( )
A.
0.1
mol
·L-1·s-1
B.
0.05
mol
·L-1·min-1
C.
0.05
mol
·L-1·s-1
D.
0.8
mol
·L-1·s-1
15.下列有关电池叙述中正确的是( )
A.
锌锰干电池是一种常用的二次电池
B.
锌锰干电池碳棒是负极,锌片是正极
C.
锌锰干电池工作一段时间后锌外壳逐渐变薄
D.
水果电池是高效环保的家用电池
二、实验题(共3小题)
16.某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验:
X溶液是________,滴入的量一般为________。
②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是________________________________________________________________________。
(2)丙同学利用“保温瓶式最热计”,测出10
mL
10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化,见下表(假设两溶液密度相同)。
就此实验回答:
①盐酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应。
②请在下图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图。
17.某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+Fe2++H2↑
(2)实验用品:电极(__________、__________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为________________________________________________________________________,
发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
18.某同学用如图所示做水果电池的实验,测得数据如下表所示:
请回答以下问题:
(1)实验⑥中负极的电极反应式为________________________________________________。
(2)实验①、⑤中电流方向相反的原因是__________________________________________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”)
。
三、计算题(共3小题)
19.向2
L密闭容器中通入6
mol气体A和6
mol气体B,在一定条件下发生反应:xA(g)+yB(g)===pC(g)+qD(g)
已知:平均反应速率v(C)=v(A);反应2
min时,A的浓度减少了1
mol·L-1,B的物质的量减少了3
mol,有6
mol
D生成。
回答下列问题:
(1)反应2
min内,v(A)=______,v(B)=________;
(2)该反应化学方程式中x∶y∶p∶q=____________;
(3)如果其他条件不变,将容器的容积变为1
L,进行同样的实验,则与上述反应比较:反应速率________(填“增大”“减小”或“不变”),理由是___________________。
20.常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13
mol,nt(NH3)=6
mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8
L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
21.将气体A、B置于固定容积为2
L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10
s末,达到平衡,测得A的物质的量为1.8
mol,B的物质的量为0.6
mol,C的物质的量为0.8
mol。
(1)用C表示10
s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10
s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____________;②增大A的浓度_________________________________________;
③恒容下充入氖气____________。
四、填空题(共3小题)
22.写出下列物质的电子式:
(1)具有双核10个电子的共价化合物分子的电子式是____________;
(2)四核10个电子的共价化合物分子的化学式是____________;
(3)以上两种化合物的热稳定性由小到大的顺序是____________。
23.现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是________。
(2)只由极性键构成的物质是________。
(3)只由非极性键构成的物质是________。
(4)只由非金属元素组成的离子化合物是________。
(5)由极性键和非极性键构成的物质是________。
(6)由离子键和极性键构成的物质是________。
(7)由离子键和非极性键构成的物质是________。
(8)属于离子化合物的物质是________。
(9)属于共价化合物的物质是________。
24.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________________________________。
(2)B中锡极为________极,电极反应式为____________,锡极附近溶液的酸性________(填“增大”、“减小”或“不变”)
。B中Fe极为________极,电极反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应式方程式为__________________________
________________________________________________________________________。
(4)
A、B、C中铁被腐蚀由快到慢的顺序是__________________________________。
答案解析
1.【答案】C
【解析】粉末状碳酸钙的表面积比块状碳酸钙的表面积大,相同条件下,与相同浓度的盐酸反应时反应速率大,排除A项、B项。由于a>b,ag碳酸钙反应时放出二氧化碳多,排除D项。
2.【答案】D
【解析】卤素的非金属性F>
Cl>Br>I,卤化氢的热稳定性HF>HCl>HBr>HI;C-C键比Si-Si键稳定,难断裂,金刚石的硬度大于硅,其熔、沸点也高于硅;NaF、NaCl、NaBr、NaI的熔点与其离子键强弱有关;F2、Cl2、Br2、I2的分子间作用力依次增强,沸点依次升高。
3.【答案】C
【解析】A中,N2、H2、NH3的浓度之比等于化学计量数之比时,不能确定反应是否处于平衡状态;B中,因容器的体积不变,而混合气体的总质量不改变,则无论反应平衡与否,混合气体的密度均不变;C中,当有1
mol
N≡N键断裂时,相当于生成2
mol
NH3(1
mol
NH3中含有3
mol
N—H键),即形成6
mol
N—H键,同时有6
mol
N—H键断裂,符合v正(NH3)=v逆(NH3),故反应处于化学平衡状态;D中,两反应速率均表示正反应速率,反应进行的任何阶段均成比例。
4.【答案】C
【解析】先确定正反应(生成AB)和逆反应(生成A2或B2),再求它们指定物质变化的物质的量之比,若等于其化学计量数之比,则反应达到平衡状态。由于该反应前后气体的体积相等,无论反应是否达到平衡,容器内气体的总物质的量不随时间变化而变化。
5.【答案】D
【解析】减少生成物C或D的浓度,逆反应速率减小,正反应速率也减小;减少反应物A或B的浓度,正反应速率减小;增大反应物A或B的浓度,正反应速率增大。
6.【答案】C
【解析】原电池是把化学能转化为电能的装置。在原电池中,活泼金属作负极,失去电子发生氧化反应;不活泼金属作正极,得到电子发生还原反应;其电子在外电路中的流向是从负极流向正极,电子流出的一极为负极,电子流入的一极为正极。
7.【答案】B
【解析】在锌铜原电池中,溶液中阴离子(硫酸根离子)移向负极(电极锌),阳离子(氢离子)移向正极(电极铜);负极锌失去电子,Zn-2e-Zn2+,发生氧化反应;溶液中氢离子在正极铜上得到电子,2H++2e-H2↑,发生还原反应,当有0.5
mol电子流经导线时,则有0.25
mol氢气生成。
8.【答案】D
【解析】各物质的浓度相等时,该反应不一定达到平衡状态,A错误;A、B、C、D的浓度之比为1∶3∶2∶2,不能说明各组分的浓度不再变化,无法判断是否达到了平衡状态,B错误;达到平衡状态时,正逆反应速率相等,但不等于零,C错误、D正确。
9.【答案】D
【解析】任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v正=v逆,对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关,但当外界条件发生改变,引起v正与v逆不相等时,化学平衡被破坏,化学反应的限度也会发生改变。
10.【答案】A
【解析】B项,NaCl熔化破坏离子键;C项,NH3液化后仍是NH3,没有破坏共价键;D项,NaOH溶于水破坏离子键。
11.【答案】B
【解析】Δc(N2O5)=0.040
8
mol·L-1-0.030
0
mol·L-1=0.010
8
mol·L-1。根据反应中各物质的化学计量数之比,可求得Δc(NO2)=0.021
6
mol·L-1,Δc(O2)=0.005
4
mol·L-1。根据化学反应速率的表达式可求得v(N2O5)==1.08×10-2mol·L-1·min-1,v(NO2)==2.16×10-2mol·L-1·min-1,v(O2)==5.4×10-3mol·L-1·min-1。
12.【答案】D
【解析】在该原电池中,活泼金属M为负极,失去电子发生氧化反应;N为正极,溶液中的氢离子在正极得到电子被还原为氢气有气体放出;电子由负极流出沿导线流向正极,而电流的方向与电子的流向相反,即由正极(N)流向负极(M)。
13.【答案】B
【解析】原电池的形成条件:
①有活动性不同的两个电极,②两电极插入电解质溶液中,③两极用导线相连形成闭合回路,④相对活泼的金属与电解质溶液发生自发的氧化还原反应。
A项电极相同且铜与稀硫酸不反应;C项和D项中相对活泼的金属与其电解质溶液不能发生氧化还原反应。
14.【答案】C
【解析】反应速率通常用单位时间内反应物或生成物浓度的变化量来表示,所以该反应物的反应速率==0.05
mol
·L-1·s-1。
15.【答案】C
【解析】锌锰干电池是一种常用的一次电池,其中锌作负极,碳棒作正极;锌锰干电池工作时,锌不断的被氧化而消耗,锌外壳会逐渐变薄。水果电池产生的电流非常微弱,不能作为家用电池。
16.【答案】(1)①酚酞 1~2滴 ②甲同学的实验不能说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应
(2)①放热 ②见下图
【解析】(1)①由题图知加入的指示剂在氢氧化钠溶液中呈红色,在酸性溶液中呈无色,故该试剂为酚酞;②甲同学的实验不能充分说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应。
(2)表格中的数据说明,该反应为放热反应。
17.【答案】(2)铁钉或铁条 铜钉(其他导电的惰性电极如铅笔芯、铂等都正确) 烧杯 导线
(4)①电能 电能 ②负 Fe-2e-Fe2+ 氧化
③正 2H++2e-H2↑ 还原
【解析】原电池是将化学能转变为电能的装置,活泼金属作负极,发生氧化反应,不活泼金属材料作正极,发生还原反应。电流表正极应接原电池正极,电流表负极应接原电池负极。
18.【答案】(1)Al-3e-Al3+
(2)实验①中锌比铜活泼,锌作负极,实验⑤中铝比锌活泼,锌作正极,两实验中电流方向相反
(3)水果品种 电极材料
(4)合理
【解析】实验⑥中电极是铝比锌与铝活泼,铝为负极,反应式为Al-3e-Al3+;实验①中锌比铜活泼,锌为负极,实验⑤中铝比锌活泼,锌为正极,两实验中电流方向相反;由实验①和⑤可知,水果电池的电压与水果的品种及电极材料有关。
19.【答案】(1)0.50
mol·L-1·min-1 0.75
mol·L-1·min-1
(2)2∶3∶1∶6
(3)增大 体积减小,物质的量浓度变大,反应物浓度越大,反应越快
【解析】(1)反应2
min内,A的浓度减少了1
mol·L-1,B的浓度减少了1.5
mol·L-1,所以v(A)==0.50
mol·L-1·min-1,v(B)==0.75
mol·L-1·min-1。
(2)因为v(C)=v(A),所以v(C)=0.25
mol·L-1·min-1,D的浓度增加3
mol·L-1,所以v(D)=1.5
mol·L-1·min-1,根据化学反应速率之比等于方程式中化学计量数之比,所以x∶y∶p∶q=0.5∶0.75∶0.25∶1.5=2∶3∶1∶6。
20.【答案】(1)16 (2)8
mol (3)5∶4 (4)2∶3
(5)1∶2 (6)3∶3∶2
【解析】(1)设反应转化的N2的物质的量为x,由题意可知:
由2x=6得x=3,a=13+3=16。
(2)平衡时n(NH3)=716.8
L÷22.4
L·mol-1×25%=32
mol×25%=8
mol。
(3)设反应过程中混合气体总物质的量减少y,则
解得y=8
mol,原混合气体总物质的量为716.8
L÷22.4
L·mol-1+8
mol=40
mol,原混合气体与平衡混合气体总物质的量之比为40
mol∶32
mol=5∶4。
(4)a∶b=16
mol∶(40-16)
mol=2∶3。
(5)平衡时,氮气的转化率为×100%=25%,氢气的转化率为×100%=50%,故α(N2)∶α(H2)=1∶2。
(6)反应过程中各物质的物质的量如下:
平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12
mol∶12
mol∶8
mol=3∶3∶2。
21.【答案】(1)0.04
mol·L-1·s-1 (2)1.5
mol·L-1
(3)0.4
mol·L-1 (4)1∶1 (5)不变 不变
(6)①减小 ②增大 ③不变
【解析】
(1)v(C)==0.04
mol·L-1·s-1。
(2)反应前,c(A)==1.5
mol·L-1。
(3)10
s末,c(D)==0.4
mol·L-1。
(4)起始和平衡时n(A)∶n(B)=3∶1,故α(A)=α(B)。
(5)混合气体的质量和物质的量、容器的体积均不变化,故r不变,ρ不变。
(6)恒容条件下充入稀有气体,反应速率不变。
22.【答案】(1) (2)NH3 (3)NH3<HF
【解析】双核10个电子的共价化合物为氟化氢,其电子式为;四核10个电子的共价化合物为氨,其化学式NH3;氟元素的非金属性比氮元素强,其氢化物的热稳定性HF>
NH3。
23.【答案】(1)⑥ (2)④ (3)① (4)⑦ (5)⑤ (6)③⑦ (7)② (8)②③⑥⑦ (9)④⑤
【解析】①Cl2中仅存在非极性共价键;②Na2O2不仅存在离子键还存在非极性共价键;③NaOH不仅存在离子键还存在极性共价键;④HCl仅存在极性共价键;⑤H2O2不仅存在极性共价键还存在非极性共价键;⑥MgF2仅存在离子键;⑦NH4Cl不仅存在离子键还存在极性共价键。
24.【答案】(1)Fe+2H+Fe2++H2↑
(2)正 2H++2e-H2↑ 减小 正极 Fe-2e-Fe2+
(3)Zn Zn+H2SO4ZnSO4+H2↑
(4)BAC
【解析】A中不能形成原电池,铁与稀硫酸发生置换反应。
B能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁腐蚀的速率加快。
C能形成原电池,锌比铁活泼,锌为负极不断被腐蚀,铁为正极保持不变。
化学反应规律》单元检测题
一、单选题(共15小题)
1.将ag块状碳酸钙跟足量的盐酸反应,碳酸钙损失的质量随时间的变化曲线如图中实线所示,在相同的条件下,bg(a、b相差不大,但a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
A.
答案A
B.
答案B
C.
答案C
D.
答案D
2.下列物质性质的变化规律与分子间作用力有关的是( )
A.
HF、HCl、HBr、HI的热稳定性依次减弱
B.
金刚石的硬度大于硅,其熔、沸点也高于硅
C.
NaF、NaCl、NaBr、NaI的熔点依次降低
D.
F2、Cl2、Br2、I2的沸点依次升高
3.在体积不变的密闭容器中发生反应N2(g)+3H2(g)2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.
N2、H2、NH3的浓度之比为1∶3∶2
B.
混合气体的密度不随时间变化
C.
当有1
mol
N≡N键断裂时,有6
mol
N—H键断裂
D.
单位时间内生成2amol
NH3,同时消耗amol
N2
4.在一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是( )
A.
单位时间内生成nmol
A2同时生成nmol
AB
B.
容器内气体的总物质的量不随时间而变化
C.
单位时间内生成2nmol
AB的同时生成nmol
B2
D.
单位时间内生成nmol
A2的同时生成nmol
B2
5.在恒温恒容的条件下,能使反应A(g)+B(g)C(g)+D(g)正反应速率增大的措施是( )
A.
减少C或D的浓度
B.
减少A的浓度
C.
减少B的浓度
D.
增大A或B的浓度
6.下列关于原电池的叙述中正确的是( )
A.
把电能转化为化学能的装置
B.
活泼金属作正极,不活泼金属作负极
C.
外电路中电子从负极流向正极
D.
正极发生氧化反应
7.如图所示是锌和铜形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①铜为负极,锌为正极
②铜极上有气泡产生,发生还原反应
③硫酸根离子向铜极移动
④若有0.5
mol电子流经导线,则可产生0.25
mol气体
⑤电子的流向是铜―→锌
⑥正极反应式:Cu+2e-Cu2+,发生氧化反应
A.
①②③
B.
②④
C.
②④⑥
D.
③④⑤
8.在一定温度下体积不变的密闭容器中,可逆反应A(g)+3B(g)2C(g)+2D(g)达到平衡状态的标志是( )
A.
各物质的浓度相等
B.
A、B、C、D的浓度之比为1∶3∶2∶2
C.
正反应速率与逆反应速率均为零
D.
正反应速率与逆反应速率相等
9.对于化学反应的限度的叙述,错误的是( )
A.
任何可逆反应都有一定的限度
B.
化学反应达到限度时,正、逆反应速率相等
C.
化学反应的限度与时间的长短无关
D.
化学反应的限度是不可改变的
10.下列物质的变化过程中,共价键明显被破坏的是( )
A.
从NH4HCO3中闻到了刺激性气味
B.
NaCl熔化
C.
NH3液化
D.
NaOH溶于水
11.某温度下,反应2N2O5(g)4NO2(g)+O2(g)开始时,c(N2O5)=0.040
8
mol·L-1,经1
min后,c(N2O5)=0.030
0
mol·L-1。则该反应的反应速率为( )
A.v(N2O5)=5.4×10-3mol·L-1·min-1
B.v(N2O5)=1.08×10-2mol·L-1·min-1
C.v(NO2)=1.08×10-2mol·L-1·min-1
D.v(O2)=1.08×10-2mol·L-1·min-1
12.如图所示的装置中,金属活动性顺序
M位于氢之前,而N位于氢之后。下列叙述中不正确的是( )
A.
N上有气体放出
B.
M为负极,N为正极
C.
是化学能转变为电能的装置
D.
导线中有电流通过,电流方向是由M到N
13.如图所示能够组成原电池,并且产生明显电流的是( )
A.
A
B.
B
C.
C
D.
D
14.在2
L的密闭容器中,反应物的物质的量为3
mol,经过20
s后,它的物质的量变成了1
mol,在这20s内它的反应速率为( )
A.
0.1
mol
·L-1·s-1
B.
0.05
mol
·L-1·min-1
C.
0.05
mol
·L-1·s-1
D.
0.8
mol
·L-1·s-1
15.下列有关电池叙述中正确的是( )
A.
锌锰干电池是一种常用的二次电池
B.
锌锰干电池碳棒是负极,锌片是正极
C.
锌锰干电池工作一段时间后锌外壳逐渐变薄
D.
水果电池是高效环保的家用电池
二、实验题(共3小题)
16.某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验:
X溶液是________,滴入的量一般为________。
②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是________________________________________________________________________。
(2)丙同学利用“保温瓶式最热计”,测出10
mL
10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化,见下表(假设两溶液密度相同)。
就此实验回答:
①盐酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应。
②请在下图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图。
17.某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+Fe2++H2↑
(2)实验用品:电极(__________、__________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为________________________________________________________________________,
发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
18.某同学用如图所示做水果电池的实验,测得数据如下表所示:
请回答以下问题:
(1)实验⑥中负极的电极反应式为________________________________________________。
(2)实验①、⑤中电流方向相反的原因是__________________________________________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”)
。
三、计算题(共3小题)
19.向2
L密闭容器中通入6
mol气体A和6
mol气体B,在一定条件下发生反应:xA(g)+yB(g)===pC(g)+qD(g)
已知:平均反应速率v(C)=v(A);反应2
min时,A的浓度减少了1
mol·L-1,B的物质的量减少了3
mol,有6
mol
D生成。
回答下列问题:
(1)反应2
min内,v(A)=______,v(B)=________;
(2)该反应化学方程式中x∶y∶p∶q=____________;
(3)如果其他条件不变,将容器的容积变为1
L,进行同样的实验,则与上述反应比较:反应速率________(填“增大”“减小”或“不变”),理由是___________________。
20.常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13
mol,nt(NH3)=6
mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8
L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
21.将气体A、B置于固定容积为2
L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10
s末,达到平衡,测得A的物质的量为1.8
mol,B的物质的量为0.6
mol,C的物质的量为0.8
mol。
(1)用C表示10
s内反应的平均反应速率为________。
(2)反应前A的物质的量浓度是________。
(3)10
s末,生成物D的浓度为________。
(4)A与B的平衡转化率之比为________。
(5)反应过程中容器内气体的平均相对分子质量变化是________(填“增大”、“减小”或“不变”,下同),气体的密度变化是________。
(6)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____________;②增大A的浓度_________________________________________;
③恒容下充入氖气____________。
四、填空题(共3小题)
22.写出下列物质的电子式:
(1)具有双核10个电子的共价化合物分子的电子式是____________;
(2)四核10个电子的共价化合物分子的化学式是____________;
(3)以上两种化合物的热稳定性由小到大的顺序是____________。
23.现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由离子键构成的物质是________。
(2)只由极性键构成的物质是________。
(3)只由非极性键构成的物质是________。
(4)只由非金属元素组成的离子化合物是________。
(5)由极性键和非极性键构成的物质是________。
(6)由离子键和极性键构成的物质是________。
(7)由离子键和非极性键构成的物质是________。
(8)属于离子化合物的物质是________。
(9)属于共价化合物的物质是________。
24.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________________________________。
(2)B中锡极为________极,电极反应式为____________,锡极附近溶液的酸性________(填“增大”、“减小”或“不变”)
。B中Fe极为________极,电极反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应式方程式为__________________________
________________________________________________________________________。
(4)
A、B、C中铁被腐蚀由快到慢的顺序是__________________________________。
答案解析
1.【答案】C
【解析】粉末状碳酸钙的表面积比块状碳酸钙的表面积大,相同条件下,与相同浓度的盐酸反应时反应速率大,排除A项、B项。由于a>b,ag碳酸钙反应时放出二氧化碳多,排除D项。
2.【答案】D
【解析】卤素的非金属性F>
Cl>Br>I,卤化氢的热稳定性HF>HCl>HBr>HI;C-C键比Si-Si键稳定,难断裂,金刚石的硬度大于硅,其熔、沸点也高于硅;NaF、NaCl、NaBr、NaI的熔点与其离子键强弱有关;F2、Cl2、Br2、I2的分子间作用力依次增强,沸点依次升高。
3.【答案】C
【解析】A中,N2、H2、NH3的浓度之比等于化学计量数之比时,不能确定反应是否处于平衡状态;B中,因容器的体积不变,而混合气体的总质量不改变,则无论反应平衡与否,混合气体的密度均不变;C中,当有1
mol
N≡N键断裂时,相当于生成2
mol
NH3(1
mol
NH3中含有3
mol
N—H键),即形成6
mol
N—H键,同时有6
mol
N—H键断裂,符合v正(NH3)=v逆(NH3),故反应处于化学平衡状态;D中,两反应速率均表示正反应速率,反应进行的任何阶段均成比例。
4.【答案】C
【解析】先确定正反应(生成AB)和逆反应(生成A2或B2),再求它们指定物质变化的物质的量之比,若等于其化学计量数之比,则反应达到平衡状态。由于该反应前后气体的体积相等,无论反应是否达到平衡,容器内气体的总物质的量不随时间变化而变化。
5.【答案】D
【解析】减少生成物C或D的浓度,逆反应速率减小,正反应速率也减小;减少反应物A或B的浓度,正反应速率减小;增大反应物A或B的浓度,正反应速率增大。
6.【答案】C
【解析】原电池是把化学能转化为电能的装置。在原电池中,活泼金属作负极,失去电子发生氧化反应;不活泼金属作正极,得到电子发生还原反应;其电子在外电路中的流向是从负极流向正极,电子流出的一极为负极,电子流入的一极为正极。
7.【答案】B
【解析】在锌铜原电池中,溶液中阴离子(硫酸根离子)移向负极(电极锌),阳离子(氢离子)移向正极(电极铜);负极锌失去电子,Zn-2e-Zn2+,发生氧化反应;溶液中氢离子在正极铜上得到电子,2H++2e-H2↑,发生还原反应,当有0.5
mol电子流经导线时,则有0.25
mol氢气生成。
8.【答案】D
【解析】各物质的浓度相等时,该反应不一定达到平衡状态,A错误;A、B、C、D的浓度之比为1∶3∶2∶2,不能说明各组分的浓度不再变化,无法判断是否达到了平衡状态,B错误;达到平衡状态时,正逆反应速率相等,但不等于零,C错误、D正确。
9.【答案】D
【解析】任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v正=v逆,对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关,但当外界条件发生改变,引起v正与v逆不相等时,化学平衡被破坏,化学反应的限度也会发生改变。
10.【答案】A
【解析】B项,NaCl熔化破坏离子键;C项,NH3液化后仍是NH3,没有破坏共价键;D项,NaOH溶于水破坏离子键。
11.【答案】B
【解析】Δc(N2O5)=0.040
8
mol·L-1-0.030
0
mol·L-1=0.010
8
mol·L-1。根据反应中各物质的化学计量数之比,可求得Δc(NO2)=0.021
6
mol·L-1,Δc(O2)=0.005
4
mol·L-1。根据化学反应速率的表达式可求得v(N2O5)==1.08×10-2mol·L-1·min-1,v(NO2)==2.16×10-2mol·L-1·min-1,v(O2)==5.4×10-3mol·L-1·min-1。
12.【答案】D
【解析】在该原电池中,活泼金属M为负极,失去电子发生氧化反应;N为正极,溶液中的氢离子在正极得到电子被还原为氢气有气体放出;电子由负极流出沿导线流向正极,而电流的方向与电子的流向相反,即由正极(N)流向负极(M)。
13.【答案】B
【解析】原电池的形成条件:
①有活动性不同的两个电极,②两电极插入电解质溶液中,③两极用导线相连形成闭合回路,④相对活泼的金属与电解质溶液发生自发的氧化还原反应。
A项电极相同且铜与稀硫酸不反应;C项和D项中相对活泼的金属与其电解质溶液不能发生氧化还原反应。
14.【答案】C
【解析】反应速率通常用单位时间内反应物或生成物浓度的变化量来表示,所以该反应物的反应速率==0.05
mol
·L-1·s-1。
15.【答案】C
【解析】锌锰干电池是一种常用的一次电池,其中锌作负极,碳棒作正极;锌锰干电池工作时,锌不断的被氧化而消耗,锌外壳会逐渐变薄。水果电池产生的电流非常微弱,不能作为家用电池。
16.【答案】(1)①酚酞 1~2滴 ②甲同学的实验不能说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应
(2)①放热 ②见下图
【解析】(1)①由题图知加入的指示剂在氢氧化钠溶液中呈红色,在酸性溶液中呈无色,故该试剂为酚酞;②甲同学的实验不能充分说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应。
(2)表格中的数据说明,该反应为放热反应。
17.【答案】(2)铁钉或铁条 铜钉(其他导电的惰性电极如铅笔芯、铂等都正确) 烧杯 导线
(4)①电能 电能 ②负 Fe-2e-Fe2+ 氧化
③正 2H++2e-H2↑ 还原
【解析】原电池是将化学能转变为电能的装置,活泼金属作负极,发生氧化反应,不活泼金属材料作正极,发生还原反应。电流表正极应接原电池正极,电流表负极应接原电池负极。
18.【答案】(1)Al-3e-Al3+
(2)实验①中锌比铜活泼,锌作负极,实验⑤中铝比锌活泼,锌作正极,两实验中电流方向相反
(3)水果品种 电极材料
(4)合理
【解析】实验⑥中电极是铝比锌与铝活泼,铝为负极,反应式为Al-3e-Al3+;实验①中锌比铜活泼,锌为负极,实验⑤中铝比锌活泼,锌为正极,两实验中电流方向相反;由实验①和⑤可知,水果电池的电压与水果的品种及电极材料有关。
19.【答案】(1)0.50
mol·L-1·min-1 0.75
mol·L-1·min-1
(2)2∶3∶1∶6
(3)增大 体积减小,物质的量浓度变大,反应物浓度越大,反应越快
【解析】(1)反应2
min内,A的浓度减少了1
mol·L-1,B的浓度减少了1.5
mol·L-1,所以v(A)==0.50
mol·L-1·min-1,v(B)==0.75
mol·L-1·min-1。
(2)因为v(C)=v(A),所以v(C)=0.25
mol·L-1·min-1,D的浓度增加3
mol·L-1,所以v(D)=1.5
mol·L-1·min-1,根据化学反应速率之比等于方程式中化学计量数之比,所以x∶y∶p∶q=0.5∶0.75∶0.25∶1.5=2∶3∶1∶6。
20.【答案】(1)16 (2)8
mol (3)5∶4 (4)2∶3
(5)1∶2 (6)3∶3∶2
【解析】(1)设反应转化的N2的物质的量为x,由题意可知:
由2x=6得x=3,a=13+3=16。
(2)平衡时n(NH3)=716.8
L÷22.4
L·mol-1×25%=32
mol×25%=8
mol。
(3)设反应过程中混合气体总物质的量减少y,则
解得y=8
mol,原混合气体总物质的量为716.8
L÷22.4
L·mol-1+8
mol=40
mol,原混合气体与平衡混合气体总物质的量之比为40
mol∶32
mol=5∶4。
(4)a∶b=16
mol∶(40-16)
mol=2∶3。
(5)平衡时,氮气的转化率为×100%=25%,氢气的转化率为×100%=50%,故α(N2)∶α(H2)=1∶2。
(6)反应过程中各物质的物质的量如下:
平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12
mol∶12
mol∶8
mol=3∶3∶2。
21.【答案】(1)0.04
mol·L-1·s-1 (2)1.5
mol·L-1
(3)0.4
mol·L-1 (4)1∶1 (5)不变 不变
(6)①减小 ②增大 ③不变
【解析】
(1)v(C)==0.04
mol·L-1·s-1。
(2)反应前,c(A)==1.5
mol·L-1。
(3)10
s末,c(D)==0.4
mol·L-1。
(4)起始和平衡时n(A)∶n(B)=3∶1,故α(A)=α(B)。
(5)混合气体的质量和物质的量、容器的体积均不变化,故r不变,ρ不变。
(6)恒容条件下充入稀有气体,反应速率不变。
22.【答案】(1) (2)NH3 (3)NH3<HF
【解析】双核10个电子的共价化合物为氟化氢,其电子式为;四核10个电子的共价化合物为氨,其化学式NH3;氟元素的非金属性比氮元素强,其氢化物的热稳定性HF>
NH3。
23.【答案】(1)⑥ (2)④ (3)① (4)⑦ (5)⑤ (6)③⑦ (7)② (8)②③⑥⑦ (9)④⑤
【解析】①Cl2中仅存在非极性共价键;②Na2O2不仅存在离子键还存在非极性共价键;③NaOH不仅存在离子键还存在极性共价键;④HCl仅存在极性共价键;⑤H2O2不仅存在极性共价键还存在非极性共价键;⑥MgF2仅存在离子键;⑦NH4Cl不仅存在离子键还存在极性共价键。
24.【答案】(1)Fe+2H+Fe2++H2↑
(2)正 2H++2e-H2↑ 减小 正极 Fe-2e-Fe2+
(3)Zn Zn+H2SO4ZnSO4+H2↑
(4)BAC
【解析】A中不能形成原电池,铁与稀硫酸发生置换反应。
B能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁腐蚀的速率加快。
C能形成原电池,锌比铁活泼,锌为负极不断被腐蚀,铁为正极保持不变。
