初中科学浙教版八年级下册第三章 第3节 化学方程式 练习题-普通用卷
文档属性
| 名称 | 初中科学浙教版八年级下册第三章 第3节 化学方程式 练习题-普通用卷 |

|
|
| 格式 | zip | ||
| 文件大小 | 268.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-02-13 21:36:52 | ||
图片预览


文档简介
初中科学浙教版八年级下册第三章第三节化学方程式练习题
一、选择题
中国制造、中国创造、中国建造共同发力,焊接、切割技术世界一流。生活中常用乙炔焰来切割金属,如图为乙炔燃烧示意图,下列说法中错误的是()
A.
该反应能放出大量的热
B.
乙炔中各元素质量比为12:1
C.
化学反应前后原子的种类和数目不变
D.
该反应中,参加反应的反应物分子个数比为1:1
某化学反应的微观过程如图所示,下列说法中错误的是
A.
甲属于氧化物
B.
物质丙的化学式是
C.
反应中,乙、丁两种物质的化学计量数之比为3:1
D.
物质丁的化学式是CO
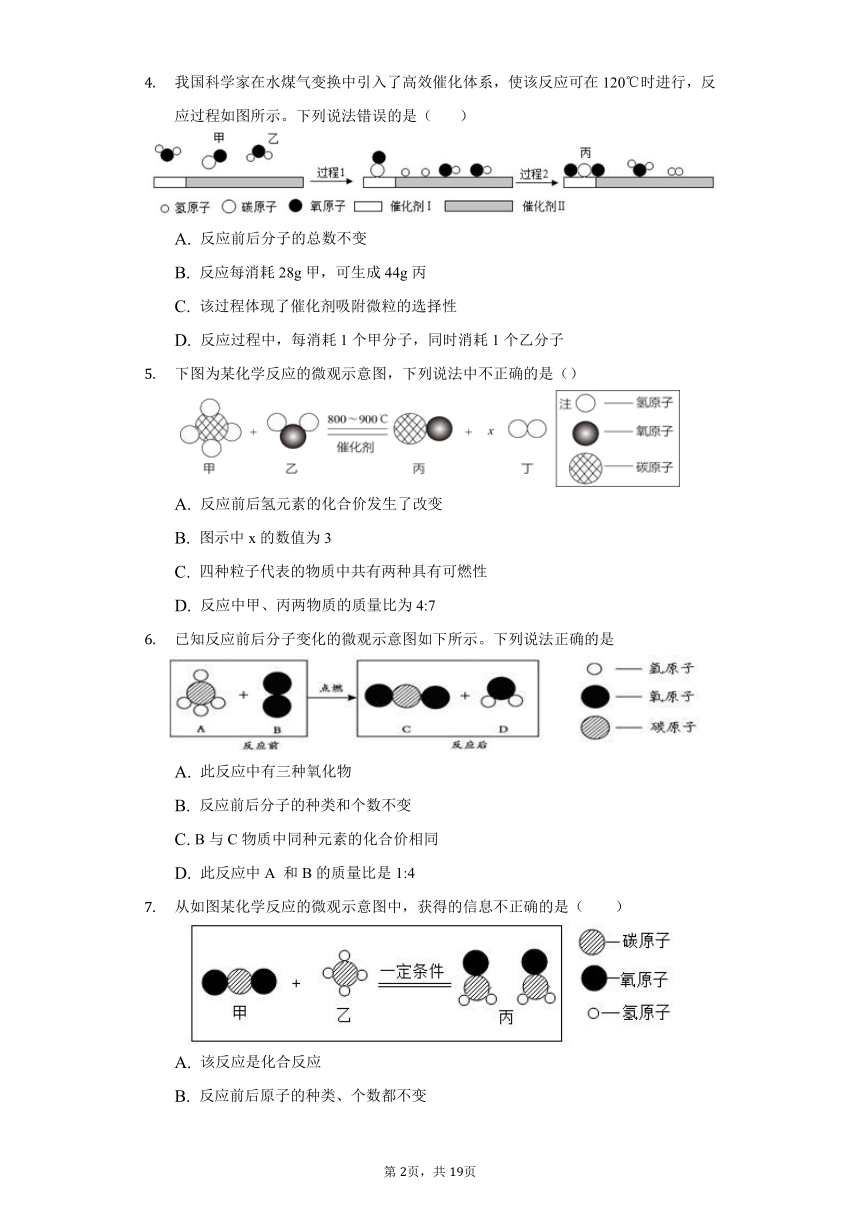
我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120
℃时进行,反应过程如图所示。下列说法错误的是(
)
A.
反应前后分子的总数不变
B.
反应每消耗28
g甲,可生成44
g丙
C.
该过程体现了催化剂吸附微粒的选择性
D.
参加反应的甲、乙分子个数比为1:2
我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是(?
?
?)
A.
反应前后分子的总数不变
B.
反应每消耗28g甲,可生成44g丙
C.
该过程体现了催化剂吸附微粒的选择性
D.
反应过程中,每消耗1个甲分子,同时消耗1个乙分子
下图为某化学反应的微观示意图,下列说法中不正确的是()
A.
反应前后氢元素的化合价发生了改变
B.
图示中x的数值为3
C.
四种粒子代表的物质中共有两种具有可燃性
D.
反应中甲、丙两物质的质量比为4:7
已知反应前后分子变化的微观示意图如下所示。下列说法正确的是
A.
此反应中有三种氧化物
B.
反应前后分子的种类和个数不变
C.
B与C物质中同种元素的化合价相同
D.
此反应中A
和B的质量比是1:4
从如图某化学反应的微观示意图中,获得的信息不正确的是( )
A.
该反应是化合反应
B.
反应前后原子的种类、个数都不变
C.
甲和乙的质量比为11:4
D.
甲乙丙三种物质的分子数比为1:1:1
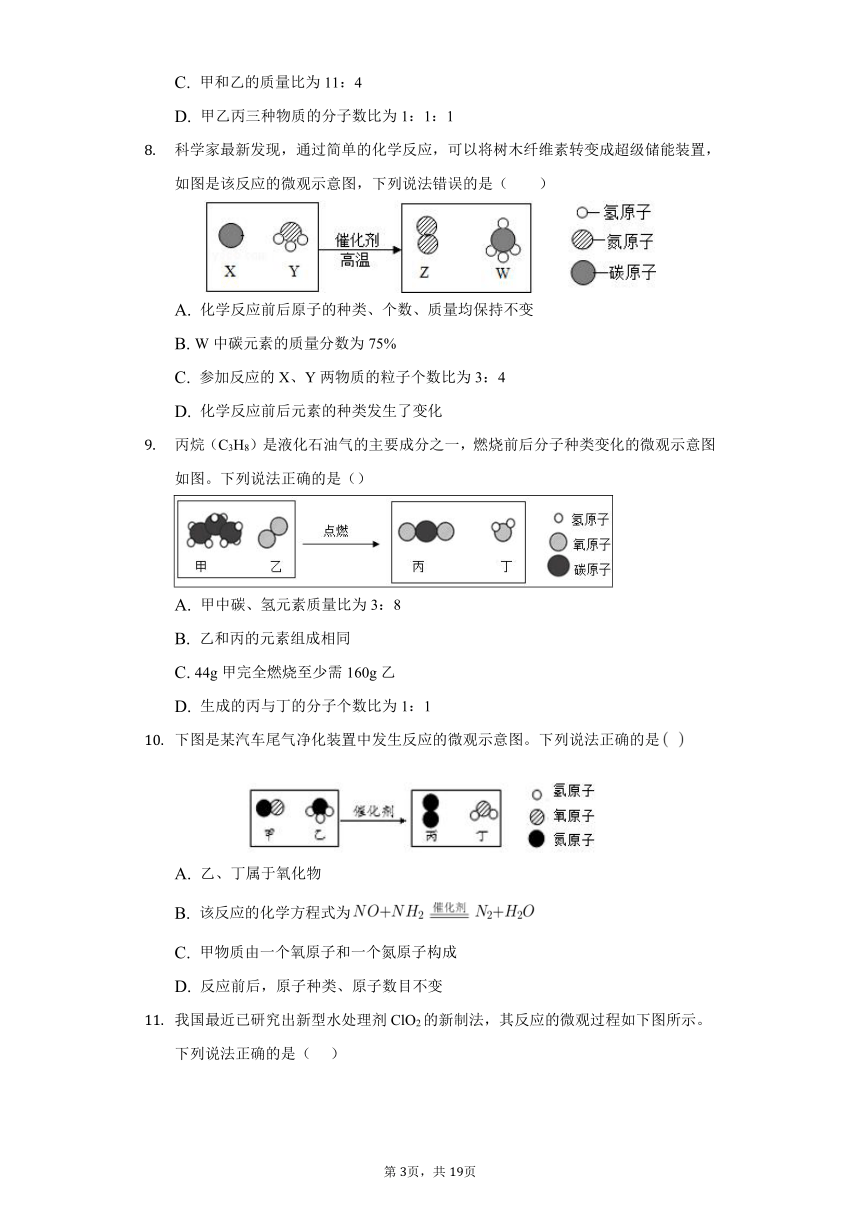
科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是( )
A.
化学反应前后原子的种类、个数、质量均保持不变
B.
W中碳元素的质量分数为75%
C.
参加反应的X、Y两物质的粒子个数比为3:4
D.
化学反应前后元素的种类发生了变化
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如图。下列说法正确的是()
A.
甲中碳、氢元素质量比为3:8
B.
乙和丙的元素组成相同
C.
44g甲完全燃烧至少需160g乙
D.
生成的丙与丁的分子个数比为1:1
下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是???
A.
乙、丁属于氧化物
B.
该反应的化学方程式为
C.
甲物质由一个氧原子和一个氮原子构成
D.
反应前后,原子种类、原子数目不变
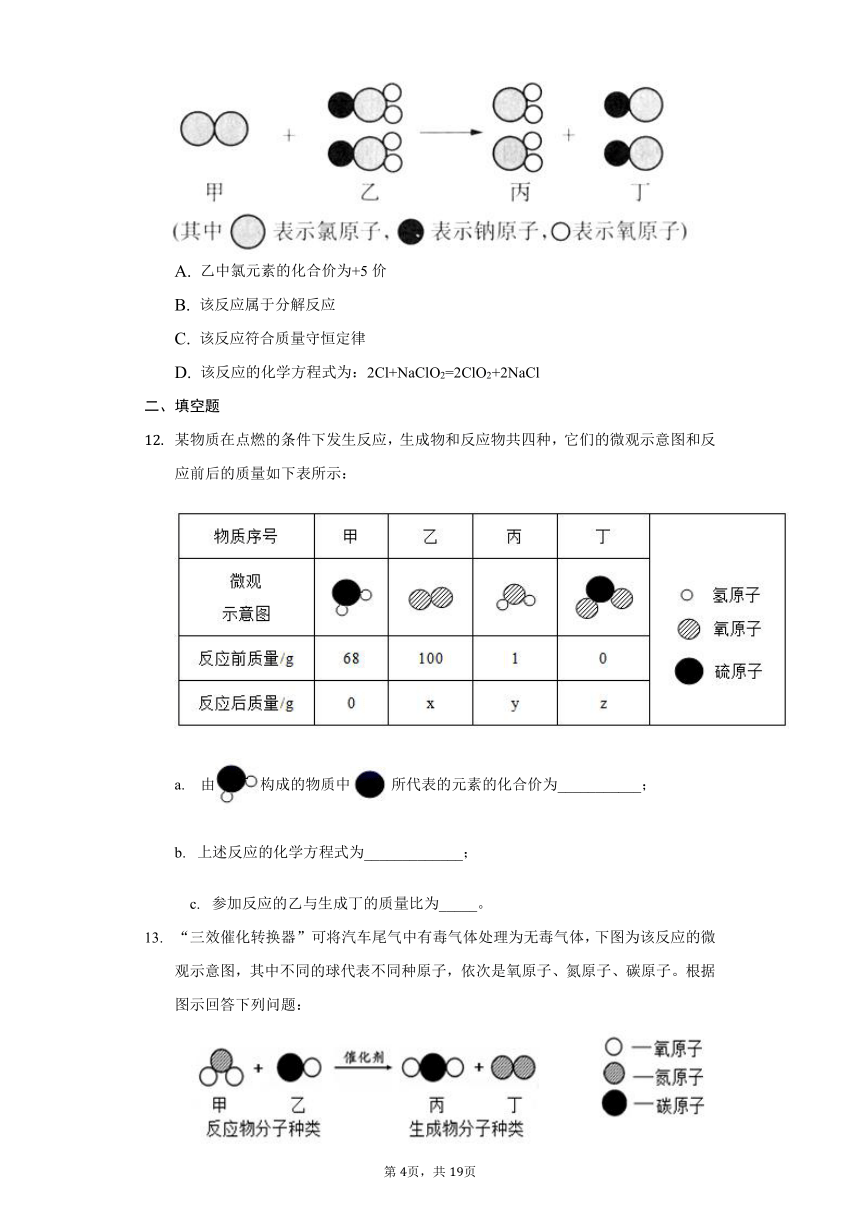
我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如下图所示。下列说法正确的是(???
)
A.
乙中氯元素的化合价为+5价
B.
该反应属于分解反应
C.
该反应符合质量守恒定律
D.
该反应的化学方程式为:2Cl+NaClO2=2ClO2+2NaCl
二、填空题
某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示:
a.??
由构成的物质中所代表的元素的化合价为___________;
b.?
上述反应的化学方程式为_____________;
?
?c.?
参加反应的乙与生成丁的质量比为_____。
“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体,下图为该反应的微观示意图,其中不同的球代表不同种原子,依次是氧原子、氮原子、碳原子。根据图示回答下列问题:
(1)该化学反应________化合反应(填“属于”或“不属于”);
(2)写出该反应的化学方程式:_________________________________;
(3)甲、乙、丙、丁四种物质中属于单质的是_______________(写化学式);
(4)该反应中甲、乙的分子个数比为__________;
(
5)上述反应中,不发生改变的粒子是______________(填“分子”或“原子”)。
“宏观和微观相结合”“定性研究和定量研究相结合”是研究化学反应的重要方法.以下是运用上述方法认识红磷燃烧反应的过程,请完成下列问题.
(1)写出红磷燃烧的化学方程式______;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的分子,即______;
(3)定量认识,从宏观角度讲,______的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧______的总个数在反应前后保持不变;
(4)现有62g红磷,要使其完全燃烧,至少需要______g氧气.
已知相同条件下,气体的体积比等于其分子个数比。一定条件下,将一定量的丙烷(C3H8)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质
丙烷
氧气
水
二氧化碳
一氧化碳
反应前质量/g
4.4
12.8
0
0
0
反应后质量/g
0
0
7.2
4.4
a
(1)相同条件下该反应生成的CO与CO2的质量比为_______;体积比为________。
(2)若要使一氧化碳充分燃烧(已知:),还需增加的氧气的质量为__________。
(3)写出丙烷完全燃烧后生成二氧化碳和水的化学方程式:________________。
三、分析计算题
一定条件下,4.8g
CH4与16.0g
O2恰好完全反应,生成10.8g
H2O、4.4g
CO2和物质X。则X的质量为_____________g;该反应方程式中O2与X化学计量数之比为____________。
4.2g
C2H4在O2中燃烧,生成CO的同时得到8.8
g
CO2和5.4
g
H2O。该反应的化学方程式为_________________________________。
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速完全分解生成两种单质。
(1)若因为撞击在气囊内产生N2的质量为21g,则分解的叠氮化钠质量为______g。
(2)2NaN3+______=Na2O+3N2↑+Cu(填化学式)。
(3)已知Cu+Cl2CuCl2,根据(2)(3)中的化学方程式,130gNaN3与足量的反应物完全反应能得到______gCuCl2。
四、实验探究题
(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量为_____,该物质中一定含有_____元素(填元素符号),各元素的质量比为_____
。
(2)配平下列化学方程式(化学计量数为1也要填入“_____”上)
①
_____Al
+_____H2SO4=_____Al2(SO4)3+
_____H2↑
②
_____Fe2O3
+
_____C_____Fe
+
_____CO2↑
③
_____NH3+_____O2=_____NO
+
_____+H2O
④
_____C2H4
+
_____O2_____H2O
+
_____CO2
(3)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图:
①根据实验目的,小李必须测量的数据是_____
A
锥形瓶质量
B
气球质量
C
反应前整个反应装置(包括里边的物质)质量
D
反应后整个反应装置(包括里边的物质)质量
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向_____倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因_____。
③另取一定量的块状大理石与稀盐酸反应,充分反应后得到气体
0.44
g,请计算参与反应的碳酸钙的质量_____。
答案和解析
1.【答案】D
【解答】
由图可知,该反应的化学方程式为:2C2H2+5O24CO2+2H2O。
A.该反应是乙炔的燃烧,燃烧时能放出大量的热,故A说法正确;?
B.乙炔中各元素质量比为:(12×2):(1×2)=12︰1,故B说法正确;
C.由化学变化的实质可知,化学反应前后原子的种类和数目不变,故C说法正确;?
D.由方程式可知,该反应中,参加反应的反应物分子个数比为2︰5,故D说法错误。
?故选D。
2.【答案】D
【解答】
由化学反应的微观过程及物质的微观构成可知,反应物是二氧化碳和氢气;根据质量守恒定律:化学反应前后原子的种类和个数不变,可知丁是水,即生成物是CH3OH和水,则反应的方程式是:CO2+3H2CH3OH+H2O,则:
A.氧化物是由两种元素组成且其中一种是氧元素的化合物,甲是CO2,CO2???????是由碳元素和氧元素组成的化合物,属于氧化物,故说法正确;
B.由物质的微观构成可知,物质丙的化学式是CH3OH,故说法正确;
C.由反应的方程式可知,乙、丁两种物质的化学计量数之比为3:1,故说法正确;
D.物质丁的化学式是H2O,故说法错误。
3.【答案】D
【解答】
由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:;
A.由化学方程式可知,反应前后分子的总数不变,故A正确;
B.由化学方程式可知,甲是CO,丙是CO2,甲与丙的质量比是28:44,所以反应每消耗28g甲,可生成44g丙,故B正确;
C分析图示信息可知,不同的催化剂所吸附的微粒种类不同,该过程体现了催化剂吸附微粒的选择性,故C正确;
D.分析图示信息可知,综合该过程1、2来看,反应过程中,每消耗1个甲分子,同时消耗2个乙分子,故D错误。
故选D。
4.【答案】D
【解答】
由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:CO+H2OCO2+H2;
A.由化学方程式可知,反应前后分子的总数不变,故A正确;
B.由化学方程式可知,甲是CO,丙是CO2,甲与丙的质量比是28:44,所以反应每消耗28g甲,可生成44g丙,故B正确;
C分析图示信息可知,不同的催化剂所吸附的微粒种类不同,该过程体现了催化剂吸附微粒的选择性,故C正确;
D.分析图示信息可知,综合该过程1、2来看,反应过程中,每消耗1个甲分子,同时消耗2个乙分子,故D错误。
故选D。
5.【答案】C
【解答】
由变化过程的微粒结构以及变化过程可知该反应的方程式为:。
A.反应前化合物中的氢元素变成了单质中的氢元素,化合价由+1价变成0价,故A说法正确;
B.根据化学反应前后原子的种类和个数都不变,可知产生氢气分子的个数是3,因此x=3,故B说法正确;
C.该反应中的CH4分子,CO分子和H2分子共有三种微粒具有可燃性,故C说法不正确;
D.反应中甲烷分子和一氧化碳分子的个数比是1:1,因此质量比为:16:28=4:7,故D说法正确。?
故选C。
6.【答案】D
【解答】
根据模拟图,该反应的化学方程式为,由此可知A是甲烷,B是氧气,C是二氧化碳,D是水。
A.此反应中只有2中氧化物即二氧化碳和水,故A说法不正确;
B.根据质量守恒定律可知,化学反应前后,分子的种类一定改变,分子的个数不一定改变,故B说法不正确;
C.B是氧气,氧元素的化合价为0,C是二氧化碳,其中氧元素的化合价为-2价,故C说法不正确;?
D.根据化学方程式的含义,可求出反应物A和B的质量比,故D说法正确。
故选D。
7.【答案】D
【解答】
A.该反应由两种物质生成了一种物质,属于化合反应,故A正确;
B.由微粒的变化可知,反应前后原子的种类、个数都不变,故B正确;
C.甲是二氧化碳,乙是甲烷,甲和乙的质量比为44:16=11:4,故C正确;
D.由方程式可知,甲、乙、丙三种物质的分子数比为1:1:2,故D错误。
故选D。
8.【答案】D
【解答】
由反应的微观示意图和质量守恒定律可知,该反应是碳和氨气在一定条件下反应生成了氮气和甲烷,反应的化学方程式是:3C+4NH32N2+3CH4。
A.由微粒的变化可知,化学反应前后原子的种类、个数、质量均保持不变,故A正确;
B.由图示可知,W为甲烷,碳元素的质量分数为:=75%,故B正确;
C.由上述化学方程式可知,参加反应的X、Y两物质的粒子个数比为3:4,故C正确;
D.由质量守恒定律可知,化学反应前后元素的种类没有发生变化,故D错误。
故选D。
9.【答案】C
【解析】
【分析】
本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。
【解答】
A.由丙烷(C3H8)的化学式可知,甲中碳、氢元素质量比,故A错误;
B.由微观示意图可知,乙由氧元素组成,而丙由碳元素和氧元素组成,二者元素组成不相同,故B错误;
C.丙烷与氧气在点燃条件下生成二氧化碳和水,化学方程式为:,每44份质量的丙烷完全燃烧至少需要160份质量的氧气,所以44g甲完全燃烧至少需160g乙,故C正确;
D.根据微观反应模型图可知,该反应的化学方程式为:,则生成丙与丁的分子个数比为3:4,而不是1:1,故D错误。
故选C。
10.【答案】D
【解析】
【分析】
本题考查对微观示意图及粒子构成模拟图的认识、氧化物的概念、质量守恒定律的理解和化学方程式的书写。解题关键是理解微观示意图及粒子构成模拟图、氧化物的概念、质量守恒定律的内容和解读和掌握化学方程式的书写。
【解答】
由反应的微观示意图可以看出,反应物是NH3和NO,生成物是N2和H2O,所以化学反应方程式为:6NO+4NH35N2+6H2O。
A.氧化物是由两种元素组成且其中一种元素是氧元素的化合物,所以该反应中的甲是一氧化氮属于氧化物,丁是水属于氧化物,乙是氨气不属于氧化物,故A错误;
B.由反应的微观示意图可以看出,反应物是NH3和NO,生成物是N2和H2O,所以化学反应方程式为:6NO+4NH35N2+6H2O,故B错误;
C.甲物质是一氧化氮,是由一氧化氮分子构成的,每个一氧化氮分子是由一个氧原子和一个氮原子构成,故C错误;
D.由质量守恒定律可知,化学反应前后原子的种类与数目保持不变,故D正确。
故选D。
11.【答案】C
【解析】
【分析】
本题考查物质反应的微观模型示意图。
A.根据物质的分子构成,判断物质的化学式;利用化合物中元素的化合价的代数和为零计算出要求元素的化合价;
B.分解反应是一种物质生成两种或者两种以上物质的反应,可根据反应物、生成物的种类判断;
C.反应前后,原子的种类和个数不变是物质符合质量守恒定律的原因;根据反应的微观示意图,判断反应前后原子的变化情况;
D.根据反应中各种物质的分子构成及参加反应的分数个数,推断反应发生的实际情况,完成反应的化学方程式的书写。
【解答】
A.物质乙的分子由1个钠原子、1个氯原子和2个氧原子构成,则乙物质的化学式为NaClO2;设其中氯元素的化合价为x,则有(+1)+x+(-2)×2=0,解得x=+3,故A不正确;
B.该反应由两种物质生成另外的两种物质,而分解反应的反应物是一种,故B不正确;
C.反应前的三个分子中共含有4个氯原子、4个氧原子和2个钠原子,反应后生成的三个化合物的分子中仍含这三种元素的10个原子;因此反应前后原子种类、个数不变反应遵守质量守恒定律,故C正确;
D.甲物质的分子由两个氯原子构成,物质甲的化学式应写为Cl2;物质乙、丙、丁的化学式分别为NaClO2、ClO2、NaCl,并且反应中四种物质的分子个数比为=1:2:2:2,因此该反应的化学式应为:Cl2+2NaClO2═2ClO2+2NaCl,故D不正确。
故选C。
12.【答案】a.
-2
b.
2H2S+2O2SO2+2H2O
c.
3:
4
【解析】
【分析】
要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识。然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。根根据题中的图例进行判断该物质的化学式;根据图示结合含氧化合物的组成来判断;根据反应前后原子的种类不变来书写出该反应的化学方程式;根据方程式可进行有关的计算。
【解答】
a.?由图示可知甲为H2S,设硫元素的化合价为x,则(+1)×2+x=0,x=-2;
b.?由图中微粒的变化可知,在化学反应前后发生改变的微粒是分子,上述反应为硫化氢和氧气在点燃的条件下反应生成水和二氧化硫,反应的化学方程式为:2H2S+3O22H2O+2SO2;
c.?由表中的数据可知,参加反应甲的质量为68g,
设参加反应的氧气的质量为m、生成的水的质量为n、生成的二氧化硫的质量为p。
2H2S+3O22H2O+2SO2;
?68???????96????????????36?????
128
68g?????
m?
?
?
?
?
?
?n???????
?p
===,m=96g,n=36g,p=128g
由上述计算可知:参加反应的乙与生成的丁的质量比为96g:128g=3:4。
13.【答案】(1)不属于
?
(2)
(3)N2
(4)1:2
(5)原子
【解析】
【分析】
本题考查学生对反应的微观示意图含义的理解,分子由原子构成,由同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子。
【解答】
(1)由反应的微观示意图可知,该反应的生成物为两种,不属于化合反应;
(2)由微观粒子示意图可知,该反应是二氧化氮和一氧化碳在催化剂作用下反应生成二氧化碳和氮气,反应的化学方程式为;
(3)单质是由一种元素组成的纯净物,由方程式可知,甲、乙、丙、丁四种物质中属于单质的是氮气,化学式是N2;
(4)由反应的化学方程式可知,每2个甲分子和4个乙分子反应生成4个二氧化碳分子和1个氮气分子,则参加反应的甲、乙分子个数比为2:4=1:2;
(5)由微粒的变化可知,反应前后不发生改变的粒子是原子。
14.【答案】(1)4P+5O2?2P2O5
(2)五氧化二磷分子
(3)参加反应的红磷和氧气;原子
(4)80
【解析】
【分析】
本题主要考查化学方程式的含义、书写以及计算,难度不大。
【解答】
(1)红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的分子,即五氧化二磷分子;
(3)定量认识,从宏观角度讲,参加反应的红磷和氧气的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧原子的总个数在反应前后保持不变(4)设62g红磷完全燃烧需要氧气的质量为x,
4P+5O22P2O5
124
160
62g??
x
=
x=80g;
故答案为:(1)4P+5O2?2P2O5
(2)五氧化二磷分子
(3)参加反应的红磷和氧气;原子
(4)80
15.【答案】(1)14:11;?2:1
(2)3.2
g
(3)C3H8+5O23CO2+4H2O
【解析】
【分析】
本题考查质量守恒定律的应用,根据表格分析及质量守恒定律计算即可,本题难点在相同条件下,气体的体积比等于分子个数比。
【解答】
(1)根据物质反应前后的变化可知,物质x和氧气在变化中全部消耗完,产生了水、二氧化碳和一氧化碳,根据化学变化过程中,参与反应的反应物的质量之和等于生成物的质量之和,列式为:4.4+12.8=7.2+4.4+a,解得a=5.6;故反应生成的CO与CO2的质量比为:5.6:4.4=14:11,相同条件下气体的体积比等于分子个数比等于=2:1;
(2)若物质X充分燃烧,生成物只有水和二氧化碳,故需要氧气的量为5.6g一氧化碳全部转化为二氧化碳所需的氧气的量,设需要的氧气的量为m,则根据化学方程式计算:
2CO+O22CO2
?56????32
5.6g??
m
列关系式为:
解得:m=3.2g;
(3)丙烷完全燃烧后生成二氧化碳和水,化学方程式为:C3H8+5O23CO2+4H2O。
16.【答案】5.6;5:2
【解析】
【分析】
本题难度不大,根据反应前后质量总和不变列等式计算出X的质量;根据质量比结合相对分子质量进行分析。
【解答】
设X的质量为a,反应前后质量总和不变列等式:4.8g+16.0g=10.8g+4.4g+a,解得a=5.6g;甲烷不完全燃烧时会产生一氧化碳,所以X是一氧化碳;甲烷不完全燃烧的化学方程式中各物质的化学计量数之比为::::=3:5:1:6:2,将其配平可得:3CH4+5O2CO2+6H2O+2CO,所以该反应方程式中O2与X化学计量数之比为5:2。
故答案为:5.6;5:2。
17.【答案】3C2H4+8O22CO+4CO2+6H2O
【解析】
【分析】
化学反应前后元素的种类和质量均不变,生成物一氧化碳和二氧化碳中的碳元素质量和等于参加反应的乙烯中的碳元素质量,据此由化学式的计算得出生成一氧化碳的质量,由质量守恒定律得出参加反应的氧气质量,再根据化学方程式中各物质的计量数之比等于各物质质量与相对分子质量之比,即可得出该化学反应方程式中各物质的计量数.
【解答】
4.2gC2H4中碳元素质量为:,8.8gCO2中碳元素质量为:,则反应生成一氧化碳中的碳元素质量为:3.6g-2.4g=1.2g,由此可知,生成一氧化碳的质量为:,由质量守恒定律可得,参加反应的氧气质量为:2.8g+8.8g+5.4g-4.2g=12.8g,则该化学方程式中乙烯、氧气、一氧化碳、二氧化碳和水的配平计量数比为:,所以该反应的化学方程式为:3C2H4+8O22CO+4CO2+6H2O.
18.【答案】(1)32.5
(2)CuO
?(3)135
【解析】
【分析】
(1)根据信息书写对应的化学方程式,然后根据氮气的质量和对应的化学方程式求算分解的叠氮化钠的质量;
(2)根据化学方程式左右两边各原子个数相同分析解答;
(3)根据化学反应中元素种类和质量均不变,结合关系式求算130g叠氮化钠对应的氯化铜的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
【解答】
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速完全分解生成两种单质,为氮气和钠,对应的化学方程式为2NaN32Na+3N2↑;
设生成21g氮气消耗的叠氮化钠的质量为x
2NaN32Na+3N2↑
130???????????????????????
84
x??????????????????????????
21g
=
x=32.5g
(2)根据质量守恒定律,结合给出的关系可知,2NaN3+CuO=Na2O+3N2↑+Cu;
(3)设130gNaN3与足量的反应物完全反应能得到的CuCl2的质量为y。
根据2NaN3+CuO=Na2O+3N2↑+Cu和Cu+Cl2CuCl2,可得关系为
2NaN3?∽
Cu
∽
CuCl2,
130?
?
?
?
?
?
?
?
?
?
?135
130g?
?
?
?
?
?
?
?
?
?
y
=
y=135g
故答案为:(1)32.5;
(2)CuO;
(3)135。
19.【答案】(1)4.8g;C、H、O;12:3:8;
(2)①2;3;1;3;
②2;3;4;3;
③4?;5;4;6;
④1;3;2;2;
(3)①CD;
②右;气球鼓起后有向上的浮力作用;
???????③1g
【解析】
【分析】
本题考查的知识点较多,解题时根据质量守恒定律及其应用、有关化学式的计算、化学方程式的配平方法、质量守恒定律的验证、根据化学方程式的计算来分析解答即可。
【解答】
(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量=4.4g+2.7g-2.3g=4.8g;二氧化碳中氧元素质量与水中氧元素质量之和为,大于氧气质量,则该物质中一定含有碳(C)、氢(H)、氧(O)三种元素,二氧化碳中碳元素质量为:4.4g-3.2g=1.2g;水中氢元素质量为:2.7g-2.4g=0.3g,氧元素质量为5.6g-4.8g=0.8g;则碳、氢、氧三种元素质量比1.2g:0.3g:0.8g=12:3:8;
(2)①
2Al
+3H2SO4=1Al2(SO4)3+
3H2↑;
②2Fe2O3?+3C4Fe
+3CO2↑;
③
4NH3+5O2=4NO?+
6H2O;
④1C2H4?+
3O22H2O
+
2CO2;
(3)用盐酸与碳酸钙粉末反应验证质量守恒定律,须测量的数据是:
C
反应前整个反应装置(包括里边的物质)质量
D
反应后整个反应装置(包括里边的物质)质量
故选:CD。
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。分析原因:气球鼓起后有向上的浮力作用;
③解:设参与反应的碳酸钙的质量x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?44
?
?
x
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?0.44g
x=1g
即参加反应碳酸钙的质量为1g。
第2页,共2页
第1页,共1页
一、选择题
中国制造、中国创造、中国建造共同发力,焊接、切割技术世界一流。生活中常用乙炔焰来切割金属,如图为乙炔燃烧示意图,下列说法中错误的是()
A.
该反应能放出大量的热
B.
乙炔中各元素质量比为12:1
C.
化学反应前后原子的种类和数目不变
D.
该反应中,参加反应的反应物分子个数比为1:1
某化学反应的微观过程如图所示,下列说法中错误的是
A.
甲属于氧化物
B.
物质丙的化学式是
C.
反应中,乙、丁两种物质的化学计量数之比为3:1
D.
物质丁的化学式是CO
我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120
℃时进行,反应过程如图所示。下列说法错误的是(
)
A.
反应前后分子的总数不变
B.
反应每消耗28
g甲,可生成44
g丙
C.
该过程体现了催化剂吸附微粒的选择性
D.
参加反应的甲、乙分子个数比为1:2
我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是(?
?
?)
A.
反应前后分子的总数不变
B.
反应每消耗28g甲,可生成44g丙
C.
该过程体现了催化剂吸附微粒的选择性
D.
反应过程中,每消耗1个甲分子,同时消耗1个乙分子
下图为某化学反应的微观示意图,下列说法中不正确的是()
A.
反应前后氢元素的化合价发生了改变
B.
图示中x的数值为3
C.
四种粒子代表的物质中共有两种具有可燃性
D.
反应中甲、丙两物质的质量比为4:7
已知反应前后分子变化的微观示意图如下所示。下列说法正确的是
A.
此反应中有三种氧化物
B.
反应前后分子的种类和个数不变
C.
B与C物质中同种元素的化合价相同
D.
此反应中A
和B的质量比是1:4
从如图某化学反应的微观示意图中,获得的信息不正确的是( )
A.
该反应是化合反应
B.
反应前后原子的种类、个数都不变
C.
甲和乙的质量比为11:4
D.
甲乙丙三种物质的分子数比为1:1:1
科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是( )
A.
化学反应前后原子的种类、个数、质量均保持不变
B.
W中碳元素的质量分数为75%
C.
参加反应的X、Y两物质的粒子个数比为3:4
D.
化学反应前后元素的种类发生了变化
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如图。下列说法正确的是()
A.
甲中碳、氢元素质量比为3:8
B.
乙和丙的元素组成相同
C.
44g甲完全燃烧至少需160g乙
D.
生成的丙与丁的分子个数比为1:1
下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是???
A.
乙、丁属于氧化物
B.
该反应的化学方程式为
C.
甲物质由一个氧原子和一个氮原子构成
D.
反应前后,原子种类、原子数目不变
我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如下图所示。下列说法正确的是(???
)
A.
乙中氯元素的化合价为+5价
B.
该反应属于分解反应
C.
该反应符合质量守恒定律
D.
该反应的化学方程式为:2Cl+NaClO2=2ClO2+2NaCl
二、填空题
某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示:
a.??
由构成的物质中所代表的元素的化合价为___________;
b.?
上述反应的化学方程式为_____________;
?
?c.?
参加反应的乙与生成丁的质量比为_____。
“三效催化转换器”可将汽车尾气中有毒气体处理为无毒气体,下图为该反应的微观示意图,其中不同的球代表不同种原子,依次是氧原子、氮原子、碳原子。根据图示回答下列问题:
(1)该化学反应________化合反应(填“属于”或“不属于”);
(2)写出该反应的化学方程式:_________________________________;
(3)甲、乙、丙、丁四种物质中属于单质的是_______________(写化学式);
(4)该反应中甲、乙的分子个数比为__________;
(
5)上述反应中,不发生改变的粒子是______________(填“分子”或“原子”)。
“宏观和微观相结合”“定性研究和定量研究相结合”是研究化学反应的重要方法.以下是运用上述方法认识红磷燃烧反应的过程,请完成下列问题.
(1)写出红磷燃烧的化学方程式______;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的分子,即______;
(3)定量认识,从宏观角度讲,______的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧______的总个数在反应前后保持不变;
(4)现有62g红磷,要使其完全燃烧,至少需要______g氧气.
已知相同条件下,气体的体积比等于其分子个数比。一定条件下,将一定量的丙烷(C3H8)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质
丙烷
氧气
水
二氧化碳
一氧化碳
反应前质量/g
4.4
12.8
0
0
0
反应后质量/g
0
0
7.2
4.4
a
(1)相同条件下该反应生成的CO与CO2的质量比为_______;体积比为________。
(2)若要使一氧化碳充分燃烧(已知:),还需增加的氧气的质量为__________。
(3)写出丙烷完全燃烧后生成二氧化碳和水的化学方程式:________________。
三、分析计算题
一定条件下,4.8g
CH4与16.0g
O2恰好完全反应,生成10.8g
H2O、4.4g
CO2和物质X。则X的质量为_____________g;该反应方程式中O2与X化学计量数之比为____________。
4.2g
C2H4在O2中燃烧,生成CO的同时得到8.8
g
CO2和5.4
g
H2O。该反应的化学方程式为_________________________________。
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速完全分解生成两种单质。
(1)若因为撞击在气囊内产生N2的质量为21g,则分解的叠氮化钠质量为______g。
(2)2NaN3+______=Na2O+3N2↑+Cu(填化学式)。
(3)已知Cu+Cl2CuCl2,根据(2)(3)中的化学方程式,130gNaN3与足量的反应物完全反应能得到______gCuCl2。
四、实验探究题
(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量为_____,该物质中一定含有_____元素(填元素符号),各元素的质量比为_____
。
(2)配平下列化学方程式(化学计量数为1也要填入“_____”上)
①
_____Al
+_____H2SO4=_____Al2(SO4)3+
_____H2↑
②
_____Fe2O3
+
_____C_____Fe
+
_____CO2↑
③
_____NH3+_____O2=_____NO
+
_____+H2O
④
_____C2H4
+
_____O2_____H2O
+
_____CO2
(3)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图:
①根据实验目的,小李必须测量的数据是_____
A
锥形瓶质量
B
气球质量
C
反应前整个反应装置(包括里边的物质)质量
D
反应后整个反应装置(包括里边的物质)质量
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向_____倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因_____。
③另取一定量的块状大理石与稀盐酸反应,充分反应后得到气体
0.44
g,请计算参与反应的碳酸钙的质量_____。
答案和解析
1.【答案】D
【解答】
由图可知,该反应的化学方程式为:2C2H2+5O24CO2+2H2O。
A.该反应是乙炔的燃烧,燃烧时能放出大量的热,故A说法正确;?
B.乙炔中各元素质量比为:(12×2):(1×2)=12︰1,故B说法正确;
C.由化学变化的实质可知,化学反应前后原子的种类和数目不变,故C说法正确;?
D.由方程式可知,该反应中,参加反应的反应物分子个数比为2︰5,故D说法错误。
?故选D。
2.【答案】D
【解答】
由化学反应的微观过程及物质的微观构成可知,反应物是二氧化碳和氢气;根据质量守恒定律:化学反应前后原子的种类和个数不变,可知丁是水,即生成物是CH3OH和水,则反应的方程式是:CO2+3H2CH3OH+H2O,则:
A.氧化物是由两种元素组成且其中一种是氧元素的化合物,甲是CO2,CO2???????是由碳元素和氧元素组成的化合物,属于氧化物,故说法正确;
B.由物质的微观构成可知,物质丙的化学式是CH3OH,故说法正确;
C.由反应的方程式可知,乙、丁两种物质的化学计量数之比为3:1,故说法正确;
D.物质丁的化学式是H2O,故说法错误。
3.【答案】D
【解答】
由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:;
A.由化学方程式可知,反应前后分子的总数不变,故A正确;
B.由化学方程式可知,甲是CO,丙是CO2,甲与丙的质量比是28:44,所以反应每消耗28g甲,可生成44g丙,故B正确;
C分析图示信息可知,不同的催化剂所吸附的微粒种类不同,该过程体现了催化剂吸附微粒的选择性,故C正确;
D.分析图示信息可知,综合该过程1、2来看,反应过程中,每消耗1个甲分子,同时消耗2个乙分子,故D错误。
故选D。
4.【答案】D
【解答】
由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:CO+H2OCO2+H2;
A.由化学方程式可知,反应前后分子的总数不变,故A正确;
B.由化学方程式可知,甲是CO,丙是CO2,甲与丙的质量比是28:44,所以反应每消耗28g甲,可生成44g丙,故B正确;
C分析图示信息可知,不同的催化剂所吸附的微粒种类不同,该过程体现了催化剂吸附微粒的选择性,故C正确;
D.分析图示信息可知,综合该过程1、2来看,反应过程中,每消耗1个甲分子,同时消耗2个乙分子,故D错误。
故选D。
5.【答案】C
【解答】
由变化过程的微粒结构以及变化过程可知该反应的方程式为:。
A.反应前化合物中的氢元素变成了单质中的氢元素,化合价由+1价变成0价,故A说法正确;
B.根据化学反应前后原子的种类和个数都不变,可知产生氢气分子的个数是3,因此x=3,故B说法正确;
C.该反应中的CH4分子,CO分子和H2分子共有三种微粒具有可燃性,故C说法不正确;
D.反应中甲烷分子和一氧化碳分子的个数比是1:1,因此质量比为:16:28=4:7,故D说法正确。?
故选C。
6.【答案】D
【解答】
根据模拟图,该反应的化学方程式为,由此可知A是甲烷,B是氧气,C是二氧化碳,D是水。
A.此反应中只有2中氧化物即二氧化碳和水,故A说法不正确;
B.根据质量守恒定律可知,化学反应前后,分子的种类一定改变,分子的个数不一定改变,故B说法不正确;
C.B是氧气,氧元素的化合价为0,C是二氧化碳,其中氧元素的化合价为-2价,故C说法不正确;?
D.根据化学方程式的含义,可求出反应物A和B的质量比,故D说法正确。
故选D。
7.【答案】D
【解答】
A.该反应由两种物质生成了一种物质,属于化合反应,故A正确;
B.由微粒的变化可知,反应前后原子的种类、个数都不变,故B正确;
C.甲是二氧化碳,乙是甲烷,甲和乙的质量比为44:16=11:4,故C正确;
D.由方程式可知,甲、乙、丙三种物质的分子数比为1:1:2,故D错误。
故选D。
8.【答案】D
【解答】
由反应的微观示意图和质量守恒定律可知,该反应是碳和氨气在一定条件下反应生成了氮气和甲烷,反应的化学方程式是:3C+4NH32N2+3CH4。
A.由微粒的变化可知,化学反应前后原子的种类、个数、质量均保持不变,故A正确;
B.由图示可知,W为甲烷,碳元素的质量分数为:=75%,故B正确;
C.由上述化学方程式可知,参加反应的X、Y两物质的粒子个数比为3:4,故C正确;
D.由质量守恒定律可知,化学反应前后元素的种类没有发生变化,故D错误。
故选D。
9.【答案】C
【解析】
【分析】
本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。
【解答】
A.由丙烷(C3H8)的化学式可知,甲中碳、氢元素质量比,故A错误;
B.由微观示意图可知,乙由氧元素组成,而丙由碳元素和氧元素组成,二者元素组成不相同,故B错误;
C.丙烷与氧气在点燃条件下生成二氧化碳和水,化学方程式为:,每44份质量的丙烷完全燃烧至少需要160份质量的氧气,所以44g甲完全燃烧至少需160g乙,故C正确;
D.根据微观反应模型图可知,该反应的化学方程式为:,则生成丙与丁的分子个数比为3:4,而不是1:1,故D错误。
故选C。
10.【答案】D
【解析】
【分析】
本题考查对微观示意图及粒子构成模拟图的认识、氧化物的概念、质量守恒定律的理解和化学方程式的书写。解题关键是理解微观示意图及粒子构成模拟图、氧化物的概念、质量守恒定律的内容和解读和掌握化学方程式的书写。
【解答】
由反应的微观示意图可以看出,反应物是NH3和NO,生成物是N2和H2O,所以化学反应方程式为:6NO+4NH35N2+6H2O。
A.氧化物是由两种元素组成且其中一种元素是氧元素的化合物,所以该反应中的甲是一氧化氮属于氧化物,丁是水属于氧化物,乙是氨气不属于氧化物,故A错误;
B.由反应的微观示意图可以看出,反应物是NH3和NO,生成物是N2和H2O,所以化学反应方程式为:6NO+4NH35N2+6H2O,故B错误;
C.甲物质是一氧化氮,是由一氧化氮分子构成的,每个一氧化氮分子是由一个氧原子和一个氮原子构成,故C错误;
D.由质量守恒定律可知,化学反应前后原子的种类与数目保持不变,故D正确。
故选D。
11.【答案】C
【解析】
【分析】
本题考查物质反应的微观模型示意图。
A.根据物质的分子构成,判断物质的化学式;利用化合物中元素的化合价的代数和为零计算出要求元素的化合价;
B.分解反应是一种物质生成两种或者两种以上物质的反应,可根据反应物、生成物的种类判断;
C.反应前后,原子的种类和个数不变是物质符合质量守恒定律的原因;根据反应的微观示意图,判断反应前后原子的变化情况;
D.根据反应中各种物质的分子构成及参加反应的分数个数,推断反应发生的实际情况,完成反应的化学方程式的书写。
【解答】
A.物质乙的分子由1个钠原子、1个氯原子和2个氧原子构成,则乙物质的化学式为NaClO2;设其中氯元素的化合价为x,则有(+1)+x+(-2)×2=0,解得x=+3,故A不正确;
B.该反应由两种物质生成另外的两种物质,而分解反应的反应物是一种,故B不正确;
C.反应前的三个分子中共含有4个氯原子、4个氧原子和2个钠原子,反应后生成的三个化合物的分子中仍含这三种元素的10个原子;因此反应前后原子种类、个数不变反应遵守质量守恒定律,故C正确;
D.甲物质的分子由两个氯原子构成,物质甲的化学式应写为Cl2;物质乙、丙、丁的化学式分别为NaClO2、ClO2、NaCl,并且反应中四种物质的分子个数比为=1:2:2:2,因此该反应的化学式应为:Cl2+2NaClO2═2ClO2+2NaCl,故D不正确。
故选C。
12.【答案】a.
-2
b.
2H2S+2O2SO2+2H2O
c.
3:
4
【解析】
【分析】
要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识。然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。根根据题中的图例进行判断该物质的化学式;根据图示结合含氧化合物的组成来判断;根据反应前后原子的种类不变来书写出该反应的化学方程式;根据方程式可进行有关的计算。
【解答】
a.?由图示可知甲为H2S,设硫元素的化合价为x,则(+1)×2+x=0,x=-2;
b.?由图中微粒的变化可知,在化学反应前后发生改变的微粒是分子,上述反应为硫化氢和氧气在点燃的条件下反应生成水和二氧化硫,反应的化学方程式为:2H2S+3O22H2O+2SO2;
c.?由表中的数据可知,参加反应甲的质量为68g,
设参加反应的氧气的质量为m、生成的水的质量为n、生成的二氧化硫的质量为p。
2H2S+3O22H2O+2SO2;
?68???????96????????????36?????
128
68g?????
m?
?
?
?
?
?
?n???????
?p
===,m=96g,n=36g,p=128g
由上述计算可知:参加反应的乙与生成的丁的质量比为96g:128g=3:4。
13.【答案】(1)不属于
?
(2)
(3)N2
(4)1:2
(5)原子
【解析】
【分析】
本题考查学生对反应的微观示意图含义的理解,分子由原子构成,由同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子。
【解答】
(1)由反应的微观示意图可知,该反应的生成物为两种,不属于化合反应;
(2)由微观粒子示意图可知,该反应是二氧化氮和一氧化碳在催化剂作用下反应生成二氧化碳和氮气,反应的化学方程式为;
(3)单质是由一种元素组成的纯净物,由方程式可知,甲、乙、丙、丁四种物质中属于单质的是氮气,化学式是N2;
(4)由反应的化学方程式可知,每2个甲分子和4个乙分子反应生成4个二氧化碳分子和1个氮气分子,则参加反应的甲、乙分子个数比为2:4=1:2;
(5)由微粒的变化可知,反应前后不发生改变的粒子是原子。
14.【答案】(1)4P+5O2?2P2O5
(2)五氧化二磷分子
(3)参加反应的红磷和氧气;原子
(4)80
【解析】
【分析】
本题主要考查化学方程式的含义、书写以及计算,难度不大。
【解答】
(1)红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5;
(2)定性认识,从宏观角度讲,该反应产生了新的物质五氧化二磷;从微观角度讲,该反应产生了新的分子,即五氧化二磷分子;
(3)定量认识,从宏观角度讲,参加反应的红磷和氧气的总质量等于反应后生成的P2O5的质量;从微观角度讲,磷、氧原子的总个数在反应前后保持不变(4)设62g红磷完全燃烧需要氧气的质量为x,
4P+5O22P2O5
124
160
62g??
x
=
x=80g;
故答案为:(1)4P+5O2?2P2O5
(2)五氧化二磷分子
(3)参加反应的红磷和氧气;原子
(4)80
15.【答案】(1)14:11;?2:1
(2)3.2
g
(3)C3H8+5O23CO2+4H2O
【解析】
【分析】
本题考查质量守恒定律的应用,根据表格分析及质量守恒定律计算即可,本题难点在相同条件下,气体的体积比等于分子个数比。
【解答】
(1)根据物质反应前后的变化可知,物质x和氧气在变化中全部消耗完,产生了水、二氧化碳和一氧化碳,根据化学变化过程中,参与反应的反应物的质量之和等于生成物的质量之和,列式为:4.4+12.8=7.2+4.4+a,解得a=5.6;故反应生成的CO与CO2的质量比为:5.6:4.4=14:11,相同条件下气体的体积比等于分子个数比等于=2:1;
(2)若物质X充分燃烧,生成物只有水和二氧化碳,故需要氧气的量为5.6g一氧化碳全部转化为二氧化碳所需的氧气的量,设需要的氧气的量为m,则根据化学方程式计算:
2CO+O22CO2
?56????32
5.6g??
m
列关系式为:
解得:m=3.2g;
(3)丙烷完全燃烧后生成二氧化碳和水,化学方程式为:C3H8+5O23CO2+4H2O。
16.【答案】5.6;5:2
【解析】
【分析】
本题难度不大,根据反应前后质量总和不变列等式计算出X的质量;根据质量比结合相对分子质量进行分析。
【解答】
设X的质量为a,反应前后质量总和不变列等式:4.8g+16.0g=10.8g+4.4g+a,解得a=5.6g;甲烷不完全燃烧时会产生一氧化碳,所以X是一氧化碳;甲烷不完全燃烧的化学方程式中各物质的化学计量数之比为::::=3:5:1:6:2,将其配平可得:3CH4+5O2CO2+6H2O+2CO,所以该反应方程式中O2与X化学计量数之比为5:2。
故答案为:5.6;5:2。
17.【答案】3C2H4+8O22CO+4CO2+6H2O
【解析】
【分析】
化学反应前后元素的种类和质量均不变,生成物一氧化碳和二氧化碳中的碳元素质量和等于参加反应的乙烯中的碳元素质量,据此由化学式的计算得出生成一氧化碳的质量,由质量守恒定律得出参加反应的氧气质量,再根据化学方程式中各物质的计量数之比等于各物质质量与相对分子质量之比,即可得出该化学反应方程式中各物质的计量数.
【解答】
4.2gC2H4中碳元素质量为:,8.8gCO2中碳元素质量为:,则反应生成一氧化碳中的碳元素质量为:3.6g-2.4g=1.2g,由此可知,生成一氧化碳的质量为:,由质量守恒定律可得,参加反应的氧气质量为:2.8g+8.8g+5.4g-4.2g=12.8g,则该化学方程式中乙烯、氧气、一氧化碳、二氧化碳和水的配平计量数比为:,所以该反应的化学方程式为:3C2H4+8O22CO+4CO2+6H2O.
18.【答案】(1)32.5
(2)CuO
?(3)135
【解析】
【分析】
(1)根据信息书写对应的化学方程式,然后根据氮气的质量和对应的化学方程式求算分解的叠氮化钠的质量;
(2)根据化学方程式左右两边各原子个数相同分析解答;
(3)根据化学反应中元素种类和质量均不变,结合关系式求算130g叠氮化钠对应的氯化铜的质量。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
【解答】
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速完全分解生成两种单质,为氮气和钠,对应的化学方程式为2NaN32Na+3N2↑;
设生成21g氮气消耗的叠氮化钠的质量为x
2NaN32Na+3N2↑
130???????????????????????
84
x??????????????????????????
21g
=
x=32.5g
(2)根据质量守恒定律,结合给出的关系可知,2NaN3+CuO=Na2O+3N2↑+Cu;
(3)设130gNaN3与足量的反应物完全反应能得到的CuCl2的质量为y。
根据2NaN3+CuO=Na2O+3N2↑+Cu和Cu+Cl2CuCl2,可得关系为
2NaN3?∽
Cu
∽
CuCl2,
130?
?
?
?
?
?
?
?
?
?
?135
130g?
?
?
?
?
?
?
?
?
?
y
=
y=135g
故答案为:(1)32.5;
(2)CuO;
(3)135。
19.【答案】(1)4.8g;C、H、O;12:3:8;
(2)①2;3;1;3;
②2;3;4;3;
③4?;5;4;6;
④1;3;2;2;
(3)①CD;
②右;气球鼓起后有向上的浮力作用;
???????③1g
【解析】
【分析】
本题考查的知识点较多,解题时根据质量守恒定律及其应用、有关化学式的计算、化学方程式的配平方法、质量守恒定律的验证、根据化学方程式的计算来分析解答即可。
【解答】
(1)已知:2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则根据质量守恒定律,参加反应的氧气的质量=4.4g+2.7g-2.3g=4.8g;二氧化碳中氧元素质量与水中氧元素质量之和为,大于氧气质量,则该物质中一定含有碳(C)、氢(H)、氧(O)三种元素,二氧化碳中碳元素质量为:4.4g-3.2g=1.2g;水中氢元素质量为:2.7g-2.4g=0.3g,氧元素质量为5.6g-4.8g=0.8g;则碳、氢、氧三种元素质量比1.2g:0.3g:0.8g=12:3:8;
(2)①
2Al
+3H2SO4=1Al2(SO4)3+
3H2↑;
②2Fe2O3?+3C4Fe
+3CO2↑;
③
4NH3+5O2=4NO?+
6H2O;
④1C2H4?+
3O22H2O
+
2CO2;
(3)用盐酸与碳酸钙粉末反应验证质量守恒定律,须测量的数据是:
C
反应前整个反应装置(包括里边的物质)质量
D
反应后整个反应装置(包括里边的物质)质量
故选:CD。
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。分析原因:气球鼓起后有向上的浮力作用;
③解:设参与反应的碳酸钙的质量x。
CaCO3+2HCl═CaCl2+H2O+CO2↑
?
100
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?44
?
?
x
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?0.44g
x=1g
即参加反应碳酸钙的质量为1g。
第2页,共2页
第1页,共1页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
