浙教版八年级科学下册第3章 空气与生命 单元测试题(含答案)
文档属性
| 名称 | 浙教版八年级科学下册第3章 空气与生命 单元测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 319.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-02-19 21:11:15 | ||
图片预览


文档简介
第3章 空气与生命
一、选择题(每题3分,共45分)
1.2020,我们离全面建成小康社会这一目标又近了一步。“务农重本,国之大纲”,党的十九大提出实施乡村振兴战略,让农业成为有奔头的产业,让农民成为有吸引力的职业,让农村成为安居乐业的美丽家园。下列哪项不利于美丽家园的建设 ( )
A.提倡使用无磷洗衣粉
B.提倡低碳出行,少开汽车
C.更多地利用太阳能、风能等清洁能源
D.露天焚烧垃圾
2.家庭中一般利用冰箱来储存水果和蔬菜,利用你学过的科学知识,分析冰箱能延长果蔬储存时间的主要原因是 ( )
A.减少果蔬水分含量,加快呼吸作用
B.降低了环境的温度,减缓呼吸作用
C.降低了环境的温度,加快呼吸作用
D.减少环境中氧气的含量,减缓呼吸作用
3.图1是小明完成氧气的制取、收集和验满的主要操作过程,其中需要纠正的是 ( )
40989253873510160080010257492524765141795538735
A.气密性检查 B.添加试剂 C.制取并收集气体 D.气体验满
图1
4.下列关于“植物在光照下制造淀粉实验”的相关描述不正确的是 ( )
A.把天竺葵放在暗处一昼夜,目的是运走、耗尽叶片内的淀粉
B.天竺葵在光照下既能进行光合作用又能进行呼吸作用
C.将叶片放在酒精中水浴加热的原因之一是避免酒精温度过高引起燃烧
D.叶片经脱色、清洗、滴加碘液、再清洗,遮光部分显蓝色
5.金属钯在某新型药物合成反应前后质量和化学性质都没有改变。你认为金属钯在此反应中可能是 ( )
A.催化剂 B.乳化剂 C.反应物 D.生成物
6.我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图2所示。下列说法正确的是( )
图2
A.甲的相对分子质量为6
B.1个丙分子中含有4个氢原子
C.参加反应的甲与乙的质量比为3∶1
D.氢元素的化合价在反应前后没有发生改变
7.图3是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是( )
图3
A.图甲中的转化1是酸雨形成的主要原因
B.图乙中可实现有机物与无机物的相互转化
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
8.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图4 所示转化过程。下列说法正确的是 ( )
图4
A.反应①的化学方程式为CO2+CCO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.元素的种类、原子的数目在化学反应前后不变
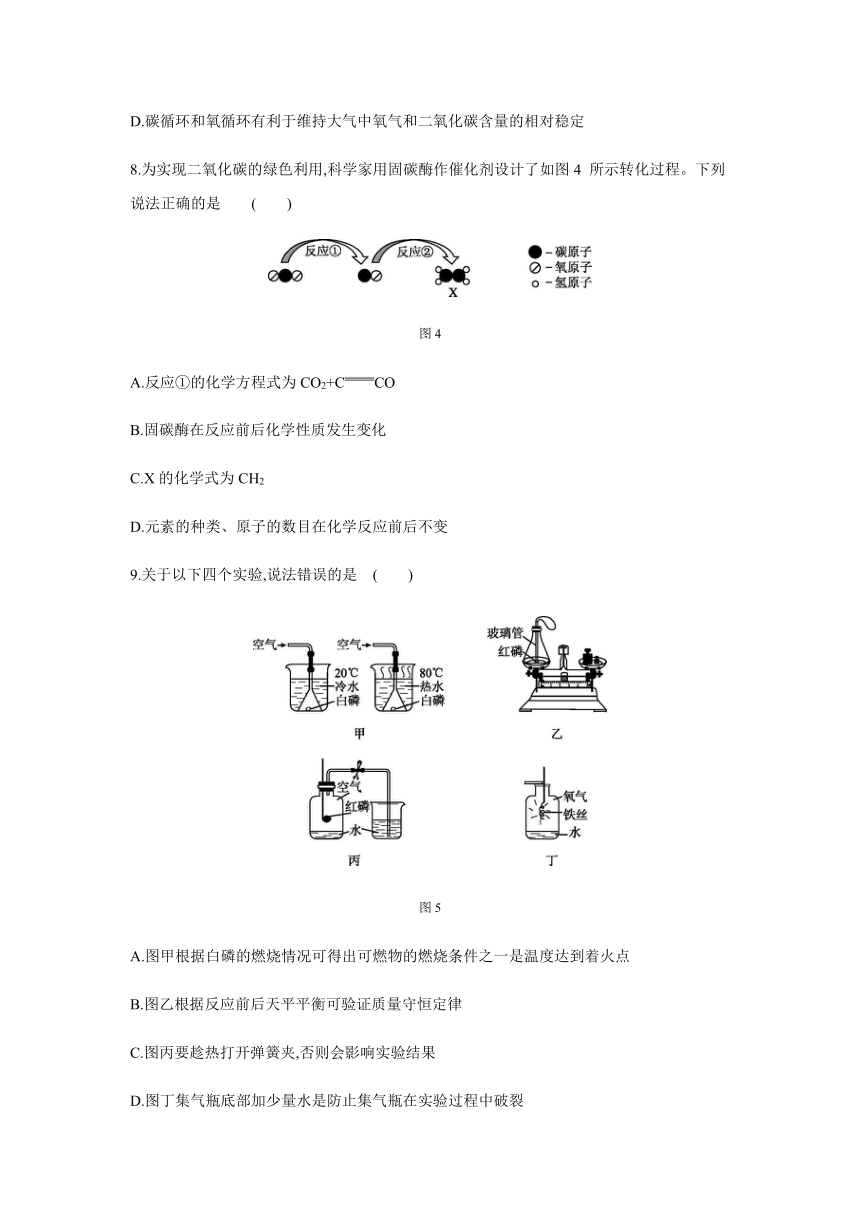
9.关于以下四个实验,说法错误的是 ( )
图5
A.图甲根据白磷的燃烧情况可得出可燃物的燃烧条件之一是温度达到着火点
B.图乙根据反应前后天平平衡可验证质量守恒定律
C.图丙要趁热打开弹簧夹,否则会影响实验结果
D.图丁集气瓶底部加少量水是防止集气瓶在实验过程中破裂
10.如何减少温室气体二氧化碳的含量是科学家一直在探究的课题。中国科学技术大学的专家找到了一种新型催化剂,可将二氧化碳转化为液体燃料甲酸(CH2O2)。下列说法中不正确的是 ( )
A.地球上二氧化碳含量升高的主要原因是植物的呼吸作用
B.二氧化碳能阻挡地面辐射,对地球有保温作用
C.二氧化碳转化为甲酸的过程属于化学变化
D.这种新型催化剂在反应前后质量不变
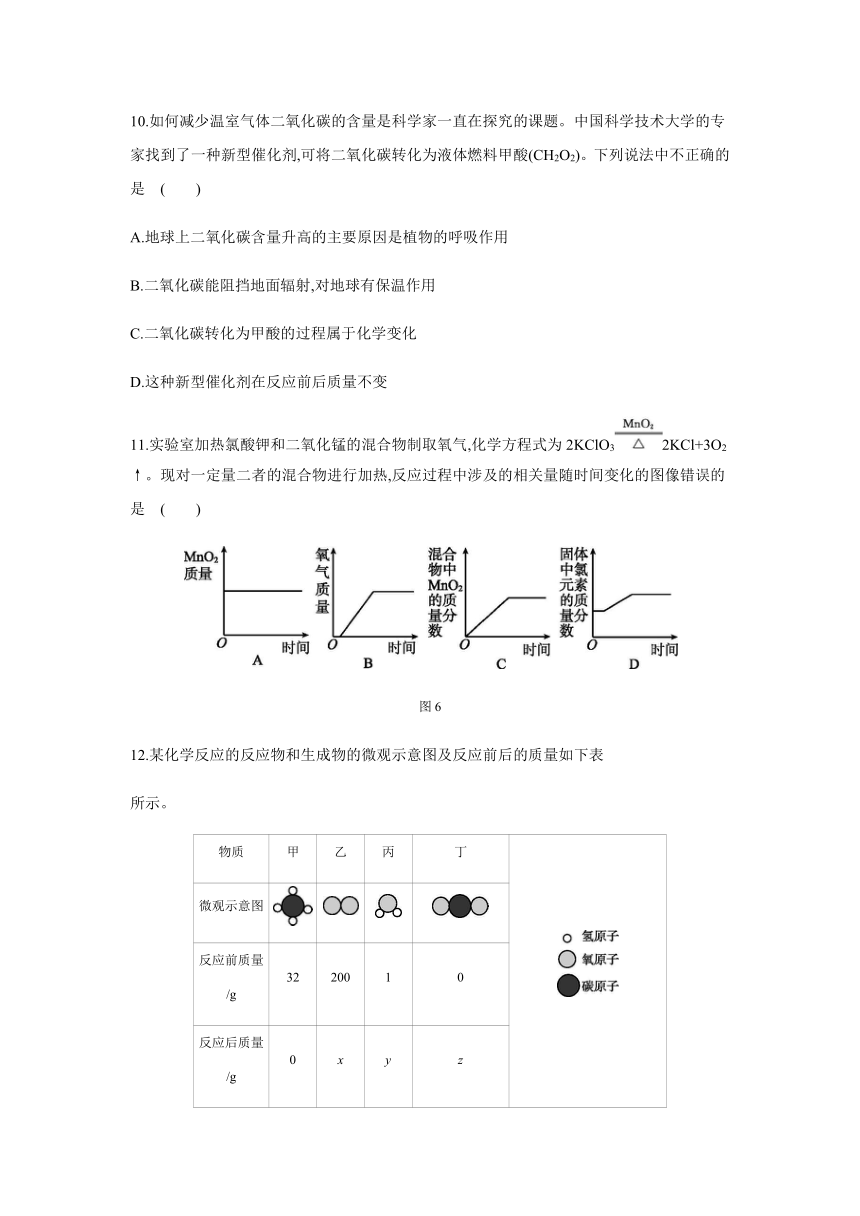
11.实验室加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为2KClO32KCl+3O2↑。现对一定量二者的混合物进行加热,反应过程中涉及的相关量随时间变化的图像错误的是 ( )
图6
12.某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表
所示。
物质
甲
乙
丙
丁
微观示意图
反应前质量/g
32
200
1
0
反应后质量/g
0
x
y
z
下列有关该反应的说法正确的是 ( )
A.甲物质由碳原子和氢原子直接构成
B.该反应一定属于化合反应
C.参加反应的甲、乙的分子个数比为1∶1
D.x+y+z=233
13.小金通过实验室制取和收集二氧化碳的方法获得了一瓶二氧化碳气体。接着利用这瓶二氧化碳气体完成了如图7所示实验,观察到蜡烛火焰自下而上依次熄灭。下列说法错误的是( )
图7
A.实验室制取二氧化碳的药品为块状大理石和稀硫酸
B.实验室可采用向上排空气法收集二氧化碳
C.图示实验可说明二氧化碳密度比空气大
D.图示实验可说明二氧化碳不支持蜡烛的燃烧
14.叶绿素是一类含镁的有机物,是叶绿体中的重要色素,与光合作用密切相关。叶绿素 ( )
A.主要吸收白光中的绿光
B.存在于植物体的每个细胞中
C.能溶解在酒精中
D.含有的镁用于调节植物的生命活动
15.小东把两颗“曼妥思”薄荷糖放入一瓶可乐中,马上出现了喷涌现象。小东对此产生疑问,最终查阅资料得知此喷涌现象属正常反应,主要是“曼妥思”薄荷糖表面含有阿拉伯胶,它在反应前后质量和化学性质均不变,却能加快可乐等碳酸饮料分解,使之瞬间生成大量的二氧化碳,从而出现喷涌现象。以下说法错误的是 ( )
A.阿拉伯胶在反应中相当于催化剂
B.喷涌现象发生时,既有化学变化又有物理变化
C.把“曼妥思”薄荷糖放入“雪碧”中不能形成喷涌现象
D.喷涌而出的二氧化碳是一种氧化物
二、填空题(共24分)
16.(8分)2019年6月5日世界环境日全球主场活动在浙江杭州举行,世界环境日主题聚焦空气污染防治。回答下列问题。
(1)汽车尾气中的二氧化硫、氮氧化物等物质,在大气中与水分结合而形成 ,腐蚀建筑、损害林木。目前,杭州已开辟“零排放、零污染”的纯电动公交线,路线超过100条,纯电动汽车是由电动机驱动的汽车,其电动机的工作原理是 。?
(2)2018年杭州市生态环境局已陆续在全市144个乡镇街道建立了小微空气自动监测站,实时接收监测数据。计入空气质量指数的污染物,除了二氧化硫、二氧化氮外,还有 (填序号)。?
①二氧化碳 ②可吸入悬浮颗粒物 ③氮气 ④臭氧 ⑤一氧化碳
(3)为了防止空气污染,保护美丽的天空。下列做法值得提倡的是 (填字母)。?
A.使用清洁能源代替煤和石油
B.积极植树造林,防治扬尘污染
C.焚烧落叶和垃圾
D.工业废气处理后再排放
17.(4分)某同学以高锰酸钾为原料制取氧气。
图8
(1)用如图8所示方法检查装置的气密性,用手紧握试管却观察不到导管口有气泡冒出。若此装置气密性良好,为顺利完成该装置的气密性检查,请提一条合理建议:
。?
(2)清洗试管时,试管中的固体物质溅落在衣服上,留下了黑点,用彩漂液(主要成分是过氧化氢)清洗,黑点处迅速产生气泡,请用化学方程式表示产生气泡的原因: 。?
18.(4分)根据图9回答问题。
图9
(1)实验室用高锰酸钾制取氧气的发生装置和收集装置是 (从A~E中选择,填字母)。?
(2)若用F装置收集二氧化碳,气体应从 (填“m”或“n”)端进。?
19.(8分)图10是有关光合作用、呼吸作用的示意图,请据图回答:
图10
(1)a、b表示植物的生理活动,其中b是 。?
(2)A、B表示两种物质,其中A是 。?
(3)a作用的意义:不但为生物圈中所有生物提供了有机物,而且提供了呼吸作用需要的 ,同时减少了大气中的二氧化碳含量,维持了生物圈中的 平衡。?
三、实验探究题(共16分)
20.(8分)材料一 1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
图11
材料二 1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三 1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:? 。?
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自
的假设。?
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是
。?
(4)质量守恒定律的发现过程,给我们的启示是 (填字母)。?
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
21.(8分)某实验小组为了探究“绿叶在光下制造有机物”,如图12 所示,请你结合所学知识回答有关问题。
图12
(1)该实验正确的操作步骤是:①→③→②→ →⑤。?
A.⑦⑥④ B.④⑦⑥ C.⑥④⑦ D.⑦④⑥
(2)实验步骤①把绿色植物放到黑暗处一昼夜的目的是 。?
(3)实验步骤⑦把叶片放在盛有酒精的小烧杯中水浴加热的目的是 。?
(4)若该实验小组的操作步骤完全正确,则在图⑤中可观察到的实验现象是叶片遮光部分不变色,未遮光部分变成 。?
四、解答题(共15分)
22.(7分)把适量萌发的水稻种子装入黑色塑料袋中,扎紧袋口,在无光的环境中放置几昼夜。之后松开袋口,立即插入导管扎紧袋口,并将导管口插入烧杯中,如图13所示。将烧杯中蜡烛点燃,观察到蜡烛能在烧杯中持续燃烧后,再缓慢挤压塑料袋,观察到蜡烛能够熄灭。请用所学的知识解释蜡烛熄灭的原因。
图13
43434089217523.(8分)某同学用如图14所示装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
实验次数
1
2
3
碳酸钠质量/g
0.53
1.06
2.12
反应前装置总质量/g
66.33
66.86
67.92
反应后装置总质量/g
66.19
66.62
67.42
图14
(1)计算第1次反应产生二氧化碳的质量。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3 g/L,二氧化碳密度取2.0 g/L,结果精确到0.01 g)
答案
1.D 2.B 3.D 4.D 5.A 6.B 7.A 8.D 9.C 10.A 11.C 12.D 13.A 14.C 15.C
16.(1)酸雨 通电线圈在磁场中转动
(2)②④⑤ (3)ABD
17.(1)用酒精灯加热试管(或把试管浸入热水中,合理即可)
(2)2H2O22H2O+O2↑
18.(1)AC(或AE)
(2)m
19.(1)呼吸作用
(2)二氧化碳
(3)氧气 碳-氧
20.(1)铁丝在氧气中燃烧后质量增加(合理即可)
(2)空气
(3)打开容器前没有称量容器的总质量
(4)ACD
21.(1)D
(2)使叶片内原有的淀粉转运和消耗掉
(3)用酒精溶解叶片中的叶绿素便于观察
(4)蓝色
22.萌发的水稻种子呼吸作用旺盛,要消耗大量氧气(产生二氧化碳),导致黑塑料袋内的氧气含量很低,而物质的燃烧需要有充足的助燃剂(和达到着火点的温度),将袋内的气体缓慢挤入烧杯中时,会将烧杯内的空气向上排出,导致烧杯内蜡烛因为缺少助燃剂而熄灭。
23.解:(1)设第1次反应产生二氧化碳的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
0.53 g x
10644=0.53 gx x=0.22 g
(2)第1次反应前后装置减少的质量为66.33 g-66.19 g=0.14 g。
产生二氧化碳的体积为0.22 g2.0 g/L=0.11 L,
产生0.11 L二氧化碳使气球胀大所排开空气的质量为1.3 g/L×0.11 L≈0.14 g,
反应后托盘内的质量为66.19 g+0.14 g(浮力导致天平减小的示数)=66.33 g,所以遵循质量守恒定律。
答:(1)第1次反应产生二氧化碳的质量为0.22 g;(2)该反应遵循质量守恒定律。
一、选择题(每题3分,共45分)
1.2020,我们离全面建成小康社会这一目标又近了一步。“务农重本,国之大纲”,党的十九大提出实施乡村振兴战略,让农业成为有奔头的产业,让农民成为有吸引力的职业,让农村成为安居乐业的美丽家园。下列哪项不利于美丽家园的建设 ( )
A.提倡使用无磷洗衣粉
B.提倡低碳出行,少开汽车
C.更多地利用太阳能、风能等清洁能源
D.露天焚烧垃圾
2.家庭中一般利用冰箱来储存水果和蔬菜,利用你学过的科学知识,分析冰箱能延长果蔬储存时间的主要原因是 ( )
A.减少果蔬水分含量,加快呼吸作用
B.降低了环境的温度,减缓呼吸作用
C.降低了环境的温度,加快呼吸作用
D.减少环境中氧气的含量,减缓呼吸作用
3.图1是小明完成氧气的制取、收集和验满的主要操作过程,其中需要纠正的是 ( )
40989253873510160080010257492524765141795538735
A.气密性检查 B.添加试剂 C.制取并收集气体 D.气体验满
图1
4.下列关于“植物在光照下制造淀粉实验”的相关描述不正确的是 ( )
A.把天竺葵放在暗处一昼夜,目的是运走、耗尽叶片内的淀粉
B.天竺葵在光照下既能进行光合作用又能进行呼吸作用
C.将叶片放在酒精中水浴加热的原因之一是避免酒精温度过高引起燃烧
D.叶片经脱色、清洗、滴加碘液、再清洗,遮光部分显蓝色
5.金属钯在某新型药物合成反应前后质量和化学性质都没有改变。你认为金属钯在此反应中可能是 ( )
A.催化剂 B.乳化剂 C.反应物 D.生成物
6.我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图2所示。下列说法正确的是( )
图2
A.甲的相对分子质量为6
B.1个丙分子中含有4个氢原子
C.参加反应的甲与乙的质量比为3∶1
D.氢元素的化合价在反应前后没有发生改变
7.图3是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是( )
图3
A.图甲中的转化1是酸雨形成的主要原因
B.图乙中可实现有机物与无机物的相互转化
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
8.为实现二氧化碳的绿色利用,科学家用固碳酶作催化剂设计了如图4 所示转化过程。下列说法正确的是 ( )
图4
A.反应①的化学方程式为CO2+CCO
B.固碳酶在反应前后化学性质发生变化
C.X的化学式为CH2
D.元素的种类、原子的数目在化学反应前后不变
9.关于以下四个实验,说法错误的是 ( )
图5
A.图甲根据白磷的燃烧情况可得出可燃物的燃烧条件之一是温度达到着火点
B.图乙根据反应前后天平平衡可验证质量守恒定律
C.图丙要趁热打开弹簧夹,否则会影响实验结果
D.图丁集气瓶底部加少量水是防止集气瓶在实验过程中破裂
10.如何减少温室气体二氧化碳的含量是科学家一直在探究的课题。中国科学技术大学的专家找到了一种新型催化剂,可将二氧化碳转化为液体燃料甲酸(CH2O2)。下列说法中不正确的是 ( )
A.地球上二氧化碳含量升高的主要原因是植物的呼吸作用
B.二氧化碳能阻挡地面辐射,对地球有保温作用
C.二氧化碳转化为甲酸的过程属于化学变化
D.这种新型催化剂在反应前后质量不变
11.实验室加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式为2KClO32KCl+3O2↑。现对一定量二者的混合物进行加热,反应过程中涉及的相关量随时间变化的图像错误的是 ( )
图6
12.某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表
所示。
物质
甲
乙
丙
丁
微观示意图
反应前质量/g
32
200
1
0
反应后质量/g
0
x
y
z
下列有关该反应的说法正确的是 ( )
A.甲物质由碳原子和氢原子直接构成
B.该反应一定属于化合反应
C.参加反应的甲、乙的分子个数比为1∶1
D.x+y+z=233
13.小金通过实验室制取和收集二氧化碳的方法获得了一瓶二氧化碳气体。接着利用这瓶二氧化碳气体完成了如图7所示实验,观察到蜡烛火焰自下而上依次熄灭。下列说法错误的是( )
图7
A.实验室制取二氧化碳的药品为块状大理石和稀硫酸
B.实验室可采用向上排空气法收集二氧化碳
C.图示实验可说明二氧化碳密度比空气大
D.图示实验可说明二氧化碳不支持蜡烛的燃烧
14.叶绿素是一类含镁的有机物,是叶绿体中的重要色素,与光合作用密切相关。叶绿素 ( )
A.主要吸收白光中的绿光
B.存在于植物体的每个细胞中
C.能溶解在酒精中
D.含有的镁用于调节植物的生命活动
15.小东把两颗“曼妥思”薄荷糖放入一瓶可乐中,马上出现了喷涌现象。小东对此产生疑问,最终查阅资料得知此喷涌现象属正常反应,主要是“曼妥思”薄荷糖表面含有阿拉伯胶,它在反应前后质量和化学性质均不变,却能加快可乐等碳酸饮料分解,使之瞬间生成大量的二氧化碳,从而出现喷涌现象。以下说法错误的是 ( )
A.阿拉伯胶在反应中相当于催化剂
B.喷涌现象发生时,既有化学变化又有物理变化
C.把“曼妥思”薄荷糖放入“雪碧”中不能形成喷涌现象
D.喷涌而出的二氧化碳是一种氧化物
二、填空题(共24分)
16.(8分)2019年6月5日世界环境日全球主场活动在浙江杭州举行,世界环境日主题聚焦空气污染防治。回答下列问题。
(1)汽车尾气中的二氧化硫、氮氧化物等物质,在大气中与水分结合而形成 ,腐蚀建筑、损害林木。目前,杭州已开辟“零排放、零污染”的纯电动公交线,路线超过100条,纯电动汽车是由电动机驱动的汽车,其电动机的工作原理是 。?
(2)2018年杭州市生态环境局已陆续在全市144个乡镇街道建立了小微空气自动监测站,实时接收监测数据。计入空气质量指数的污染物,除了二氧化硫、二氧化氮外,还有 (填序号)。?
①二氧化碳 ②可吸入悬浮颗粒物 ③氮气 ④臭氧 ⑤一氧化碳
(3)为了防止空气污染,保护美丽的天空。下列做法值得提倡的是 (填字母)。?
A.使用清洁能源代替煤和石油
B.积极植树造林,防治扬尘污染
C.焚烧落叶和垃圾
D.工业废气处理后再排放
17.(4分)某同学以高锰酸钾为原料制取氧气。
图8
(1)用如图8所示方法检查装置的气密性,用手紧握试管却观察不到导管口有气泡冒出。若此装置气密性良好,为顺利完成该装置的气密性检查,请提一条合理建议:
。?
(2)清洗试管时,试管中的固体物质溅落在衣服上,留下了黑点,用彩漂液(主要成分是过氧化氢)清洗,黑点处迅速产生气泡,请用化学方程式表示产生气泡的原因: 。?
18.(4分)根据图9回答问题。
图9
(1)实验室用高锰酸钾制取氧气的发生装置和收集装置是 (从A~E中选择,填字母)。?
(2)若用F装置收集二氧化碳,气体应从 (填“m”或“n”)端进。?
19.(8分)图10是有关光合作用、呼吸作用的示意图,请据图回答:
图10
(1)a、b表示植物的生理活动,其中b是 。?
(2)A、B表示两种物质,其中A是 。?
(3)a作用的意义:不但为生物圈中所有生物提供了有机物,而且提供了呼吸作用需要的 ,同时减少了大气中的二氧化碳含量,维持了生物圈中的 平衡。?
三、实验探究题(共16分)
20.(8分)材料一 1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
图11
材料二 1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三 1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:? 。?
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自
的假设。?
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是
。?
(4)质量守恒定律的发现过程,给我们的启示是 (填字母)。?
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
21.(8分)某实验小组为了探究“绿叶在光下制造有机物”,如图12 所示,请你结合所学知识回答有关问题。
图12
(1)该实验正确的操作步骤是:①→③→②→ →⑤。?
A.⑦⑥④ B.④⑦⑥ C.⑥④⑦ D.⑦④⑥
(2)实验步骤①把绿色植物放到黑暗处一昼夜的目的是 。?
(3)实验步骤⑦把叶片放在盛有酒精的小烧杯中水浴加热的目的是 。?
(4)若该实验小组的操作步骤完全正确,则在图⑤中可观察到的实验现象是叶片遮光部分不变色,未遮光部分变成 。?
四、解答题(共15分)
22.(7分)把适量萌发的水稻种子装入黑色塑料袋中,扎紧袋口,在无光的环境中放置几昼夜。之后松开袋口,立即插入导管扎紧袋口,并将导管口插入烧杯中,如图13所示。将烧杯中蜡烛点燃,观察到蜡烛能在烧杯中持续燃烧后,再缓慢挤压塑料袋,观察到蜡烛能够熄灭。请用所学的知识解释蜡烛熄灭的原因。
图13
43434089217523.(8分)某同学用如图14所示装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。
实验次数
1
2
3
碳酸钠质量/g
0.53
1.06
2.12
反应前装置总质量/g
66.33
66.86
67.92
反应后装置总质量/g
66.19
66.62
67.42
图14
(1)计算第1次反应产生二氧化碳的质量。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律。(空气密度取1.3 g/L,二氧化碳密度取2.0 g/L,结果精确到0.01 g)
答案
1.D 2.B 3.D 4.D 5.A 6.B 7.A 8.D 9.C 10.A 11.C 12.D 13.A 14.C 15.C
16.(1)酸雨 通电线圈在磁场中转动
(2)②④⑤ (3)ABD
17.(1)用酒精灯加热试管(或把试管浸入热水中,合理即可)
(2)2H2O22H2O+O2↑
18.(1)AC(或AE)
(2)m
19.(1)呼吸作用
(2)二氧化碳
(3)氧气 碳-氧
20.(1)铁丝在氧气中燃烧后质量增加(合理即可)
(2)空气
(3)打开容器前没有称量容器的总质量
(4)ACD
21.(1)D
(2)使叶片内原有的淀粉转运和消耗掉
(3)用酒精溶解叶片中的叶绿素便于观察
(4)蓝色
22.萌发的水稻种子呼吸作用旺盛,要消耗大量氧气(产生二氧化碳),导致黑塑料袋内的氧气含量很低,而物质的燃烧需要有充足的助燃剂(和达到着火点的温度),将袋内的气体缓慢挤入烧杯中时,会将烧杯内的空气向上排出,导致烧杯内蜡烛因为缺少助燃剂而熄灭。
23.解:(1)设第1次反应产生二氧化碳的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 44
0.53 g x
10644=0.53 gx x=0.22 g
(2)第1次反应前后装置减少的质量为66.33 g-66.19 g=0.14 g。
产生二氧化碳的体积为0.22 g2.0 g/L=0.11 L,
产生0.11 L二氧化碳使气球胀大所排开空气的质量为1.3 g/L×0.11 L≈0.14 g,
反应后托盘内的质量为66.19 g+0.14 g(浮力导致天平减小的示数)=66.33 g,所以遵循质量守恒定律。
答:(1)第1次反应产生二氧化碳的质量为0.22 g;(2)该反应遵循质量守恒定律。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
