第十讲 原子结构的模型 讲义—2020-2021学年浙教版八年级科学下册(含答案)
文档属性
| 名称 | 第十讲 原子结构的模型 讲义—2020-2021学年浙教版八年级科学下册(含答案) | 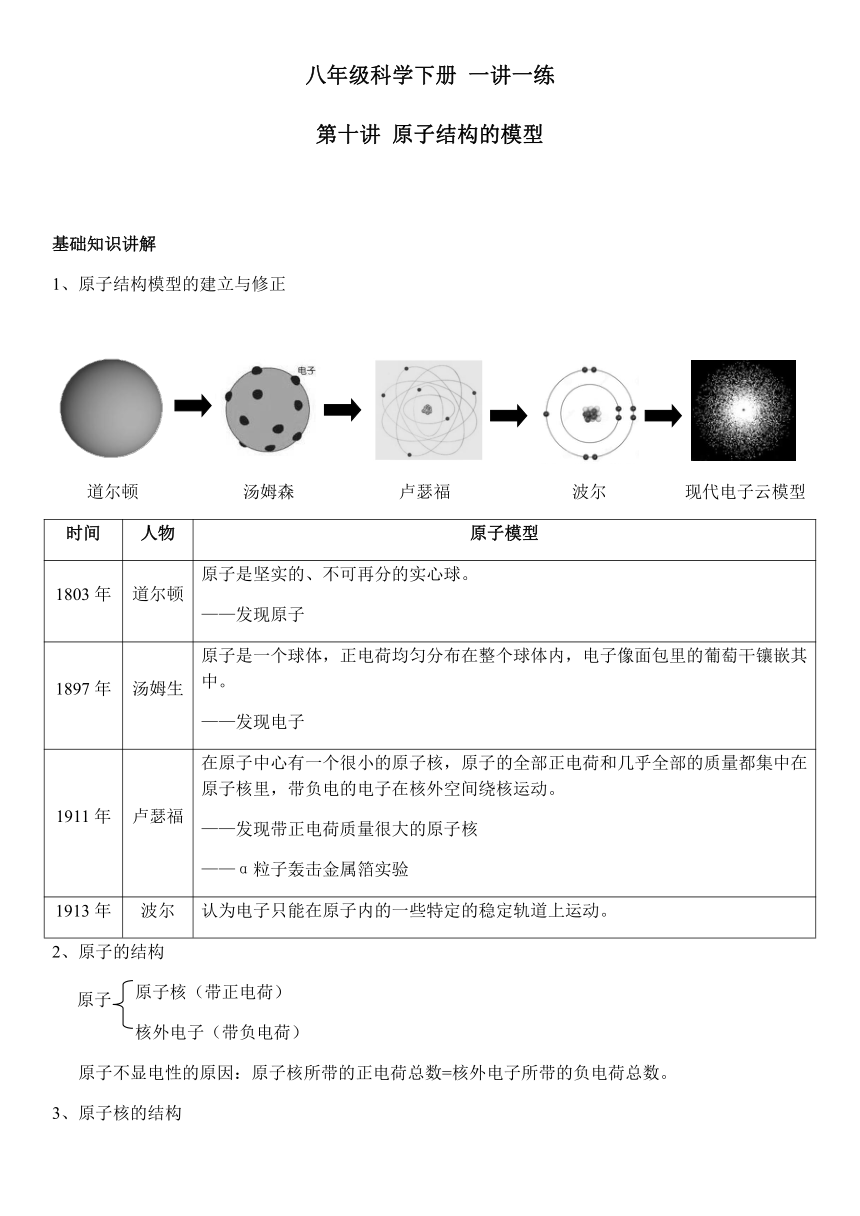 | |
| 格式 | docx | ||
| 文件大小 | 247.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-02-26 08:24:27 | ||
图片预览



文档简介
八年级科学下册 一讲一练
第十讲 原子结构的模型
基础知识讲解
原子结构模型的建立与修正
5621655781055215255471805430720578105385635547180528467057810523958554210051437005273051081405382905
道尔顿 汤姆森 卢瑟福 波尔 现代电子云模型
时间
人物
原子模型
1803年
道尔顿
原子是坚实的、不可再分的实心球。
——发现原子
1897年
汤姆生
原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。
——发现电子
1911年
卢瑟福
在原子中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动。
——发现带正电荷质量很大的原子核
——α粒子轰击金属箔实验
1913年
波尔
认为电子只能在原子内的一些特定的稳定轨道上运动。
原子的结构
-1911351714512700023495原子
原子
原子核(带正电荷)
核外电子(带负电荷)
原子不显电性的原因:原子核所带的正电荷总数=核外电子所带的负电荷总数。
3、原子核的结构
7061203937012700064770原子核
原子核
质子(带正电)
中子(不带电)
(1)核电荷数:原子核所带的电荷数
(2)原子中,核电荷数=质子数=核外电子数。
(3)中子数不一定等于质子数。原子内可以没有中子。
(4)质子不同,原子种类一定不同。
(5)电子质量很小,在整个原子的质量中所占的比例极小,可忽略不计。
原子的质量主要集中在原子核上。
(6)夸克
①质子和中子是由更小的微粒“夸克”构成。
②夸克还可以再分。
巩固提升训练
1、知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是(?? )
A.?原子、原子核、核外电子????????????????????????????????????B.?原子核、原子、核外电子
C.?原子、核外电子、原子核????????????????????????????????????D.?核外电子、原子核、原子
2、下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是(? ??)
A.?决定该原子种类的粒子是b??????????????????????????????????B.?该原子的化学性质跟硫原子相似
C.?该原子的质量集中在a和c上????????????????????????????????D.?原子核中含有6个c
3、人类对原子结构的认识为现代量子理论的建立奠定了基础,以下几位科学家对原子的观点,按出现的先后顺序排列正确的是(??? )
A.?③④①②???????????????????????????B.?③①②④???????????????????????????C.?③①④②???????????????????????????D.?③②①④
4、如图所示代表三种原子的原子核,请回答下列问题:
这三种原子的原子核内均含有________个质子,所以它们属于同种________,但中子数不同,它们是氢的________。
5、下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
(1)B微粒所带的电性为________。(填“不带电”、“带正电”或“带负电”)
(2)与A互为同位素原子的是________。
6、对原子结构模型的形成,汤姆生、卢瑟福和玻尔等科学家做出了突出贡献。请根据所学完成下列有关问题。
(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是________。
(2)1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,为建立现代原子理论打下了基础。 如图a、b、c、d四条线中,不可能是α粒子在该实验中的运动轨迹的是________。
(3)从原子结构模型建立的过程中,我们发现? ????。(可多选)
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
7、卢瑟福通过α粒子散射实验,发现了原子中间有一个很小的核,并由此提出了原子的核式结构模型.右面平面示意图中的四条线表示α粒子(相当于氦原子核)
运动的可能轨迹,在图中完成中间两条α粒子的运动轨迹.
8、人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。
【过程与现象】1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。结果发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的几乎达到180°,像是被金箔弹了回来。
【解释与结论】
(1)绝大多数α粒子穿过金箔后方向不变,说明________;
(2)通过上述实验,可推出的原子结构模型为________;
(3)【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是________(填字母)。
答案解析:
1、 【解答】氧气由氧分子构成,而氧分子由氧原子构成,因此a为原子;原子由原子核和核外电子构成,而原子核由质子和中子构成,因此b为原子核,c为核外电子。
故选A。
2、【解答】根据模型图可知,c粒子带正电荷,为质子;b粒子不带电,为中子;a粒子带负电,为电子。
A.原子种类由原子序数决定,而原子序数=质子数,那么决定原子种类的粒子是c,故A错误;
B.该原子的最外层有4个电子,而硫原子的最外层有6个电子,所以该原子的化学性质跟硫原子不同,故B错误;
C.该原子的质量集中在c和b上,故C错误;
D.该原子共有6个电子,因为质子数=电子数,所以原子核内含有6个质子,即6个c,故D正确。
故选D。
3、【解答】1808年,英国科学家道尔顿提出了原子论,他认为物质是由原子直接构成的,原子是一个实心球体,不可再分割,创立了近现代原子论;
1897年,英国科学家汤姆孙发现原子中存在电子.1904年汤姆生提出了葡萄干面包原子模型;
1911年,英国科学家卢瑟福提出了原子结构的行星模型(核式结构);
1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型,强调核外电子的分层排布。
正确顺序为③①②④。
故选B。
4、【答案】 1;元素;同位素原子
【解答】根据图片可知,这三种原子的原子核内均含有1个质子,所以它们属于同种元素,但中子数不同,它们是氢的同位素原子。
5、【答案】 (1)带正电
(2)D
【解答】(1)根据表格可知,B微粒质子数为26,电子数为24,因为正电荷数大于负电荷数,所以带正电。
(2)根据表格可知,A和D质子数相同,而中子数不同,所以它们互为同位素原子。
6、【解答】(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是电子;
(2)原子核带正电荷, α粒子也带正电,二者靠近时会发生相互排斥。如果α粒子离原子核较远,那么排斥力非常小,对运动没有影响,则可能沿直线运动;如果二者较近,那么α粒子受到排斥运动轨迹会向下弯曲;但是肯定不会向上弯曲,故选a;
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.玻尔原子模型的建立,使人们对原子结构的认识更近一步,但是离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
7、【解答】卢瑟福通过α粒子散射并由此提出了原子的核式结构模型,该实验的现象为:绝大多数α粒子几乎不发生偏转,少数α粒子发生了较大的角度偏转,极少数α粒子发生了大角度偏转(偏转角度超过90°,有的甚至几乎达到180°,被反弹回来),据此可画出α粒子的运动轨迹,如图所示:
故答案为:α粒子散射,α粒子的运动轨迹如图所示.
【分析】卢瑟福通过α粒子散射推翻了原子“枣糕模型”,建立了原子核式结构模型,明确α粒子散射实验现象及结论即可正确解答本题.
8、【答案】 (1)原子内部绝大部分是空的
(2)C
(3)BC
【解答】(1)绝大多数α粒子穿过金箔后方向不变,说明原子内部绝大部分是空的;
(2)根据上述实验可知,原子内部大部分是空的,实心部分占的体积很小,故选C;
(3)原子内部的原子核带正电荷,而α粒子也带正电荷,根据“同种电荷相互排斥”可知,上面的α粒子轨迹向上弯曲,下面的α粒子轨迹向下弯曲,因此运动轨迹不可能是BC。
第十讲 原子结构的模型
基础知识讲解
原子结构模型的建立与修正
5621655781055215255471805430720578105385635547180528467057810523958554210051437005273051081405382905
道尔顿 汤姆森 卢瑟福 波尔 现代电子云模型
时间
人物
原子模型
1803年
道尔顿
原子是坚实的、不可再分的实心球。
——发现原子
1897年
汤姆生
原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。
——发现电子
1911年
卢瑟福
在原子中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动。
——发现带正电荷质量很大的原子核
——α粒子轰击金属箔实验
1913年
波尔
认为电子只能在原子内的一些特定的稳定轨道上运动。
原子的结构
-1911351714512700023495原子
原子
原子核(带正电荷)
核外电子(带负电荷)
原子不显电性的原因:原子核所带的正电荷总数=核外电子所带的负电荷总数。
3、原子核的结构
7061203937012700064770原子核
原子核
质子(带正电)
中子(不带电)
(1)核电荷数:原子核所带的电荷数
(2)原子中,核电荷数=质子数=核外电子数。
(3)中子数不一定等于质子数。原子内可以没有中子。
(4)质子不同,原子种类一定不同。
(5)电子质量很小,在整个原子的质量中所占的比例极小,可忽略不计。
原子的质量主要集中在原子核上。
(6)夸克
①质子和中子是由更小的微粒“夸克”构成。
②夸克还可以再分。
巩固提升训练
1、知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是(?? )
A.?原子、原子核、核外电子????????????????????????????????????B.?原子核、原子、核外电子
C.?原子、核外电子、原子核????????????????????????????????????D.?核外电子、原子核、原子
2、下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是(? ??)
A.?决定该原子种类的粒子是b??????????????????????????????????B.?该原子的化学性质跟硫原子相似
C.?该原子的质量集中在a和c上????????????????????????????????D.?原子核中含有6个c
3、人类对原子结构的认识为现代量子理论的建立奠定了基础,以下几位科学家对原子的观点,按出现的先后顺序排列正确的是(??? )
A.?③④①②???????????????????????????B.?③①②④???????????????????????????C.?③①④②???????????????????????????D.?③②①④
4、如图所示代表三种原子的原子核,请回答下列问题:
这三种原子的原子核内均含有________个质子,所以它们属于同种________,但中子数不同,它们是氢的________。
5、下表是小明收集的一些微粒的资料,请根据表格数据,回答下列问题。
粒子名称
质子数
中子数
电子数
A
14
14
14
B
26
30
24
C
14
14
18
D
14
18
14
(1)B微粒所带的电性为________。(填“不带电”、“带正电”或“带负电”)
(2)与A互为同位素原子的是________。
6、对原子结构模型的形成,汤姆生、卢瑟福和玻尔等科学家做出了突出贡献。请根据所学完成下列有关问题。
(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是________。
(2)1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,为建立现代原子理论打下了基础。 如图a、b、c、d四条线中,不可能是α粒子在该实验中的运动轨迹的是________。
(3)从原子结构模型建立的过程中,我们发现? ????。(可多选)
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.玻尔原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
7、卢瑟福通过α粒子散射实验,发现了原子中间有一个很小的核,并由此提出了原子的核式结构模型.右面平面示意图中的四条线表示α粒子(相当于氦原子核)
运动的可能轨迹,在图中完成中间两条α粒子的运动轨迹.
8、人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。
【过程与现象】1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。结果发现:绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的几乎达到180°,像是被金箔弹了回来。
【解释与结论】
(1)绝大多数α粒子穿过金箔后方向不变,说明________;
(2)通过上述实验,可推出的原子结构模型为________;
(3)【分析与应用】当α粒子轰击金箔时,如图所示的运动轨迹不可能是________(填字母)。
答案解析:
1、 【解答】氧气由氧分子构成,而氧分子由氧原子构成,因此a为原子;原子由原子核和核外电子构成,而原子核由质子和中子构成,因此b为原子核,c为核外电子。
故选A。
2、【解答】根据模型图可知,c粒子带正电荷,为质子;b粒子不带电,为中子;a粒子带负电,为电子。
A.原子种类由原子序数决定,而原子序数=质子数,那么决定原子种类的粒子是c,故A错误;
B.该原子的最外层有4个电子,而硫原子的最外层有6个电子,所以该原子的化学性质跟硫原子不同,故B错误;
C.该原子的质量集中在c和b上,故C错误;
D.该原子共有6个电子,因为质子数=电子数,所以原子核内含有6个质子,即6个c,故D正确。
故选D。
3、【解答】1808年,英国科学家道尔顿提出了原子论,他认为物质是由原子直接构成的,原子是一个实心球体,不可再分割,创立了近现代原子论;
1897年,英国科学家汤姆孙发现原子中存在电子.1904年汤姆生提出了葡萄干面包原子模型;
1911年,英国科学家卢瑟福提出了原子结构的行星模型(核式结构);
1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型,强调核外电子的分层排布。
正确顺序为③①②④。
故选B。
4、【答案】 1;元素;同位素原子
【解答】根据图片可知,这三种原子的原子核内均含有1个质子,所以它们属于同种元素,但中子数不同,它们是氢的同位素原子。
5、【答案】 (1)带正电
(2)D
【解答】(1)根据表格可知,B微粒质子数为26,电子数为24,因为正电荷数大于负电荷数,所以带正电。
(2)根据表格可知,A和D质子数相同,而中子数不同,所以它们互为同位素原子。
6、【解答】(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是电子;
(2)原子核带正电荷, α粒子也带正电,二者靠近时会发生相互排斥。如果α粒子离原子核较远,那么排斥力非常小,对运动没有影响,则可能沿直线运动;如果二者较近,那么α粒子受到排斥运动轨迹会向下弯曲;但是肯定不会向上弯曲,故选a;
(3)A.科学模型的建立是一个不断完善、不断修正的过程,故A正确;
B.模型在科学研究中起着很重要的作用,故B正确;
C.玻尔原子模型的建立,使人们对原子结构的认识更近一步,但是离完美还有一段距离,故C错误;
D.人类借助模型的建立,对原子的认识逐渐接近本质,故D正确。
故选ABD。
7、【解答】卢瑟福通过α粒子散射并由此提出了原子的核式结构模型,该实验的现象为:绝大多数α粒子几乎不发生偏转,少数α粒子发生了较大的角度偏转,极少数α粒子发生了大角度偏转(偏转角度超过90°,有的甚至几乎达到180°,被反弹回来),据此可画出α粒子的运动轨迹,如图所示:
故答案为:α粒子散射,α粒子的运动轨迹如图所示.
【分析】卢瑟福通过α粒子散射推翻了原子“枣糕模型”,建立了原子核式结构模型,明确α粒子散射实验现象及结论即可正确解答本题.
8、【答案】 (1)原子内部绝大部分是空的
(2)C
(3)BC
【解答】(1)绝大多数α粒子穿过金箔后方向不变,说明原子内部绝大部分是空的;
(2)根据上述实验可知,原子内部大部分是空的,实心部分占的体积很小,故选C;
(3)原子内部的原子核带正电荷,而α粒子也带正电荷,根据“同种电荷相互排斥”可知,上面的α粒子轨迹向上弯曲,下面的α粒子轨迹向下弯曲,因此运动轨迹不可能是BC。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
