2021年沪教版第7章《应用广泛的酸、碱、盐》7.2常见的酸和碱基础训练
文档属性
| 名称 | 2021年沪教版第7章《应用广泛的酸、碱、盐》7.2常见的酸和碱基础训练 |  | |
| 格式 | doc | ||
| 文件大小 | 143.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-02 11:07:45 | ||
图片预览


文档简介
沪教版第7章7.2常见的酸和碱基础训练
一、选择题:
1、稀硫酸中能使紫色石蕊试液变红色的微粒是( )
A.硫酸分子 B.氢离子 C.硫酸根离子 D.水分子
2、下列实验现象描述正确的是( )
A.硬水中滴加肥皂水,产生大量泡沫
B.铁丝在氧气中燃烧,火星四射
C.打开浓盐酸瓶盖,瓶口产生大量白烟
D.镁条在空气中燃烧,生成白色氧化镁
3、下列反应,属于中和反应的是( )
A.Zn+2HCl═ZnCl2+H2↑
B.CuO+2HCl═CuCl2+H2O
C.Cu(OH)2+H2SO4═CuSO4+2H2O
D.SO2+2NaOH═Na2SO3+H2O
4、现有①银和稀盐酸;②氢氧化钠固体和水;③硝酸铵固体和水;④镁和稀硫酸;⑤碳酸钠和稀盐酸五组物质。将各组中的两种物质在如图所示气密性良好的装置中相互混合,有气泡从水中逸出的是( )
A.③④⑤ B.①③⑤ C.②③④ D.②④⑤
5、氢氧化钠溶液和稀盐酸恰好完全反应,有关说法正确的是( )
A.反应后溶液中的粒子只有Na+、Cl-和H2O
B.反应前后溶剂质量不变
C.该反应的实质是NaOH+HCl═NaCl+H2O
D.反应前后阴、阳离子总数不变
6、下列实验中一定不可能用到盐酸的是( )
A.鉴别氢氧化钾和碳酸钾 B.除去碳粉中的氧化铜
C.实验室制取二氧化碳 D.干燥氧气
7、某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是( )
A.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.甲一定是碳酸盐
8、下列图象分别与选项中的操作相对应,其中合理的是( )
A、通电分解水 B、向一定量稀硫酸中加氧化铜
C、向饱和硝酸钾溶液中加硝酸钾 D、向一定量盐酸中滴加氢氧化钠溶液
9、白醋是家中常用的调料,其中醋酸是一种有机酸,家庭小实验中经常会用它来替代稀盐酸。下列实验不能完成的是( )
A.用铜丝和白醋制取氢气
B.用紫甘蓝、玫瑰花瓣的汁液做酸碱指示剂,滴入白醋中发生颜色变化
C.用碳酸钠和白醋得到二氧化碳
D.用白醋溶解鸡蛋壳(主要成分碳酸钙)
10、逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
A.中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应
B.化合物都是由不同种元素组成的,则不同种元素组成的纯净物一定是化合物
C.活泼金属能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是活泼金属
D.碱溶液的pH>7,则pH>7的溶液一定是碱溶液
11、生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
12、某实验小组使用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验过程中溶液pH的变化如图所示。下列说法中,正确的是( )
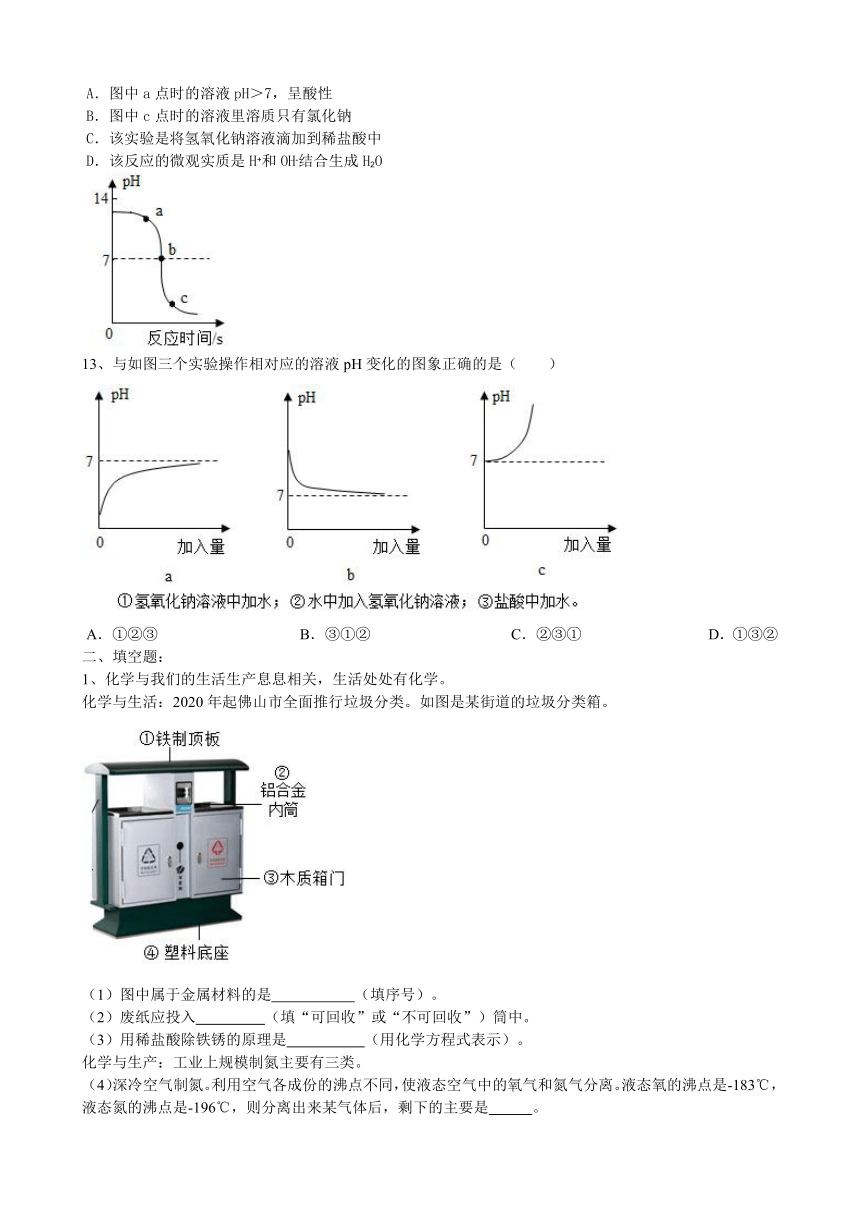
A.图中a点时的溶液pH>7,呈酸性
B.图中c点时的溶液里溶质只有氯化钠
C.该实验是将氢氧化钠溶液滴加到稀盐酸中
D.该反应的微观实质是H+和OH-结合生成H2O
13、与如图三个实验操作相对应的溶液pH变化的图象正确的是( )
A.①②③ B.③①② C.②③① D.①③②
二、填空题:
1、化学与我们的生活生产息息相关,生活处处有化学。
化学与生活:2020年起佛山市全面推行垃圾分类。如图是某街道的垃圾分类箱。
(1)图中属于金属材料的是 (填序号)。
(2)废纸应投入 (填“可回收”或“不可回收”)筒中。
(3)用稀盐酸除铁锈的原理是 (用化学方程式表示)。
化学与生产:工业上规模制氮主要有三类。
(4)深冷空气制氮。利用空气各成份的沸点不同,使液态空气中的氧气和氮气分离。液态氧的沸点是-183℃,液态氮的沸点是-196℃,则分离出来某气体后,剩下的主要是 。
(5)变压吸附制氮。利用碳分子筛对氮气进行吸附,可见碳分子筛与 一样具有疏松多孔的结构,可用于水的净化。
(6)膜分离制氮。利用中空纤维膜分离空气制取氮气。中空纤维膜还常用于自来水、地下水除菌除浊净化,使水中的微粒、细菌等不能通过滤膜而被去除。可见膜分离法净水的程度
(选填“高于”或“低于”、“等于”)吸附的方法。
2、小芳结合所学有关酸、碱的知识,用如图1所示总结了盐酸的四条化学性质(即盐酸与这四类物质能够发生化学反应)。
(1)为了验证性质①,小芳将紫色石蕊试液滴入盐酸中,溶液变成 色。
(2)依据性质②,盐酸常用于金属的除锈,用盐酸除去生锈铁钉表面铁锈的化学方程式为 。
(3)小明用微观示意图(图2)来说明性质③反应的发生过程,用化学反应方程式表示为 。从图2可以看出,该反应的微观实质是 。
(4)为了验证性质④反应能够发生,你选择的物质是 。
A.Na2CO3
B.CuSO4
C.NaCl
3、课堂上老师在进行中和反应的演示实验时,直接往氢氧化钠溶液中滴加稀盐酸,没有观察到明显现象,同学们对氢氧化钠与盐酸是否发生反应产生疑问。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】
(1)酸与碱发生中和反应会放出热量。
(2)碳酸钠溶液呈碱性。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 实验操作 现象 解释与结论
甲 向滴有酚酞溶液的氢氧化钠溶液中滴加稀盐酸 氢氧化钠与盐酸发生了化学反应
乙
U形玻璃中 边(填“左”或“右”)的红墨水液面上升 氢氧化钠与盐酸发生了化学反应
丙 用pH试纸测定滴加稀盐酸前后溶液pH的变化 滴加盐酸溶液后pH 7 氢氧化钠与盐酸发生了化学反应
【评价反思】(1)你认为哪位同学的实验设计方案不合理?理由是 。
(2)向一定量的NaOH溶液中滴加少量盐酸后,可以加入 (填字母)来证明两者发生了反应。
A.Fe2O3
B.NaCl溶液
C.Fe
D.酚酞溶液
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即刻消失了,出现此意外情况的原因可能是 (填字母)。
A.所用的酚酞试液变质了
B.所用的氢氧化钠溶液浓度太大
C.氢氧化钠溶液吸收了空气中二氧化碳而变质了
4、为了探究中和反应,甲、乙两名同学分别进行以下实验。
(1)甲同学向装有少量Ca(OH)2溶液的试管中倒入一定量的稀盐酸,然后滴加几滴酚酞试液,发现酚酞不变色,此现象 (填“能”或“不能”)说明盐酸与氢氧化钙发生了反应。写出该中和反应的化学方程式 。
若用pH试纸测得反应后溶液的pH=5,则该溶液中溶质的化学式为 。
(2)乙同学向滴有酚酞的NaOH溶液中逐滴加入稀盐酸,边滴加边振荡,“振荡”的目的是 ,滴加过程中,乙同学意外发现有气泡产生,通过思考认为该氢氧化钠溶液已变质,变质的原因是 (用化学方程式表示)。
(3)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 实验现象 实验结论
取样于试管中,先滴加 ,再滴加 。 氢氧化钠溶液部分变质
参考答案
一、选择题:
1、B 2、B 3、C 4、D 5、A 6、D 7、D 8、D 9、A 10、B
11、A 12、D 13、B
二、填空题:
1、答案:(1)①②;
(2)可回收;
(3)Fe2O3+6HCl═2FeCl3+3H2O;
(4)液氧;
(5)活性炭;
(6)高于。
2、答案:(1)红。
(2)Fe2O3+6HCl═2FeCl3+3H2O。
(3)NaOH+HCl═NaCl+H2O;氢离子和氢氧根离子结合生成水分子。
(4)A。
3、答案:【实验设计】溶液由红色变为无色;右;≤。
【评价反思】(1)乙同学,氢氧化钠溶于水放热。
(2)AC。
【拓展延伸】B。
4、答案:(1)能;Ca(OH)2+2HCl=CaCl2+2H2O;CaCl2、HCl。
(2)使药品充分接触;2NaOH+CO2=Na2CO3+H2O。
(3)过量CaCl2溶液(或BaCl2、Ba(NO3)2、Ca(NO3)2);酚酞溶液;有白色沉淀生成,溶液变红。
一、选择题:
1、稀硫酸中能使紫色石蕊试液变红色的微粒是( )
A.硫酸分子 B.氢离子 C.硫酸根离子 D.水分子
2、下列实验现象描述正确的是( )
A.硬水中滴加肥皂水,产生大量泡沫
B.铁丝在氧气中燃烧,火星四射
C.打开浓盐酸瓶盖,瓶口产生大量白烟
D.镁条在空气中燃烧,生成白色氧化镁
3、下列反应,属于中和反应的是( )
A.Zn+2HCl═ZnCl2+H2↑
B.CuO+2HCl═CuCl2+H2O
C.Cu(OH)2+H2SO4═CuSO4+2H2O
D.SO2+2NaOH═Na2SO3+H2O
4、现有①银和稀盐酸;②氢氧化钠固体和水;③硝酸铵固体和水;④镁和稀硫酸;⑤碳酸钠和稀盐酸五组物质。将各组中的两种物质在如图所示气密性良好的装置中相互混合,有气泡从水中逸出的是( )
A.③④⑤ B.①③⑤ C.②③④ D.②④⑤
5、氢氧化钠溶液和稀盐酸恰好完全反应,有关说法正确的是( )
A.反应后溶液中的粒子只有Na+、Cl-和H2O
B.反应前后溶剂质量不变
C.该反应的实质是NaOH+HCl═NaCl+H2O
D.反应前后阴、阳离子总数不变
6、下列实验中一定不可能用到盐酸的是( )
A.鉴别氢氧化钾和碳酸钾 B.除去碳粉中的氧化铜
C.实验室制取二氧化碳 D.干燥氧气
7、某同学总结的Ca(OH)2的化学性质如图。下列说法错误的是( )
A.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.甲一定是碳酸盐
8、下列图象分别与选项中的操作相对应,其中合理的是( )
A、通电分解水 B、向一定量稀硫酸中加氧化铜
C、向饱和硝酸钾溶液中加硝酸钾 D、向一定量盐酸中滴加氢氧化钠溶液
9、白醋是家中常用的调料,其中醋酸是一种有机酸,家庭小实验中经常会用它来替代稀盐酸。下列实验不能完成的是( )
A.用铜丝和白醋制取氢气
B.用紫甘蓝、玫瑰花瓣的汁液做酸碱指示剂,滴入白醋中发生颜色变化
C.用碳酸钠和白醋得到二氧化碳
D.用白醋溶解鸡蛋壳(主要成分碳酸钙)
10、逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
A.中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应
B.化合物都是由不同种元素组成的,则不同种元素组成的纯净物一定是化合物
C.活泼金属能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是活泼金属
D.碱溶液的pH>7,则pH>7的溶液一定是碱溶液
11、生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.C点生成氢气的质量等于D点生成氢气的质量
B.D点反应结束
C.CD段压强变化的主要因素是反应速度减慢
D.E点温度大于A点
12、某实验小组使用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验过程中溶液pH的变化如图所示。下列说法中,正确的是( )
A.图中a点时的溶液pH>7,呈酸性
B.图中c点时的溶液里溶质只有氯化钠
C.该实验是将氢氧化钠溶液滴加到稀盐酸中
D.该反应的微观实质是H+和OH-结合生成H2O
13、与如图三个实验操作相对应的溶液pH变化的图象正确的是( )
A.①②③ B.③①② C.②③① D.①③②
二、填空题:
1、化学与我们的生活生产息息相关,生活处处有化学。
化学与生活:2020年起佛山市全面推行垃圾分类。如图是某街道的垃圾分类箱。
(1)图中属于金属材料的是 (填序号)。
(2)废纸应投入 (填“可回收”或“不可回收”)筒中。
(3)用稀盐酸除铁锈的原理是 (用化学方程式表示)。
化学与生产:工业上规模制氮主要有三类。
(4)深冷空气制氮。利用空气各成份的沸点不同,使液态空气中的氧气和氮气分离。液态氧的沸点是-183℃,液态氮的沸点是-196℃,则分离出来某气体后,剩下的主要是 。
(5)变压吸附制氮。利用碳分子筛对氮气进行吸附,可见碳分子筛与 一样具有疏松多孔的结构,可用于水的净化。
(6)膜分离制氮。利用中空纤维膜分离空气制取氮气。中空纤维膜还常用于自来水、地下水除菌除浊净化,使水中的微粒、细菌等不能通过滤膜而被去除。可见膜分离法净水的程度
(选填“高于”或“低于”、“等于”)吸附的方法。
2、小芳结合所学有关酸、碱的知识,用如图1所示总结了盐酸的四条化学性质(即盐酸与这四类物质能够发生化学反应)。
(1)为了验证性质①,小芳将紫色石蕊试液滴入盐酸中,溶液变成 色。
(2)依据性质②,盐酸常用于金属的除锈,用盐酸除去生锈铁钉表面铁锈的化学方程式为 。
(3)小明用微观示意图(图2)来说明性质③反应的发生过程,用化学反应方程式表示为 。从图2可以看出,该反应的微观实质是 。
(4)为了验证性质④反应能够发生,你选择的物质是 。
A.Na2CO3
B.CuSO4
C.NaCl
3、课堂上老师在进行中和反应的演示实验时,直接往氢氧化钠溶液中滴加稀盐酸,没有观察到明显现象,同学们对氢氧化钠与盐酸是否发生反应产生疑问。
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】
(1)酸与碱发生中和反应会放出热量。
(2)碳酸钠溶液呈碱性。
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告。
同学 实验操作 现象 解释与结论
甲 向滴有酚酞溶液的氢氧化钠溶液中滴加稀盐酸 氢氧化钠与盐酸发生了化学反应
乙
U形玻璃中 边(填“左”或“右”)的红墨水液面上升 氢氧化钠与盐酸发生了化学反应
丙 用pH试纸测定滴加稀盐酸前后溶液pH的变化 滴加盐酸溶液后pH 7 氢氧化钠与盐酸发生了化学反应
【评价反思】(1)你认为哪位同学的实验设计方案不合理?理由是 。
(2)向一定量的NaOH溶液中滴加少量盐酸后,可以加入 (填字母)来证明两者发生了反应。
A.Fe2O3
B.NaCl溶液
C.Fe
D.酚酞溶液
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即刻消失了,出现此意外情况的原因可能是 (填字母)。
A.所用的酚酞试液变质了
B.所用的氢氧化钠溶液浓度太大
C.氢氧化钠溶液吸收了空气中二氧化碳而变质了
4、为了探究中和反应,甲、乙两名同学分别进行以下实验。
(1)甲同学向装有少量Ca(OH)2溶液的试管中倒入一定量的稀盐酸,然后滴加几滴酚酞试液,发现酚酞不变色,此现象 (填“能”或“不能”)说明盐酸与氢氧化钙发生了反应。写出该中和反应的化学方程式 。
若用pH试纸测得反应后溶液的pH=5,则该溶液中溶质的化学式为 。
(2)乙同学向滴有酚酞的NaOH溶液中逐滴加入稀盐酸,边滴加边振荡,“振荡”的目的是 ,滴加过程中,乙同学意外发现有气泡产生,通过思考认为该氢氧化钠溶液已变质,变质的原因是 (用化学方程式表示)。
(3)乙同学为了检验该氢氧化钠溶液的变质程度,设计实验方案并得出结论。
实验操作 实验现象 实验结论
取样于试管中,先滴加 ,再滴加 。 氢氧化钠溶液部分变质
参考答案
一、选择题:
1、B 2、B 3、C 4、D 5、A 6、D 7、D 8、D 9、A 10、B
11、A 12、D 13、B
二、填空题:
1、答案:(1)①②;
(2)可回收;
(3)Fe2O3+6HCl═2FeCl3+3H2O;
(4)液氧;
(5)活性炭;
(6)高于。
2、答案:(1)红。
(2)Fe2O3+6HCl═2FeCl3+3H2O。
(3)NaOH+HCl═NaCl+H2O;氢离子和氢氧根离子结合生成水分子。
(4)A。
3、答案:【实验设计】溶液由红色变为无色;右;≤。
【评价反思】(1)乙同学,氢氧化钠溶于水放热。
(2)AC。
【拓展延伸】B。
4、答案:(1)能;Ca(OH)2+2HCl=CaCl2+2H2O;CaCl2、HCl。
(2)使药品充分接触;2NaOH+CO2=Na2CO3+H2O。
(3)过量CaCl2溶液(或BaCl2、Ba(NO3)2、Ca(NO3)2);酚酞溶液;有白色沉淀生成,溶液变红。
