高中化学-鲁教版必修二3.1认识有机化合物 第2课时 有机化合物的结构特点 课件 30张
文档属性
| 名称 | 高中化学-鲁教版必修二3.1认识有机化合物 第2课时 有机化合物的结构特点 课件 30张 |

|
|
| 格式 | zip | ||
| 文件大小 | 719.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-02 00:00:00 | ||
图片预览







文档简介
(共30张PPT)
第3章 第1节 认识有机化合物
第2课时
有机化合物的结构特点
1.了解有机化合物中碳原子的成键特点及有机物种类繁多的
原因。
2.了解烷烃的概念、通式及结构特点。
3.了解烷烃的物理性质和化学性质。
4.理解同分异构体的概念,并会判断及书写简单烷烃的同分
异构体。
学习目标
碳原子成键特点和方式
a.碳原子需形成四个共价键;
d.碳原子的结合方式:链状和环状,还可带支链。
c.碳原子间的成键方式:单键、双键或三键;
b.碳原子之间或与其它原子都可以形成共价键;
有机物中碳原子的成键特点
阅读课本P62,自主学习
有机物中碳原子的成键方式
有机物种类繁多的原因
碳碳双键
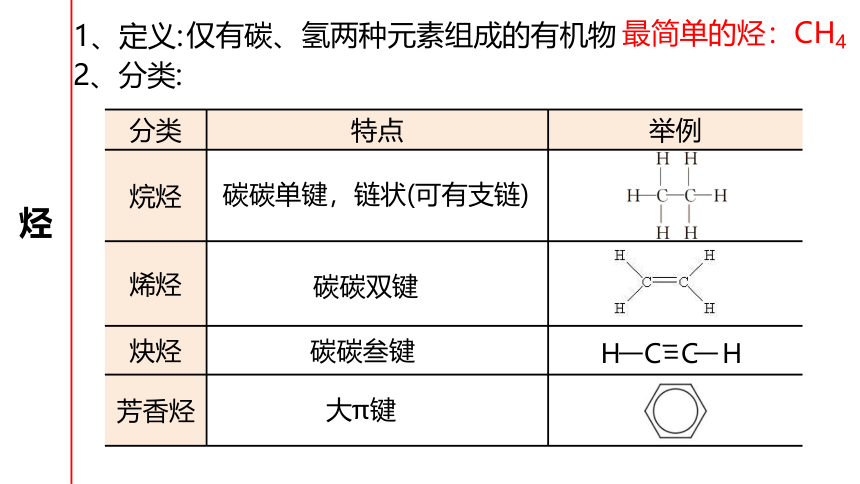
分类
特点
举例
烷烃
烯烃
炔烃
芳香烃
烃
1、定义:
仅有碳、氢两种元素组成的有机物
2、分类:
碳碳单键,链状(可有支链)
碳碳叁键
H
C=C
H
大π键
最简单的烃:CH4
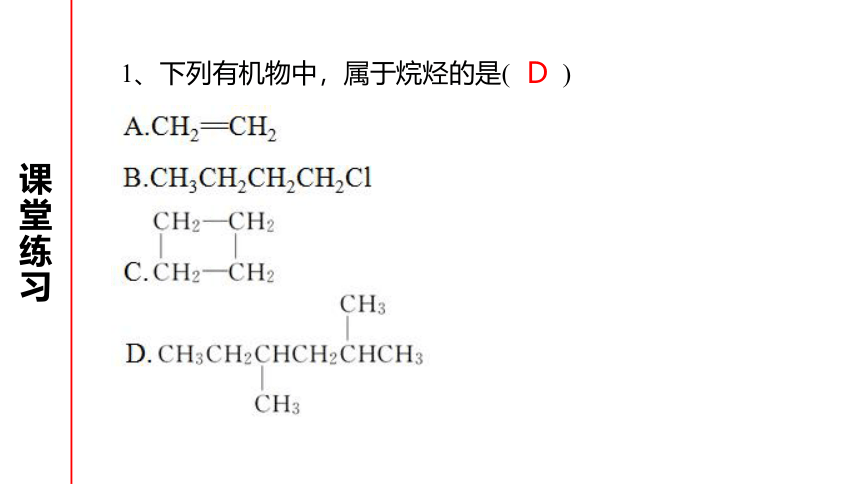
1、下列有机物中,属于烷烃的是(
)
课堂练习
D
1、命名:
碳原子数(n)及表示
n≤10
1
2
3
4
5
6
7
8
9
10
n>10
甲烷
乙烷
丙烷
丁烷
戊烷
己烷
庚烷
辛烷
壬烷
癸烷
相应数字+烷
烷
烃
注意:当n相同,结构不同时,用正、异、新表示。
如:C4H10的两种分子的命名:
无支链时,CH3CH2CH2CH3:正丁烷
有支链时,
:异丁烷
习惯命名法
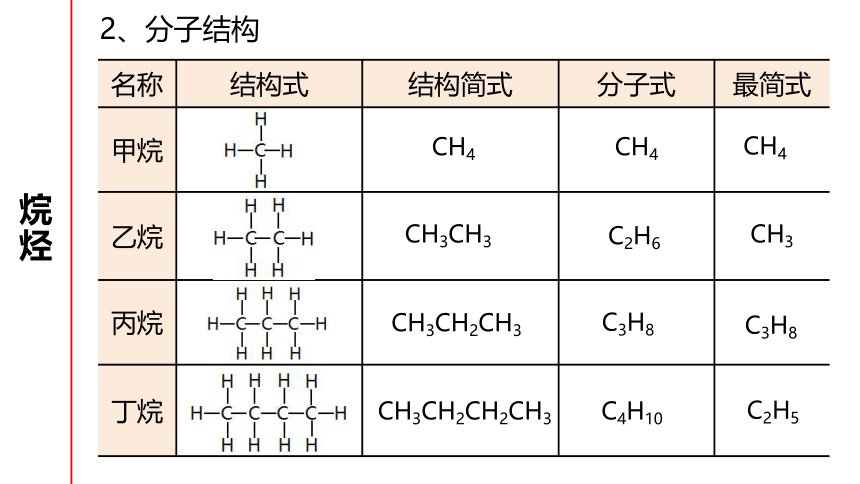
名称
结构式
结构简式
分子式
最简式
甲烷
乙烷
丙烷
丁烷
烷
烃
CH4
CH4
CH4
CH3CH2CH3
C3H8
C3H8
C4H10
CH3CH2CH2CH3
C2H5
2、分子结构
CH3CH3
C2H6
CH3
烷
烃
丙烷球棍模型
乙烷球棍模型
烷
烃
①
直链烷烃中的碳原子空间构型是折线形或锯齿状
(n≥3时)
②
烷烃的通式是CnH2n+2
烷烃是饱和烃,C
数一定的烷烃分子中H
数已达到最多
③
烷烃失去一个H原子剩余的原子团叫做烷基,一般用—R表示
(—CH3)
(符合此通式的一定是烷烃)
烷
烃
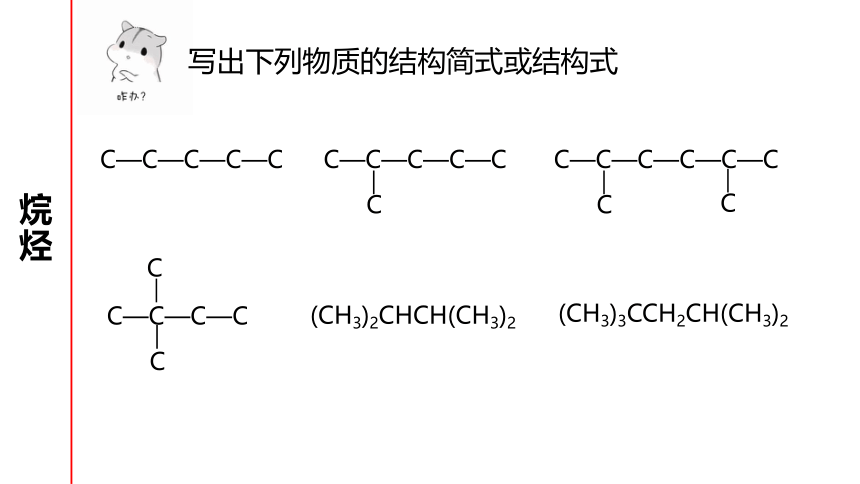
写出下列物质的结构简式或结构式
C—C—C—C—C
C—C—C—C—C—C
C
C
C—C—C—C—C
C
C—C—C—C
C
C
(CH3)2CHCH(CH3)2
(CH3)3CCH2CH(CH3)2
石蜡
烷
烃
随着碳原子数的递增,烷烃的物理性质呈现规律性的变化。
3、性质
(1)物理性质
状态由气体→液体→固体(n≤4的烷烃呈气态)。
熔、沸点逐渐升高,密度逐渐增大。
(新戊烷为气态)
在C数相同时,支链越多,沸点越低。
一般ρ烃<ρ水
烷
烃
3、性质
(2)化学性质
(同CH4类似)
稳定性:一般情况下与酸、碱、酸性高锰酸钾溶液都不反应。
取代反应:烷烃与Cl2等卤素单质光照时发生取代反应
氧化反应:烷烃都能燃烧,燃烧通式为
CnH2n+2+
O2
==
nCO2+(n+1)H2O
点燃
CH3CH3
+
Cl2
CH3CH2Cl(一氯乙烷)
+
HCl
光
结论:等物质的量的烷烃充分燃烧时,n越大,耗O2越多
2、下列属于烷烃特征性质的是( )
A.在空气中完全燃烧的产物只有CO2和H2O
B.它们都是非电解质,且几乎不溶于水
C.分子通式为CnH2n+2,可与氯气在光照下发生取代反应
D.不能使酸性高锰酸钾溶液退色,可与溴水中的溴发生取代反应
课堂练习
C
3、(2018·西安一中期中)下列物质的沸点按由高到低的顺序排列正确的是(
)
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3
A.②④①③
B.④②①③
C.④③②①
D.②④③①
课堂练习
结论:烷烃的C数越多,沸点越高。
在C数目相同时,支链越多,沸点越低
A
4、下列有关烷烃的叙述中,正确的是(
)
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色退去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水退色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥
B.①④⑥
C.②③④
D.①②③④
课堂练习
B
同分异构现象
阅读课本P63,自主学习
什么是同分异构体
1、定义:
CH3CH2CH2CH3
正丁烷
异丁烷
举例:
具有相同分子式而结构不同的化合物互为同分异构体。
有机物分子中的C数越多,同分异构体数目就越多。
2、规律:
举例:丁烷有2种,戊烷有3种,己烷有5种。
3、书写
——“减碳移位法”
主链由长到短,支链由整到散,
位置由心到边,排列同、邻到间
原
则
同分异构现象
举例:C5H12的同分异构体:
(1)写出最长碳链
C—C—C—C
(2)从主链取下一个C原子作为支链(即—CH3),画中心对称线,
将—CH3依次连在对称轴一侧的C原子上
(正戊烷)
C—C—C—C—C
①
②
C
(异戊烷)
C—C—C
(3)从主链取下2个C原子作为支链
1个—CH2CH3
2个—CH3
(定一移一)
C
C
(新戊烷)
注意:①
支链不能连在链端
②
—CH2CH3不能连在离链端的第2个C原子上
③
从主链取下的C数<主链剩余C数
同分异构现象
小组合作探究
C6H14的同分异构体有多少种
主链6碳:
C—C—C—C—C—C
(1种)
解析:
C—C—C—C—C
C
主链5碳:(2种)
C—C—C—C—C
C
主链4碳:(2种)
C—C—C—C
C
C
C—C—C—C
C
C
烃的一元取代物的同分异构体判断
-----“等效氢”法
同分异构现象
举例:C5H11Cl
步骤:(1)烃的碳链异构
(2)找等效氢
C—C—C—C
C
C—C—C
C
C
C—C—C—C—C
①
②
③
②
③
④
①
等效H判断:
同一个C原子上的H原子等效
镜面对称位置上的H原子等效
同一个C原子所连的—CH3上的H原子等效
等效氢原子种类
一般来说,同一个C原子上的H原子等效,同一个C原子所连的—CH3上的H原子等效,处于镜面对称位置上的H原子等效。
5、分子式为C4H10的烃的一氯代物的同分异构体有(
)
A.3种
B.4种
C.5种
D.6种
课堂练习
B
解析:
C—C—C—C
C—C—C
C
①
②
①
②
概念
适用
对象
结构
性质
同位素
质子数相同中子数不同的原子
原
子
原子核不同、原子核外电子排布相同
物理性质不同,化学性质相同
同素异形体
同一种元素形成的不同单质
单
质
单质的组成和结构不同
物理性质不同,化学性质相似
同分异构体
分子式相同结构不同的化合物
化
合
物
不同
物理性质不同,化学性质不一定相似
区别
6、在下列结构的有机物中,属于同分异构体的正确组合是(
)
A.②和⑤
B.②和③
C.①和②
D.③和④
课堂练习
B
7、(2018·大连高一检测)将下列物质进行分类:
(1)互为同位素的是____(填编号,下同)。
(2)互为同素异形体的是______。
(3)互为同分异构体的是___。
(4)属于同一种物质的是___。
①
②⑥
③
⑦
课堂练习
课堂小结
课堂小结
1、(2019·三门峡高一月考)下列关于烷烃的说法正确的是(
)
A.丙烷(C3H8)发生取代反应生成的C3H7Cl的结构只有一种
B.丙烷分子中3个碳原子在一条直线上
C.分子中含有7个碳原子的烷烃在常温下为液态
D.烷烃分子为直链式结构,不可以带支链
达标检测
C
2、下列有机物中,互为同分异构体的是(
)
①CH2==CHCH3
②
③CH3CH2CH3
④HC≡CCH3;⑤
⑥CH3CH2CH2CH3
A.①和②
B.①和③
C.①和④
D.⑤和⑥
达标检测
A
3、(2019·太原校级期中)下列化学性质中,烷烃不具备的是(
)
A.不能使溴水退色
B.可以在空气中燃烧
C.与Cl2发生取代反应
D.能使酸性KMnO4溶液退色
达标检测
D
CxHy+(x+
)O2
xCO2
+
H2O
y
4
y
2
点燃
烃的燃烧
烃的燃烧
(1)
烃等物质的量时,
值越大,耗O2量越多
(2)
烃等质量时,
值越大,耗O2量越多
y
x
烃燃烧时耗O2量的探究
结论:
CxHy+(x+
)O2
xCO2
+
H2O
y
4
y
2
点燃
烃的燃烧
烃的燃烧
气态烃燃烧前后气体体积的探究
结论:
(1)
T>100℃,H2O为气态
(2)
T<100℃,H2O为液态
?V=
-1
y
4
当y>4,反应后气体体积增加
当y=4,反应后气体体积不变
当y<4,反应后气体体积变小
?V=
-
-1
y
4
反应后气体体积变小
第3章 第1节 认识有机化合物
第2课时
有机化合物的结构特点
1.了解有机化合物中碳原子的成键特点及有机物种类繁多的
原因。
2.了解烷烃的概念、通式及结构特点。
3.了解烷烃的物理性质和化学性质。
4.理解同分异构体的概念,并会判断及书写简单烷烃的同分
异构体。
学习目标
碳原子成键特点和方式
a.碳原子需形成四个共价键;
d.碳原子的结合方式:链状和环状,还可带支链。
c.碳原子间的成键方式:单键、双键或三键;
b.碳原子之间或与其它原子都可以形成共价键;
有机物中碳原子的成键特点
阅读课本P62,自主学习
有机物中碳原子的成键方式
有机物种类繁多的原因
碳碳双键
分类
特点
举例
烷烃
烯烃
炔烃
芳香烃
烃
1、定义:
仅有碳、氢两种元素组成的有机物
2、分类:
碳碳单键,链状(可有支链)
碳碳叁键
H
C=C
H
大π键
最简单的烃:CH4
1、下列有机物中,属于烷烃的是(
)
课堂练习
D
1、命名:
碳原子数(n)及表示
n≤10
1
2
3
4
5
6
7
8
9
10
n>10
甲烷
乙烷
丙烷
丁烷
戊烷
己烷
庚烷
辛烷
壬烷
癸烷
相应数字+烷
烷
烃
注意:当n相同,结构不同时,用正、异、新表示。
如:C4H10的两种分子的命名:
无支链时,CH3CH2CH2CH3:正丁烷
有支链时,
:异丁烷
习惯命名法
名称
结构式
结构简式
分子式
最简式
甲烷
乙烷
丙烷
丁烷
烷
烃
CH4
CH4
CH4
CH3CH2CH3
C3H8
C3H8
C4H10
CH3CH2CH2CH3
C2H5
2、分子结构
CH3CH3
C2H6
CH3
烷
烃
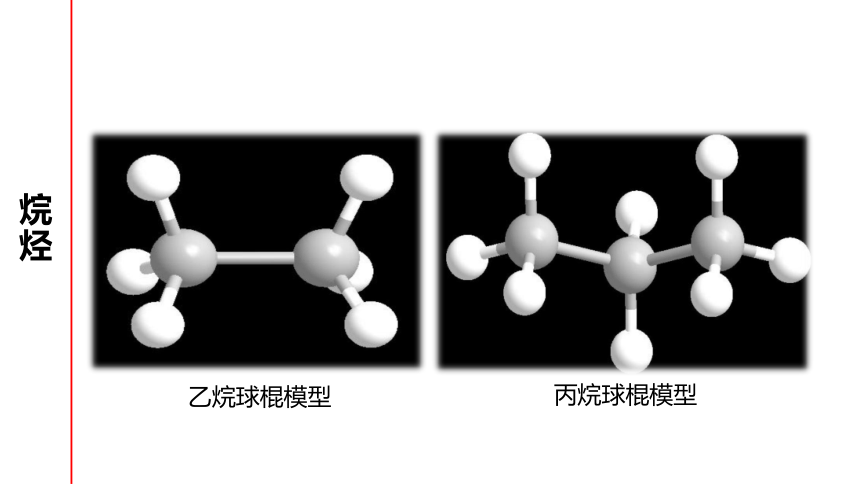
丙烷球棍模型
乙烷球棍模型
烷
烃
①
直链烷烃中的碳原子空间构型是折线形或锯齿状
(n≥3时)
②
烷烃的通式是CnH2n+2
烷烃是饱和烃,C
数一定的烷烃分子中H
数已达到最多
③
烷烃失去一个H原子剩余的原子团叫做烷基,一般用—R表示
(—CH3)
(符合此通式的一定是烷烃)
烷
烃
写出下列物质的结构简式或结构式
C—C—C—C—C
C—C—C—C—C—C
C
C
C—C—C—C—C
C
C—C—C—C
C
C
(CH3)2CHCH(CH3)2
(CH3)3CCH2CH(CH3)2
石蜡
烷
烃
随着碳原子数的递增,烷烃的物理性质呈现规律性的变化。
3、性质
(1)物理性质
状态由气体→液体→固体(n≤4的烷烃呈气态)。
熔、沸点逐渐升高,密度逐渐增大。
(新戊烷为气态)
在C数相同时,支链越多,沸点越低。
一般ρ烃<ρ水
烷
烃
3、性质
(2)化学性质
(同CH4类似)
稳定性:一般情况下与酸、碱、酸性高锰酸钾溶液都不反应。
取代反应:烷烃与Cl2等卤素单质光照时发生取代反应
氧化反应:烷烃都能燃烧,燃烧通式为
CnH2n+2+
O2
==
nCO2+(n+1)H2O
点燃
CH3CH3
+
Cl2
CH3CH2Cl(一氯乙烷)
+
HCl
光
结论:等物质的量的烷烃充分燃烧时,n越大,耗O2越多
2、下列属于烷烃特征性质的是( )
A.在空气中完全燃烧的产物只有CO2和H2O
B.它们都是非电解质,且几乎不溶于水
C.分子通式为CnH2n+2,可与氯气在光照下发生取代反应
D.不能使酸性高锰酸钾溶液退色,可与溴水中的溴发生取代反应
课堂练习
C
3、(2018·西安一中期中)下列物质的沸点按由高到低的顺序排列正确的是(
)
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3
A.②④①③
B.④②①③
C.④③②①
D.②④③①
课堂练习
结论:烷烃的C数越多,沸点越高。
在C数目相同时,支链越多,沸点越低
A
4、下列有关烷烃的叙述中,正确的是(
)
①在烷烃分子中,所有的化学键都是单键
②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色退去
③分子通式为CnH2n+2的烃不一定是烷烃
④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水退色
⑥所有的烷烃都可以在空气中燃烧
A.①②③⑥
B.①④⑥
C.②③④
D.①②③④
课堂练习
B
同分异构现象
阅读课本P63,自主学习
什么是同分异构体
1、定义:
CH3CH2CH2CH3
正丁烷
异丁烷
举例:
具有相同分子式而结构不同的化合物互为同分异构体。
有机物分子中的C数越多,同分异构体数目就越多。
2、规律:
举例:丁烷有2种,戊烷有3种,己烷有5种。
3、书写
——“减碳移位法”
主链由长到短,支链由整到散,
位置由心到边,排列同、邻到间
原
则
同分异构现象
举例:C5H12的同分异构体:
(1)写出最长碳链
C—C—C—C
(2)从主链取下一个C原子作为支链(即—CH3),画中心对称线,
将—CH3依次连在对称轴一侧的C原子上
(正戊烷)
C—C—C—C—C
①
②
C
(异戊烷)
C—C—C
(3)从主链取下2个C原子作为支链
1个—CH2CH3
2个—CH3
(定一移一)
C
C
(新戊烷)
注意:①
支链不能连在链端
②
—CH2CH3不能连在离链端的第2个C原子上
③
从主链取下的C数<主链剩余C数
同分异构现象
小组合作探究
C6H14的同分异构体有多少种
主链6碳:
C—C—C—C—C—C
(1种)
解析:
C—C—C—C—C
C
主链5碳:(2种)
C—C—C—C—C
C
主链4碳:(2种)
C—C—C—C
C
C
C—C—C—C
C
C
烃的一元取代物的同分异构体判断
-----“等效氢”法
同分异构现象
举例:C5H11Cl
步骤:(1)烃的碳链异构
(2)找等效氢
C—C—C—C
C
C—C—C
C
C
C—C—C—C—C
①
②
③
②
③
④
①
等效H判断:
同一个C原子上的H原子等效
镜面对称位置上的H原子等效
同一个C原子所连的—CH3上的H原子等效
等效氢原子种类
一般来说,同一个C原子上的H原子等效,同一个C原子所连的—CH3上的H原子等效,处于镜面对称位置上的H原子等效。
5、分子式为C4H10的烃的一氯代物的同分异构体有(
)
A.3种
B.4种
C.5种
D.6种
课堂练习
B
解析:
C—C—C—C
C—C—C
C
①
②
①
②
概念
适用
对象
结构
性质
同位素
质子数相同中子数不同的原子
原
子
原子核不同、原子核外电子排布相同
物理性质不同,化学性质相同
同素异形体
同一种元素形成的不同单质
单
质
单质的组成和结构不同
物理性质不同,化学性质相似
同分异构体
分子式相同结构不同的化合物
化
合
物
不同
物理性质不同,化学性质不一定相似
区别
6、在下列结构的有机物中,属于同分异构体的正确组合是(
)
A.②和⑤
B.②和③
C.①和②
D.③和④
课堂练习
B
7、(2018·大连高一检测)将下列物质进行分类:
(1)互为同位素的是____(填编号,下同)。
(2)互为同素异形体的是______。
(3)互为同分异构体的是___。
(4)属于同一种物质的是___。
①
②⑥
③
⑦
课堂练习
课堂小结
课堂小结
1、(2019·三门峡高一月考)下列关于烷烃的说法正确的是(
)
A.丙烷(C3H8)发生取代反应生成的C3H7Cl的结构只有一种
B.丙烷分子中3个碳原子在一条直线上
C.分子中含有7个碳原子的烷烃在常温下为液态
D.烷烃分子为直链式结构,不可以带支链
达标检测
C
2、下列有机物中,互为同分异构体的是(
)
①CH2==CHCH3
②
③CH3CH2CH3
④HC≡CCH3;⑤
⑥CH3CH2CH2CH3
A.①和②
B.①和③
C.①和④
D.⑤和⑥
达标检测
A
3、(2019·太原校级期中)下列化学性质中,烷烃不具备的是(
)
A.不能使溴水退色
B.可以在空气中燃烧
C.与Cl2发生取代反应
D.能使酸性KMnO4溶液退色
达标检测
D
CxHy+(x+
)O2
xCO2
+
H2O
y
4
y
2
点燃
烃的燃烧
烃的燃烧
(1)
烃等物质的量时,
值越大,耗O2量越多
(2)
烃等质量时,
值越大,耗O2量越多
y
x
烃燃烧时耗O2量的探究
结论:
CxHy+(x+
)O2
xCO2
+
H2O
y
4
y
2
点燃
烃的燃烧
烃的燃烧
气态烃燃烧前后气体体积的探究
结论:
(1)
T>100℃,H2O为气态
(2)
T<100℃,H2O为液态
?V=
-1
y
4
当y>4,反应后气体体积增加
当y=4,反应后气体体积不变
当y<4,反应后气体体积变小
?V=
-
-1
y
4
反应后气体体积变小
