化学与技术模块期中测试
图片预览



文档简介
期中测试题
(时间:100分钟 总分:108分)
选择题: (14×4′=56′,每小题1-2个答案)
1、在合成硫酸工业中,已经逐渐淘汰硫铁矿作为合成原料,原因是
A、硫铁矿废物多,处理成本高 B、硫铁矿资源已经匮乏
C、硫铁矿工艺不成熟 D、硫铁矿消耗能源高
2.氨的合成反应为N2+3H22NH3(正反应放热),在合成氨工业生产中应采取的适宜条件是
A.低温、高压、催化剂 B.高温、高压
C.尽可能的高温、高压 D.适当温度、适当高压、催化剂
3.以H2、CO为主要组成,供化学合成用的一种原料气叫做“合成气”.若用天然气为原料制合成气,可用“天然气蒸气转化”的反应:
CH4(g)+H2O(g) CO(g)+3H2(g);△H>0kJ/mol
生产时主要条件是温度、压强和水蒸气的配比,另外还要有适宜的催化剂.合成气里的H2可用于合成氨,CO最终分离出来后可用于合成甲醇、醋酸、乙二醇等,即新兴起的以分子中只含有一个碳原子的化合物为原料来合成化工产品的“C1化学”.下列说法不正确的是:
A.反应速率为3v(H2)=v(CH4)
B.温度为800℃~820℃,若超过1500℃反而不利
C.工业上为使平衡正向移动,要用过量的天然气
D.在加压的条件下,正反应速率会增大
4. 在接触法制硫酸的三个反应中① ② 2SO2(g)+O2(g)2SO3(g) ③ SO3+H2O=H2SO4其中对反应物纯度有严格要求的是
A. ① B. ② C. ③ D. ①②③
5.以下有关接触法制硫酸的论述错误的是
A、为提高反应速度和原料利用率,硫铁矿要在“沸腾”状态下燃烧
B、为防止催化剂中毒,气体在进接触室前要先净化
C、接触室中热交换器其主要作用是预热末反应的气体和冷却反应后的气体
D、吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部出来放空
6.下列事实中,不能用勒夏特列原理解释的是
A.由H2和N2合成氨时,在高压下进行是有利的
B.升高盛放水的密闭容器中的温度,水的蒸气压就增大
C.合成氨在高温下进行,加入催化剂使反应速率增加,这对氨的合成有利
D.降低压强,使N2O4的分解率增高
7.在接触法制硫酸工业中,在原料气相同情况下,测得压强对SO2平衡转化率的影响见下表:
根据上表数据考虑综合经济效益你认为SO2的接触氧化应在下列哪种压强下进行最为有利
A.0.1MPa B.0.5 MPa C.1 MPa D.10 Mpa
8.下列做法能改善空气质量的是
A. 以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源代替化石能源
C. 鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
9.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学,原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料 B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜 D.用二氧化硅制备高纯硅
电动车
10.随着世界人口的急剧增长、工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是
A.加入明矾,使海水的盐份沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
11.污水处理的主要方法有:①中和法 ②化学沉淀法 ③氧化还原法 ④过滤法
其中属于化学变化的是
A.①②③ B.①②④ C.②③④ D.①②③④
12.近年来,在我国部分海域中出现了大面积的“赤潮”,给当地渔业造成了重大损失,赤潮直接威胁着人类生存的环境,已经成为我国目前最主要的海洋灾害之一。下列关于赤潮发生原因的叙述正确的是
A.含氯化合物直接排入大海,引发赤潮的发生
B.赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果
C.含氮、磷的大量污水直接排入大海,导致某些浮游生物爆发性繁殖是赤潮发生的直接原因
D.空气中二氧化碳浓度升高,导致海洋温度升高,引发了赤潮的发生
13.目前,工业上冶炼铝通常采用的方法是
A.CO或氢气还原法 B.铝热反应法
C.电解法 D.热分解法
14.下列有关化工生产的说法中,不正确的是
A.工业上用热还原法冶炼铁:Fe2O3 +3CO3CO2 +2Fe
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.在铁管上镀锌,用铁管作阳极,锌块作阴极
D.利用反应:NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl制取NaHCO3时,应先通入过量的NH3,再通入过量的CO2
二、实验题(12分)
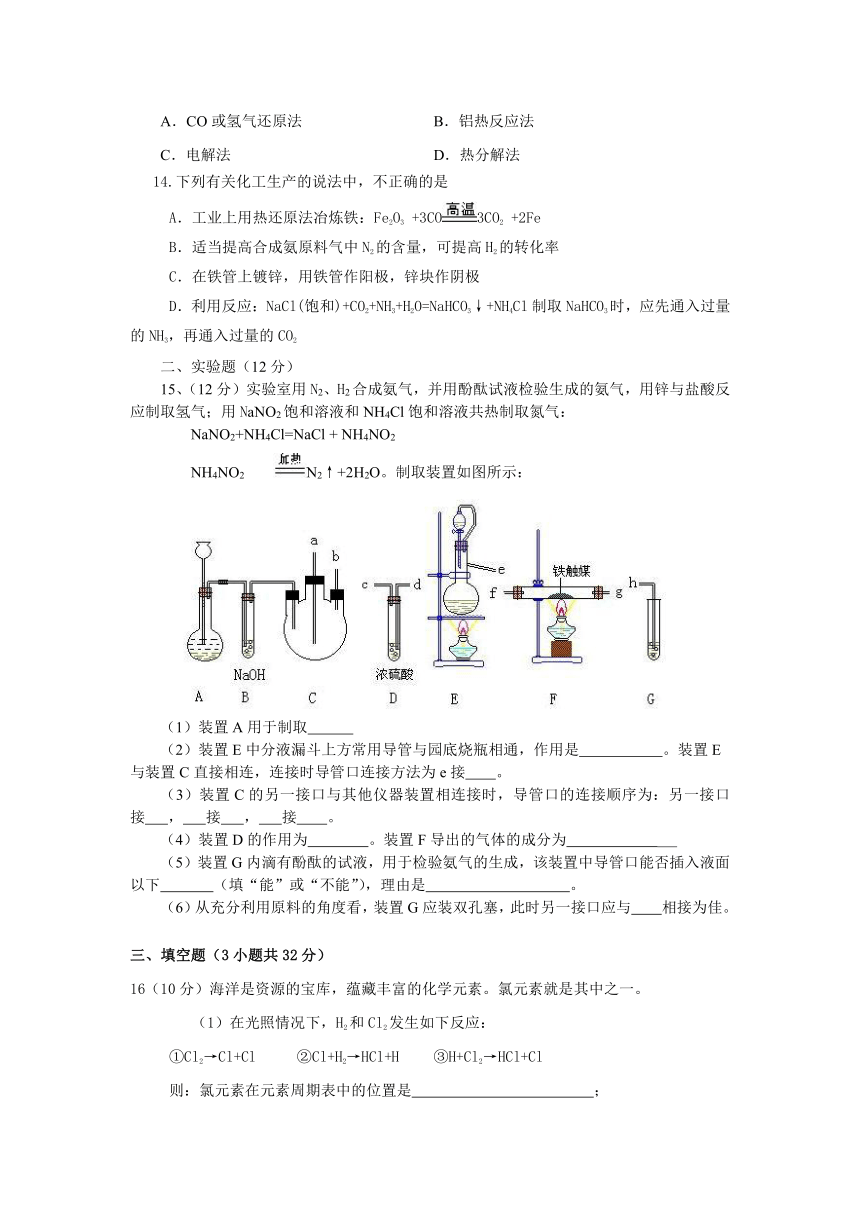
15、(12分)实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
NaNO2+NH4Cl=NaCl + NH4NO2
NH4NO2 N2↑+2H2O。制取装置如图所示:
(1)装置A用于制取
(2)装置E中分液漏斗上方常用导管与园底烧瓶相通,作用是 。装置E
与装置C直接相连,连接时导管口连接方法为e接 。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口 接 , 接 , 接 。
(4)装置D的作用为 。装置F导出的气体的成分为
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下 (填“能”或“不能”),理由是 。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与 相接为佳。
三、填空题(3小题共32分)
16(10分)海洋是资源的宝库,蕴藏丰富的化学元素。氯元素就是其中之一。
(1)在光照情况下,H2和Cl2发生如下反应:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
则:氯元素在元素周期表中的位置是 ;
在短周期主族元素中与氯元素相邻元素原有半径从大到小顺序是
反应②中形成的化学键属于 (填“离子键”或“共价键”)
(2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
毒液发生器,为使Cl2完全吸收,则a为 极(填
“正”、“负”);与b极相连石墨电极上发生反应的电极反应
式 。
(3)常温下,将NaCl固体放入烧杯中,加入适量水充分溶解后,
烧杯中仍有少量NaCl固体;再向烧杯的www.气
体,法线烧杯中固体增多。请分析原因:
(4)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.
b.
c.
d.
②溶液中存在:,则该反应常温下的平衡常数K= (已知:常温下,的电离平衡常数Kb=1.7×10—5 mol·L—1)
17、(12分)(1)环境专家认为可以用金属铝将水体中的NO转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH、Al(OH)3、NO、N2,请将各粒子分别填入以下空格内(不用配平)。
+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为 L(标准状况)。
18.(10分)下面是新设的一组垃圾箱及说明:
厦门市生活垃圾分类
可回收垃圾 . 有害垃圾
1.纸类2.玻璃3.金属4.塑料.胶6.纺织品[来源:学科.XK] 1.厨房垃圾.土3.杂草4.枯枝5.花卉 1.日光灯管2.电池3.喷雾罐4.指甲油瓶5.药品药瓶6.涂改液瓶
(1)小明在整理房间时,清理出如下物品,它们应分别放入哪个垃圾箱.序号):
A.废作业本;B.汽水易拉罐;C.铁钉;D.矿泉水瓶;E.烂苹果;F.涂改液瓶
.放入“可回收垃圾箱”的是________;应放入“不可回收垃圾箱”的是[来源:学#. X#X#K]
________;应放入“有害垃圾箱”的是________.
(2)小明用盐酸除去铁钉上的锈(主要成分为氧化铁),以重新使用它,请写出除锈的
化学方程式:____________________________.
(3)废铜有二种回收方法:
方法一:Cu+4HNO3=== Cu(NO3)2+2X↑+2H2O(X是一种大气污染物)
方法二:铜在空气中加热生成氧化铜,氧化铜再与盐酸反应生成氯化铜和水.
①方法一中,X的化学式为:________;方法二的优点是:___________________;
②请写出从氯化铜溶液中提取铜的化学方程式:___________________________;
该反应属于化学反应的基本类型是________.
(4)请从可回收垃圾的类型中,举出一例说说化学的研究成果给社会进步带来的贡
献: _________________________________________________________________
______________________________________________________________________
______________________________________________________________________.
四、计算题(共8分)
19、(8分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则:
(1)该厂每小时消耗标准状况下空气的体积为_____________________。
(2)为满足题设要求,b%的下限等于______________________。
参考答案:
1.A 2.D 3.AC 4.B 5.D 6.C 7.C 8.B 9.A 10.A 11.A 12.C 13.C 14.C
15、(12分)(1)H2 (1分)(2)使液体便于顺利滴加;b(2分)
(3)a,d,c,f,g,h (3分)(4)干燥N2和H2;NH3、N2和H2(2分)
(5)不能;NH3极易溶于水并发生倒吸(2分) (6)另一接口与d相连。(2分)
说明:N2+3H22NH3为可逆反应,为了提高原料利用率,反应物应按一定比例混合均匀,另外将气体循环利用。
16、(10分)答案:(1)第三周期,ⅦA(1分);S>Cl>F(1分);共价键(1分)
(2)负(1分);2↑(2分);
(3)饱和NaCl溶液中存在:的溶解平衡,通入HCl,溶液中Cl—浓度增大,平衡左移,故NaCl固体增多。(2分)
(4)①b(2分)②5.9×10—8 mol·L—1(2分)
17、(12分)答案: (每空2分,共12分)
(1)NO+Al+H2O→Al(OH)3+N2+OH- 5:3
(2)2H2O+O2+4e-=4OH-
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。
(3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
(4)2.016
18.(10分) 解析:(1)生活垃圾的处理应根据垃圾的成分分类处理,有些可回收再利用,有些不
可回收的要进行处理.
(2)除铁钉上的铁锈可用稀盐酸.
(3)方法一中HNO3被铜还原,由方程式可知应为NO2,会对空气造成污染,方法二
不会产生污染性气体,从CuCl2溶液中提取Cu,可用废铁屑置换,CuCl2+
Fe===FeCl2+Cu.
(4)可结合题给表中的垃圾类型,联想与可回收垃圾有关的化学应用成果回答,这是
一个开放性问题,可从以下几个方面回答:①三大合成材料的制造、应用,②金属
的制造、应用,③玻璃,④纸张的制造、回收等.
答案:(1)A、B、C、D E F
(2)Fe2O3+6HCl===2FeCl3+3H2O
(3)①NO2 没有污染物生成[来源:Z.
②Fe+CuCl2===Cu+FeCl2 置换反应
(4)①三大合成材料的制造、应用,防治污染;②金属的制造、开采、应用、合金、
保护、回收;③玻璃等无机材料;④纸张的发展、特种纸的开发、纸的制造和回收
(任选一例)
19、(8分)
NO
(时间:100分钟 总分:108分)
选择题: (14×4′=56′,每小题1-2个答案)
1、在合成硫酸工业中,已经逐渐淘汰硫铁矿作为合成原料,原因是
A、硫铁矿废物多,处理成本高 B、硫铁矿资源已经匮乏
C、硫铁矿工艺不成熟 D、硫铁矿消耗能源高
2.氨的合成反应为N2+3H22NH3(正反应放热),在合成氨工业生产中应采取的适宜条件是
A.低温、高压、催化剂 B.高温、高压
C.尽可能的高温、高压 D.适当温度、适当高压、催化剂
3.以H2、CO为主要组成,供化学合成用的一种原料气叫做“合成气”.若用天然气为原料制合成气,可用“天然气蒸气转化”的反应:
CH4(g)+H2O(g) CO(g)+3H2(g);△H>0kJ/mol
生产时主要条件是温度、压强和水蒸气的配比,另外还要有适宜的催化剂.合成气里的H2可用于合成氨,CO最终分离出来后可用于合成甲醇、醋酸、乙二醇等,即新兴起的以分子中只含有一个碳原子的化合物为原料来合成化工产品的“C1化学”.下列说法不正确的是:
A.反应速率为3v(H2)=v(CH4)
B.温度为800℃~820℃,若超过1500℃反而不利
C.工业上为使平衡正向移动,要用过量的天然气
D.在加压的条件下,正反应速率会增大
4. 在接触法制硫酸的三个反应中① ② 2SO2(g)+O2(g)2SO3(g) ③ SO3+H2O=H2SO4其中对反应物纯度有严格要求的是
A. ① B. ② C. ③ D. ①②③
5.以下有关接触法制硫酸的论述错误的是
A、为提高反应速度和原料利用率,硫铁矿要在“沸腾”状态下燃烧
B、为防止催化剂中毒,气体在进接触室前要先净化
C、接触室中热交换器其主要作用是预热末反应的气体和冷却反应后的气体
D、吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部出来放空
6.下列事实中,不能用勒夏特列原理解释的是
A.由H2和N2合成氨时,在高压下进行是有利的
B.升高盛放水的密闭容器中的温度,水的蒸气压就增大
C.合成氨在高温下进行,加入催化剂使反应速率增加,这对氨的合成有利
D.降低压强,使N2O4的分解率增高
7.在接触法制硫酸工业中,在原料气相同情况下,测得压强对SO2平衡转化率的影响见下表:
根据上表数据考虑综合经济效益你认为SO2的接触氧化应在下列哪种压强下进行最为有利
A.0.1MPa B.0.5 MPa C.1 MPa D.10 Mpa
8.下列做法能改善空气质量的是
A. 以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源代替化石能源
C. 鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
9.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学,原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料 B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜 D.用二氧化硅制备高纯硅
电动车
10.随着世界人口的急剧增长、工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是
A.加入明矾,使海水的盐份沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
11.污水处理的主要方法有:①中和法 ②化学沉淀法 ③氧化还原法 ④过滤法
其中属于化学变化的是
A.①②③ B.①②④ C.②③④ D.①②③④
12.近年来,在我国部分海域中出现了大面积的“赤潮”,给当地渔业造成了重大损失,赤潮直接威胁着人类生存的环境,已经成为我国目前最主要的海洋灾害之一。下列关于赤潮发生原因的叙述正确的是
A.含氯化合物直接排入大海,引发赤潮的发生
B.赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果
C.含氮、磷的大量污水直接排入大海,导致某些浮游生物爆发性繁殖是赤潮发生的直接原因
D.空气中二氧化碳浓度升高,导致海洋温度升高,引发了赤潮的发生
13.目前,工业上冶炼铝通常采用的方法是
A.CO或氢气还原法 B.铝热反应法
C.电解法 D.热分解法
14.下列有关化工生产的说法中,不正确的是
A.工业上用热还原法冶炼铁:Fe2O3 +3CO3CO2 +2Fe
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
C.在铁管上镀锌,用铁管作阳极,锌块作阴极
D.利用反应:NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl制取NaHCO3时,应先通入过量的NH3,再通入过量的CO2
二、实验题(12分)
15、(12分)实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
NaNO2+NH4Cl=NaCl + NH4NO2
NH4NO2 N2↑+2H2O。制取装置如图所示:
(1)装置A用于制取
(2)装置E中分液漏斗上方常用导管与园底烧瓶相通,作用是 。装置E
与装置C直接相连,连接时导管口连接方法为e接 。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口 接 , 接 , 接 。
(4)装置D的作用为 。装置F导出的气体的成分为
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下 (填“能”或“不能”),理由是 。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与 相接为佳。
三、填空题(3小题共32分)
16(10分)海洋是资源的宝库,蕴藏丰富的化学元素。氯元素就是其中之一。
(1)在光照情况下,H2和Cl2发生如下反应:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
则:氯元素在元素周期表中的位置是 ;
在短周期主族元素中与氯元素相邻元素原有半径从大到小顺序是
反应②中形成的化学键属于 (填“离子键”或“共价键”)
(2)某同学用石墨作电极,设计一种如右图所示的家用环保型消
毒液发生器,为使Cl2完全吸收,则a为 极(填
“正”、“负”);与b极相连石墨电极上发生反应的电极反应
式 。
(3)常温下,将NaCl固体放入烧杯中,加入适量水充分溶解后,
烧杯中仍有少量NaCl固体;再向烧杯的www.气
体,法线烧杯中固体增多。请分析原因:
(4)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.
b.
c.
d.
②溶液中存在:,则该反应常温下的平衡常数K= (已知:常温下,的电离平衡常数Kb=1.7×10—5 mol·L—1)
17、(12分)(1)环境专家认为可以用金属铝将水体中的NO转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH、Al(OH)3、NO、N2,请将各粒子分别填入以下空格内(不用配平)。
+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
则反应过程中产生氢气的总体积为 L(标准状况)。
18.(10分)下面是新设的一组垃圾箱及说明:
厦门市生活垃圾分类
可回收垃圾 . 有害垃圾
1.纸类2.玻璃3.金属4.塑料.胶6.纺织品[来源:学科.XK] 1.厨房垃圾.土3.杂草4.枯枝5.花卉 1.日光灯管2.电池3.喷雾罐4.指甲油瓶5.药品药瓶6.涂改液瓶
(1)小明在整理房间时,清理出如下物品,它们应分别放入哪个垃圾箱.序号):
A.废作业本;B.汽水易拉罐;C.铁钉;D.矿泉水瓶;E.烂苹果;F.涂改液瓶
.放入“可回收垃圾箱”的是________;应放入“不可回收垃圾箱”的是[来源:学#. X#X#K]
________;应放入“有害垃圾箱”的是________.
(2)小明用盐酸除去铁钉上的锈(主要成分为氧化铁),以重新使用它,请写出除锈的
化学方程式:____________________________.
(3)废铜有二种回收方法:
方法一:Cu+4HNO3=== Cu(NO3)2+2X↑+2H2O(X是一种大气污染物)
方法二:铜在空气中加热生成氧化铜,氧化铜再与盐酸反应生成氯化铜和水.
①方法一中,X的化学式为:________;方法二的优点是:___________________;
②请写出从氯化铜溶液中提取铜的化学方程式:___________________________;
该反应属于化学反应的基本类型是________.
(4)请从可回收垃圾的类型中,举出一例说说化学的研究成果给社会进步带来的贡
献: _________________________________________________________________
______________________________________________________________________
______________________________________________________________________.
四、计算题(共8分)
19、(8分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则:
(1)该厂每小时消耗标准状况下空气的体积为_____________________。
(2)为满足题设要求,b%的下限等于______________________。
参考答案:
1.A 2.D 3.AC 4.B 5.D 6.C 7.C 8.B 9.A 10.A 11.A 12.C 13.C 14.C
15、(12分)(1)H2 (1分)(2)使液体便于顺利滴加;b(2分)
(3)a,d,c,f,g,h (3分)(4)干燥N2和H2;NH3、N2和H2(2分)
(5)不能;NH3极易溶于水并发生倒吸(2分) (6)另一接口与d相连。(2分)
说明:N2+3H22NH3为可逆反应,为了提高原料利用率,反应物应按一定比例混合均匀,另外将气体循环利用。
16、(10分)答案:(1)第三周期,ⅦA(1分);S>Cl>F(1分);共价键(1分)
(2)负(1分);2↑(2分);
(3)饱和NaCl溶液中存在:的溶解平衡,通入HCl,溶液中Cl—浓度增大,平衡左移,故NaCl固体增多。(2分)
(4)①b(2分)②5.9×10—8 mol·L—1(2分)
17、(12分)答案: (每空2分,共12分)
(1)NO+Al+H2O→Al(OH)3+N2+OH- 5:3
(2)2H2O+O2+4e-=4OH-
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。
(3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
(4)2.016
18.(10分) 解析:(1)生活垃圾的处理应根据垃圾的成分分类处理,有些可回收再利用,有些不
可回收的要进行处理.
(2)除铁钉上的铁锈可用稀盐酸.
(3)方法一中HNO3被铜还原,由方程式可知应为NO2,会对空气造成污染,方法二
不会产生污染性气体,从CuCl2溶液中提取Cu,可用废铁屑置换,CuCl2+
Fe===FeCl2+Cu.
(4)可结合题给表中的垃圾类型,联想与可回收垃圾有关的化学应用成果回答,这是
一个开放性问题,可从以下几个方面回答:①三大合成材料的制造、应用,②金属
的制造、应用,③玻璃,④纸张的制造、回收等.
答案:(1)A、B、C、D E F
(2)Fe2O3+6HCl===2FeCl3+3H2O
(3)①NO2 没有污染物生成[来源:Z.
②Fe+CuCl2===Cu+FeCl2 置换反应
(4)①三大合成材料的制造、应用,防治污染;②金属的制造、开采、应用、合金、
保护、回收;③玻璃等无机材料;④纸张的发展、特种纸的开发、纸的制造和回收
(任选一例)
19、(8分)
NO
