高中化学鲁科版(2019)必修第二册 第2章 单元测试卷
文档属性
| 名称 | 高中化学鲁科版(2019)必修第二册 第2章 单元测试卷 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-10 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高中化学鲁科版(2019)必修第二册 第2章测试卷
一、单选题(共12题;共24分)
1.下列过程中,将电能转化为化学能的是(?? )
A.?风力发电机 ?B.?天然气烧水
C.?硅太阳能电池 ??D.?电解熔融氯化钠
2.下列物质既含有离子键,又含有共价键的是(?? )
A.?H2S???????????????????????????????B.?Na2S???????????????????????????????C.?H2SO4???????????????????????????????D.?(NH4)2SO4
3.下列关于非金属元素和金属元素特征的叙述不正确的是( ??)
①非金属元素可能有还_?????§?????????è??_有氧化性;②非金属元素只能形成共价化合物;③金属阳离子被还原不一定得到金属单质;④金属元素不可能存在于阴离子中;21世纪教育网版权所有
⑤金属元素与非金属元素形成的化合物一定是离子化合物
A.?①③??????????????????????????????????B.?②③??????????????????????????????????C.?③④⑤??????????????????????????????????D.?②④⑤
4.某原电池,_?°???¤é???±?X???_Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则下列情况中有可能的是( ??) www-2-1-cnjy-com
A.?X是负极,电解质溶液为CuSO4溶液 B.?X是负极,电解质溶液为H2SO4溶液
C.?X是正极,电解质溶液为CuSO4溶液 D.?X是正极,电解质溶液为H2SO4溶液
5.某碱性电池的总反应为 ,工作原理如图所示,下列说法错误的是(??? )
A.?石墨电极为正极,发生氧化反应
B.?电池工作时, 移向 电极
C.?电池工作一段时间后,电解质溶液的pH减小
???D.?外电路中电子流动方向: 灯泡 (石墨)
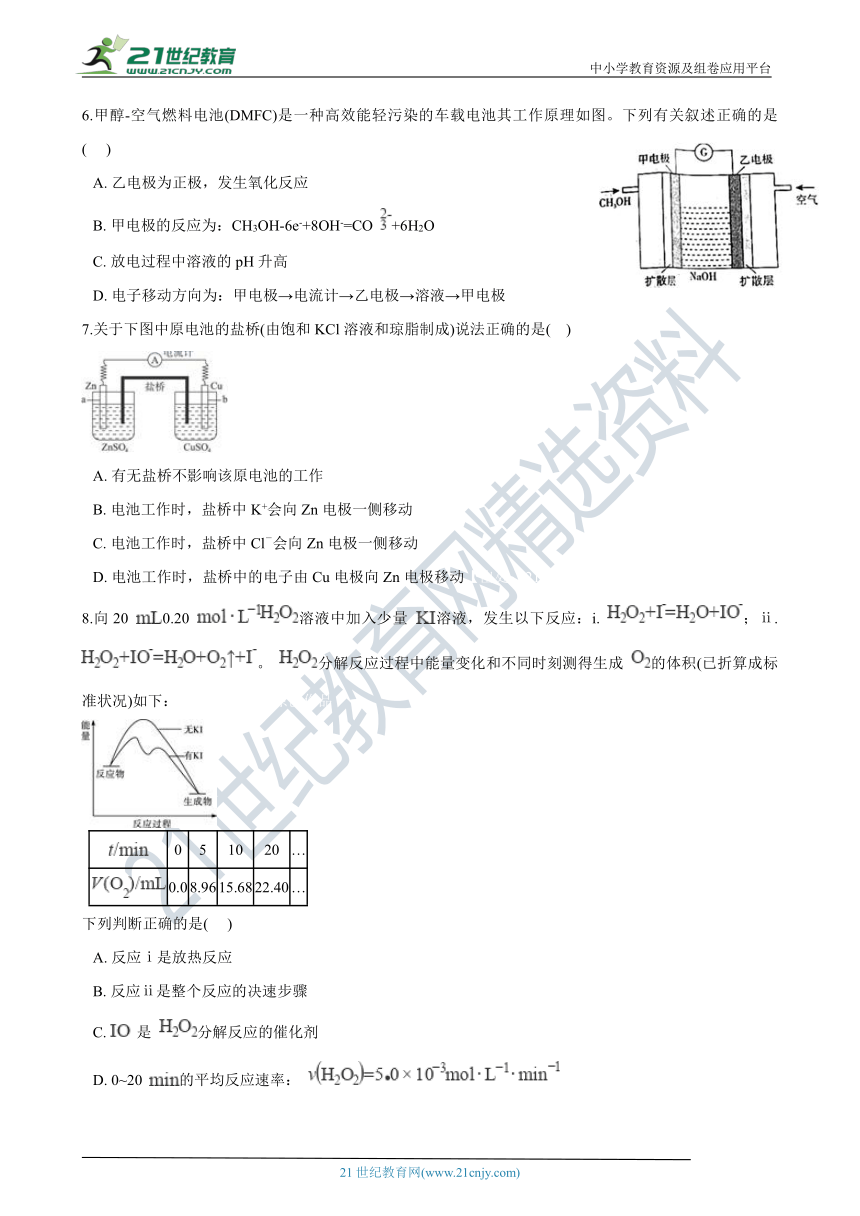
6.甲醇-空气燃料电池(DMFC)是一种高效能轻污染的车载电池其工作原理如图。下列有关叙述正确的是(??? )
A.?乙电极为正极,发生氧化反应???????????
B.?甲电极的反应为:CH3OH-6e-+8OH-=CO +6H2O
C.?放电过程中溶液的pH升高????????????????
D.?电子移动方向为:甲电极→电流计→乙电极→溶液→甲电极
7.关于下图中原电池的盐桥(由饱和KCl溶液和琼脂制成)说法正确的是(?? )
A.?有无盐桥不影_???è?????????±????_工作
B.?电池工作时,盐桥中K+会向Zn电极一侧移动
C.?电池工作时,盐桥中Cl-会向Zn电极一侧移动
D.?电池工作时,盐桥中的电子由Cu电极向Zn电极移动【出处:21教育名师】
8.向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下: 21教育名师原创作品
0 5 10 20 …
0.0 8.96 15.68 22.40 …
下列判断正确的是(??? )
A.?反应ⅰ是放热反应
B.?反应ⅱ是整个反应的决速步骤
C.?是 分解反应的催化剂
D.?0~20 的平均反应速率:
9.一定温度下的密闭容器中发生C(s)+H2O(g) CO(g)+H2(g)-Q(Q>0),达到化学平衡后(??? )
A.?加入更多的C,平衡正向移动?????????????????????????B.?升高温度,平衡逆向移动
C.?增大压强,平衡逆向移动????????????????????????????????D.?加入催化剂,CO的浓度增大2-1-c-n-j-y
10.已知反应2CO(g)+4H2(g) CH2=CH2(g)+2H2O(g)在不同条件下的化学反应速率如下,其中表示反应速率最快的是(??? )
A.?v(H2O)=0.1mol·L-1·s-1??????????????????????????????????????B.?v(H2)=4.5mol·L-1·s-1
C.?v(CH2=CH2)=0.03mol·L-1·s-1????????????????????????????D.?v(CO)=1.5mol·L-1·s-1
11.过量的铁粉与100mL0.01mol·L﹣1的稀盐酸反应。为了减慢反应速率而不改变H2的产量,可以使用如下方法中的(??? )
①加H2O?_??_____??_??????N_aOH固体?? ? ③将盐酸用量减半,浓度不变???
④加CuO固体??? ⑤加NaCl溶液??? ⑥加入硝酸钾溶液??? ⑦降低温度(不考虑盐酸挥发)
A.?①⑤⑦????????????????????????????????B.?①⑤⑥⑦????????????????????????????????C.?③⑦????????????????????????????????D.?②④⑥
12.在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,下列说法正确的是( ??)
A.?温度:T2>T1?????????????B.?压强:P1>P2?????????????C.?该正反应是吸热反应?????????????D.?x的取值是:x=1
二、综合题(共5题;共39分)
13.在一个密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。回答下列问题:
(1)增加Fe的量,反应速率________(填“增大”“不变”或“减小”,下同)。
(2)将容器容积缩小一半,反应速率________。
(3)保持容器容积不变,充入N2使体系压强增大,反应速率________。
(4)保持压强不变,充入N2使容器容积增大,正反应速率________,逆反应速率________。
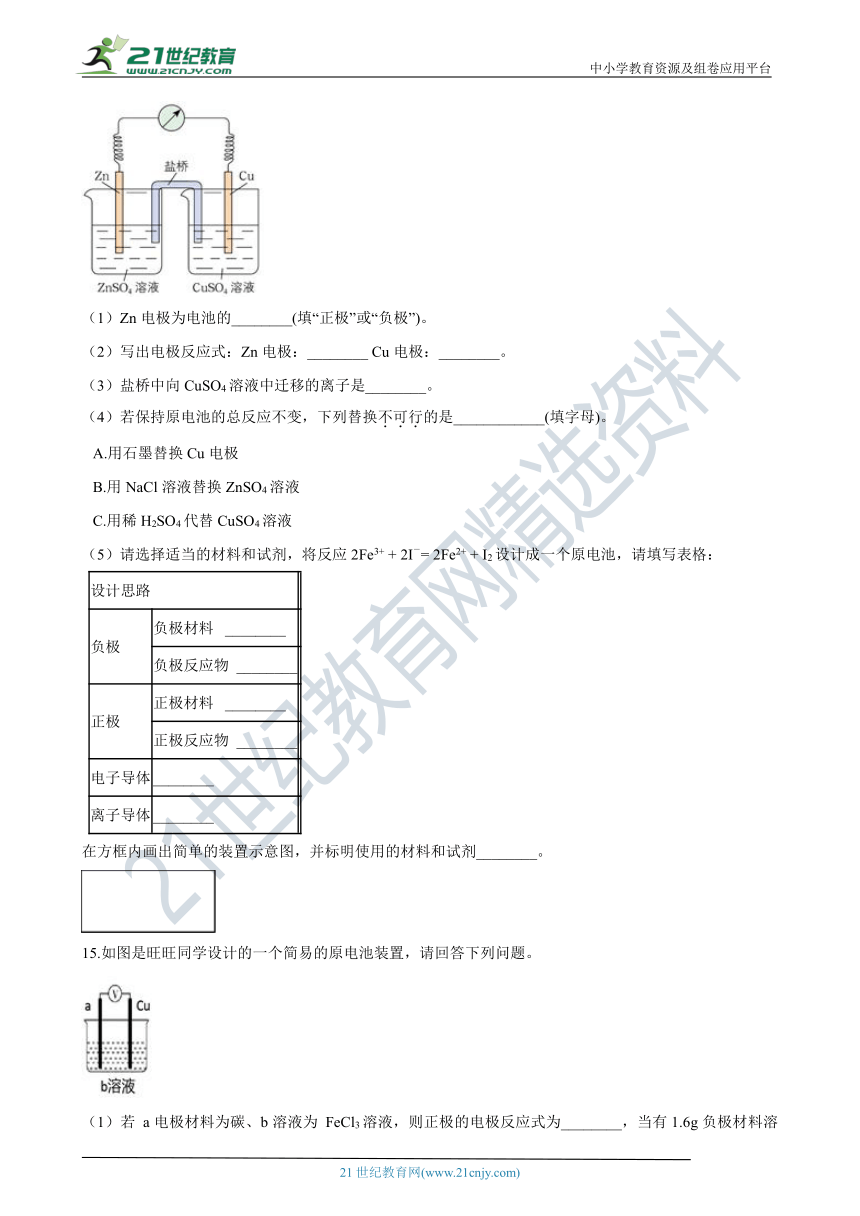
14.如图为铜锌原电池的装置示意图,其中盐桥内装琼脂-饱和KCl溶液。请回答下列问题:
(1)Zn电极为电池的________(填“正极”或“负极”)。
(2)写出电极反应式:Zn电极:________ Cu电极:________。
(3)盐桥中向CuSO4溶液中迁移的离子是________。
(4)若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。
A.用石墨替换Cu电极
B.用NaCl溶液替换ZnSO4溶液
C.用稀H2SO4代替CuSO4溶液
(5)请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:
设计思路
负极 负极材料? ________
负极反应物 ________
正极 正极材料? ________
正极反应物 ________
电子导体 ________
离子导体 ________
在方框内画出简单的装置示意图,并标明使用的材料和试剂________。
15.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。
(1)若 a电极材料为_??????b?????????_ FeCl3溶液,则正极的电极反应式为________,当有1.6g负极材料溶解时,转移的电子为________mol; 2·1·c·n·j·y
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为________→ ________(填电极材料,下同),溶液中的NO 向________极移动; 【来源:21·世纪·教育·网】
(3)氢氧燃_???????±??·???¨???_航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________。 【来源:21cnj*y.co*m】
16.为了研究碳酸钙与盐_é?????????????????_速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。 21*cnjy*com
(1)化学反应速率最快的时间段是________,原因是________
A.0~t1 ???????B.t1~t2 C.t2~t3 ??????????D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的是________;
A.通入HCl
B.NaCl固体
C.NaCl溶液
D.蒸馏水
(3)若盐酸_?????????????§????_20 mL,图中CO2的体积是标准状况下的体积,则t1~t2 , 时间段平均反应速率v(HCl)=________ mol·L-1·min-1。
17.X、Y、Z、W、R为元_?????¨???è?¨??????_十号元素,原子序数依次增大,其中有两种元素同主族。X原子的核外电子数是电子层数的三倍,X、Y 化合形成温室气体 M,X、Z原子最外层电子数之和等于Y的族序数,W 的单质常温下为黄绿色气体。回答下列问题:
(1)写出元素符号:X________,Y________,R________。
(2)W 的原子结构示意图为________。
(3)M 的电子式为________,属于________(填“共价”或“离子”)化合物。
(4)Z、W、R简单离子半径由大到小的顺序为________(填离子符号)。
(5)Z、R的最高价氧化物对应水化物碱性由强到弱的顺序为________(填化学式)。
(6)用电子式表示Y 的最简单氢化物的形成过程:________。
答案解析部分
一、单选题
1 D
解析:A.风力发电机,将风能转化为电能,A不符合题意;
B.天然气烧水,通过天然气的燃烧,将化学能转化为热能,B不符合题意;
C.硅太阳能电池,是将太阳能(光能)转化为电能,C不符合题意;
D.电解熔融氯化钠获得钠和氯气,是将电能转化为化学能,D符合题意;
故答案为:D。
分析:电能转换为化学能一般是原电池,化学能转化为电能一般是原电池
2 D
解析:A.H2S分子中H原子和S原子之间只存在共价键,故A不符合题意;
B.Na2S中钠离子和硫离子之间只存在离子键,故B不符合题意;
C.硫酸分子中S原子和H原子、O原子及O原子和H原子之间只存在共价键,为共价化合物,故C不符合题意;21教育网
D.(NH4)2SO4中铵根离子和硫酸根离子之间存在离子键,N原子和H原子、硫原子和O原子之间存在共价键,故D符合题意;21cnjy.com
故答案为D。
分析:关于化学_é?????????????????_有关判断还需要注意:(1)活泼金属和活泼非金属不一定形成离子键,例如AlCl3中Al—Cl键为共价键;另外非金属元素的两个原子之间一定形成共价键,但多个原子间也可形成离子键,如NH4Cl等。(2)离子化合物和共价化合物的判断方法:①根据化学键的类型判断:凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,一定是共价化合物。②根据化合物的类型来判断:大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸和大多数有机物都属于共价化合物。③根据化合物的性质来判断:通常熔点、沸点较低的化合物是共价化合物;溶于水后不能发生电离的化合物是共价化合物;熔化状态下能导电的化合物是离子化合物,不导电的化合物是共价化合物。21·cn·jy·com
3 D
解析:①S就既有氧化_??§?????????è?????_性
②比如氯化铵为离子化合物
③比如铁离子能被还原到亚铁离子
④高锰酸根中有金属元素锰
⑤氯化铝为共价化合物
故答案为:D
分析:一般来说非金属元素之间形成的是共价化合物,但铵盐除外,
金属元素与非金属元素形成的化合物一般是离子化合物,但氯化铝除外www.21-cn-jy.com
4 A
解析:_???????±????_较活泼的金属是负极,失去电子,发生氧化反应;电子经导线流向正极,溶液中的阳离子向正极移动,在正极得到电子,发生还原反应;Y电极质量增加,这说明Y电极是正极,溶液中的金属阳离子得到电子而析出,X是负极,因此符合条件的是选项A,
故答案为:A。
分析:该题是高考中的常见_é????????è????????_属于中等难度的试题。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力和逆向思维能力。
5 A
解析:A.石墨电极为正极,得电子,发生还原反应,A符合题意;
B.电池工作时,OH-移向负极,即 电极,B不符合题意;
C.电池总反应为: ,工作一段时间,OH-被消耗一部分,电解质溶液的pH减小,C不符合题意;
D.外电路中电子流动方向为负极经导线负载流向正极,所以是: 灯泡 (石墨),D不符合题意。
故答案为:A
分析:该装置为原电池装置, 失电子,做负极;石墨为正极,得电子,电解质溶液为强碱
6 B
解析:A.根据分析,乙为原电池正极,氧气得到电子生还原反应,故A不符合题意;
B.通入甲醇的一端为电池的负极,电极反应为:CH3OH-6e-+8OH-=CO +6H2O,故B符合题意;
C.放电过程中消耗氢氧根离子,溶液的pH降低,故C不符合题意;
D.电子不能通过溶液,故D不符合题意;
故答案为:B。
分析:通入甲醇的一端为电池的负极,通入空气的一端乙为燃料电池的正极,电解质溶液为碱性溶液,负极电极反应式为:CH3OH-6e-+8OH-=CO +6H2O,正极反应式为O2+4e-+2H2O=4OH- , 据此解答。
7 C
解析:A、没有盐桥,不能形成闭合回路,则不能形成原电池,选项A不符合题意;
B、电池工作时,盐桥中K+会向正极移动,即向铜电极一侧移动,选项B不符合题意;
C、电池工作时,盐桥中Cl-会向负极移动,即向Zn电极一侧移动,选项C符合题意;
D、电子只能在导线中移动,不能在溶液中移动,所以电子不能通过盐桥,选项D不符合题意。
故答案为:C。
分析:本题考查原电池原理,侧重于学生的分析能力的考查,明确原电池中正负极上发生的反应是解本题的关键。注意电子不经过电解质溶液。21·世纪*教育网
8 D
解析:A. 由图可知,反应ⅰ的反应物的总能量比生成物的总能量低,是吸热反应,A不符合题意; 【版权所有:21教育】
B. 由图可知,反应ⅰ的活化能比反应ⅱ的活化能大,活化能越大,反应速率越小,则反应ⅰ是整个反应的决速步骤,B不符合题意;
C. 由图以及反应方程式可知, 是 分解反应的催化剂,C不符合题意;
D. 0~20 内,生成22.4mL氧气,即生成氧气的物质的量为1.0×10-3mol,则参加反应的 的物质的量为2.0×10-3mol,则平均反应速率: ,D符合题意;
故答案为:D。
分析_?????????é????????_在加入催化剂之后,出现两个小峰,第一个峰是反应进行的过程,第二个峰是第二个反应进行的过程,活化能越高说明反应速率越慢,反应1速率慢,反应2速率快,根据能量的变化情况,反应1是吸热,反应2是放热,整个放反应也是放热反应,在反应的其实状态碘离子为发生改变,故碘离子是催化剂,可以根据数据计算出平均速率即可
9 C
解析:A.在可逆反应里_????????????è?????_体的浓度是一个常数,则加入更多的C(s),平衡不移动,A不符合题意;
B.已知反应为吸热反应,则升高温度,平衡正向移动,B不符合题意;
C.增大压强,平衡向气体计量数减小的方向移动,即平衡逆向移动,C符合题意;
D.加入催化剂,化学平衡不移动,则CO的浓度不变,D不符合题意;
故答案为:C。
分析:A.在可逆反应里,固体或者液体的浓度是一个常数,则加入更多的C(s),平衡不移动;
B.已知反应为吸热反应,则升高温度,平衡正向移动;
C.增大压强,平衡向气体计量数减小的方向移动,即平衡逆向移动;
D.加入催化剂,只改变化学反应速率,化学平衡不移动,则CO的浓度不变。
10 B
解析:A.v(H2O)=0.1mol·L-1·s-1
B.v(H2O)= v(H2)=2.25mol·L-1·s-1
C.v(H2O)=2v(CH2=CH2)=0.06mol·L-1·s-1???
D.v(H2O)=v(CO)=1.5mol·L-1·s-1
所以反应速率最快的是B,
故答案为:B;
分析:给出的是不同物质的反应速率,所以先转化为同一种物质的速率。转为为水的速率进行计算
11 A
解析:_??????H2_O,氢离子浓度减小,反应速率减慢,但氢离子的物质的量不变,所以不改变H2的产量,故符合题意;②加NaOH固体,消耗氢离子,氢离子浓度减小,反应速率减慢,氢离子的物质的量减小,生成氢气的物质的量减少,故不符合题意;③将盐酸用量减半,氢离子的物质的量减少,生成氢气的物质的量减少,浓度不变,反应速率不变,故不符合题意;④加CuO固体与盐酸反应生成氯化铜,铁与氯化铜反应生成铜、与原来的铁构成原电池,反应速率加快,Fe过量,导致生成的氢气减少,故不符合题意;⑤加NaCl溶液,氢离子的物质的量不变、但氢离子的浓度变小,反应速率减小,故符合题意;⑥加入硝酸钾溶液,溶液中硝酸根离子与盐酸电离出的氢离子构成强氧化性的硝酸,与铁反应生成氮的氧化物,而不生成氢气,所以生成氢气的物质的量减小,故不符合题意;⑦降低温度(不考虑盐酸挥发)反应速率减慢,氢离子的物质的量不变,则生成氢气的物质的量不变,故符合题意;
故①⑤⑦符合,
故答案为_???A???
_???_分析】减缓速率但不影响氢气的量,即不减少氢离子的量。
①加水稀释浓度降低②消耗氢离子③减少氢离子④减少氢离子⑤稀释⑥有氢离子和硝酸根与铁产生一氧化氮⑦降温速率减小
12 D
解析:由I、II对比_?????????T1???_度下先达到化学平衡,说明T1>T2 , 达到平衡时T1温度下C%高于T2 , 即升高温度平衡逆向移动,说明该反应正向为放热反应;对比II、III可知,P2下先达到平衡,说明P2>P1 , 达到平衡时P2下C%高于P1 , 说明增大压强平衡正向移动,因此1+1>x,因此x=1,综上所述,说法正确的是D项,
故答案为D。
分析:A、压强相_???????????????è??_高越先达到平衡;
B、温度相同时,压强越大越先达到平衡;
C、压强相同时,温度高平衡时C的百分含量小,说明升温平衡逆向移动,则正反应放热;
D、相同温度时,增大压强,平衡正向移动,正反应为气体体积减小的方向,据此解答。
二、综合题
13 (1)不变
(2)增大
(3)不变
(4)减小;减小
解析:(1)Fe为_??????????????¤???_加Fe的量,反应速率不变,故答案为:不变;(2)将容器的容积缩小一半,体系中各气态物质的浓度均增大,正反应速率和逆反应速率都增大,故答案为:增大;(3)保持容器的容积不变,充入N2使体系压强增大,体系中各物质的浓度不变,正反应速率和逆反应速率均不变,故答案为:不变;(4)保持压强不变,充入N2使容器的容积增大,体系中各气态物质的浓度均减小,正反应速率和逆反应速率均减小,故答案为:减小;减小。
分析:(1)Fe是固体,不影响反应速率;
(2)将容器容积缩小一半,相当于增大压强,正逆反应速率都增大;
(3)保持容器容积不变,充入氮气,水和氢气浓度都不变;
(4)保持压强不变,充入氮气使容器容积增大,则水和氢气浓度都减小。
14 (1)负极
(2)Zn-2e-=Zn2+;Cu2++2e-=Cu
(3)K+
(4)C
(5)石墨;KI溶液;石墨;FeCl3溶液;导线;盐桥;
【解析】【解_??????(1)__该装置是原电池,Zn易失去电子做负极,故答案为:负极;(2) Zn做负极,负极反应式为:Zn-2e-=Zn2+ , Cu做正极,正极反应式为Cu2++2e-=Cu,故答案为:Zn-2e-=Zn2+ , Cu2++2e-=Cu;(3)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4中迁移的离子应是阳离子,应是K+ , 故答案为K+;(4)A.若将Cu换成石墨,锌仍然为负极,石墨为正极,电极反应式为Zn+Cu2+=Zn2++Cu,电池反应不变,故A可行;
B.用NaCl溶液替换_ZnSO4???_液,NaCl是电解质溶液,还是Zn失去电子,电极反应式仍然为Zn+Cu2+=Zn2++Cu,电池反应不变,故B可行;
C.若将CuSO4溶液换成稀H2SO4 , 电池反应变成Zn+2H+=Zn2++H2↑,电池反应发生变化,故C不可行;
故答案为:C。(5)在2Fe3+ + 2I-= 2Fe2+ + I2中,反应式中碘元素由-1价升成0价,失去电子,发生氧化反应,负极反应物为KI溶液,铁元素由+3价降低为+2价,得到电子,发生还原反应,可以选正极反应物为FeCl3溶液,正负极用石墨作电极材料,连接导线,用盐桥形成闭合回路,组成原电池,故答案为:石墨,KI溶液;石墨,FeCl3溶液;导线,盐桥, 。
分析:(1)_?????????????±?è??_计的原理,锌活动性强于铜,锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应
(2)根据原电池设计的原理,锌活动性强于铜,锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应
(3)锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应,阴离子向负极移动,阳离子向正极移动
(4)考查的是原电池的设计,无非就是电解质溶液和电极材料,右边电极材料可以换为石墨或惰性电极,左边电解质溶液可以换成不与锌反应的即可
(5)根据原电池的设计规则:负极发生氧化反应,失去电子,而正极得电子发生还原反应,根据给出的总反应 2Fe3+?+ 2I-= 2Fe2+?+ I2?负极是碘离子放电,正极是铁离子放电,所以电极材料是惰性电极或者石墨电极,所以需要用到盐桥
15 _???1???Fe3_++e-=Fe2+;0.05
(2)铜(Cu);铁(Fe);铜(Cu)
(3)2H2O+O2+4e-=4OH-
解析:(1)若a电极材料为碳、b溶液为FeCl3溶液,则该原电池中自发进行的氧化还原反应为2Fe3++Cu=Cu2++2Fe2+ , 所以铜电极为负极,碳电极为正极,电极反应式为Fe3++e-=Fe2+;负极反应为Cu-2eˉ=Cu2+ , 1.6gCu的物质的量为 =0.025mol,所以转移电子0.05mol;(2)若a电极材料为铁、b溶液为浓硝酸,由于Fe在浓硝酸中发生钝化,所以总反应为铜和浓硝酸的反应,铜被氧化,所以铜电极为负极,铁电极为正极,原电池中电子从负极经导线流向正极,即从铜电极→铁电极;电解质溶质中阴离子流向负极,所以NO 向铜电极移动;(3)供电时总反应为:2H2+O2=2H2O,所以通入氧气的一极为正极,由于电解质溶液显碱性,所以氧气得电子被氧化和水结合生成氢氧根,电极方程式为2H2O+O2+4e-=4OH-。
分析:铁、_é?????é???±???????_下在浓硝酸、浓硫酸中会发生钝化;原电池中电子由负极经导线流向正极,电流与电子流向相反,电解质溶液中阳离子流向正极,阴离子流向负极。
16 (1)B;t1~t2斜率最大
(2)C,D
(3)
解析:(1)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知斜率最大的是t1~t2 , 故答案为:B;t1~t2斜率最大;(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,故答案为:CD;(3) t1~t2时间生成气体体积=(V2-V1)mL,则二氧化碳的物质的量= mol,根据HCl和二氧化碳的关系式知,消耗盐酸的物质的量=(2× )mol,盐酸的反应速率= = ,故答案为: 。
分析:(1)根据图象的倾斜程度进行分析,斜率越大其反应速率越大;
(2)减小溶液中氢离子浓度,即可降低反应速率;
(3)先利用图象求出 t1~t2时间生成气体体积,计算出生成二氧化碳的量,再利用HCl和二氧化碳的关系式结合速率计算公式解答。
17 (1)C;O;Ca
(2)
(3);共价
(4)Cl- >Ca2+ >Mg2+
(5)Ca(OH)2>Mg(OH)2
(6)
解析:由题意得,X为C,Y为O,M为CO2,Z为Mg,W为Cl,R为Ca
(1)X为C,Y为O,R为Ca
(2)Cl的原子结构示意图如下
(3)M为CO2,电子式为? ,非金属与非金属形成的化合物,为共价化合物
(4)电子层数越大,离子半径越大,当电子层数相同的情况下,原子序数越大, 离子半径越小,故有 Cl-?>Ca2+?>Mg2+
(5) 最高价氧化物对应水化物碱性 取决于元素的非金属性, 而同一主族越往下,金属性越强,故 Ca(OH)2>Mg(OH)2
(6)Y的最简单氢化物是水,形成过程如下,
分析:本题最难的点在于_????????¨??????__X原子的核外电子数是电子层数的三倍 ,可知X为C, X、Y 化合形成温室气体 ,故Y是O, X、Z原子最外层电子数之和等于Y的族序数 则Z是Mg, W 的单质常温下为黄绿色气体 ,则W是Cl,又 其中有两种元素同主族 ,且都为短周期元素,故R为Ca,推断出元素之后,再结合元素周期律可解题。
_21?????????è?????(www.21cnjy.com)_
高中化学鲁科版(2019)必修第二册 第2章测试卷
一、单选题(共12题;共24分)
1.下列过程中,将电能转化为化学能的是(?? )
A.?风力发电机 ?B.?天然气烧水
C.?硅太阳能电池 ??D.?电解熔融氯化钠
2.下列物质既含有离子键,又含有共价键的是(?? )
A.?H2S???????????????????????????????B.?Na2S???????????????????????????????C.?H2SO4???????????????????????????????D.?(NH4)2SO4
3.下列关于非金属元素和金属元素特征的叙述不正确的是( ??)
①非金属元素可能有还_?????§?????????è??_有氧化性;②非金属元素只能形成共价化合物;③金属阳离子被还原不一定得到金属单质;④金属元素不可能存在于阴离子中;21世纪教育网版权所有
⑤金属元素与非金属元素形成的化合物一定是离子化合物
A.?①③??????????????????????????????????B.?②③??????????????????????????????????C.?③④⑤??????????????????????????????????D.?②④⑤
4.某原电池,_?°???¤é???±?X???_Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则下列情况中有可能的是( ??) www-2-1-cnjy-com
A.?X是负极,电解质溶液为CuSO4溶液 B.?X是负极,电解质溶液为H2SO4溶液
C.?X是正极,电解质溶液为CuSO4溶液 D.?X是正极,电解质溶液为H2SO4溶液
5.某碱性电池的总反应为 ,工作原理如图所示,下列说法错误的是(??? )
A.?石墨电极为正极,发生氧化反应
B.?电池工作时, 移向 电极
C.?电池工作一段时间后,电解质溶液的pH减小
???D.?外电路中电子流动方向: 灯泡 (石墨)
6.甲醇-空气燃料电池(DMFC)是一种高效能轻污染的车载电池其工作原理如图。下列有关叙述正确的是(??? )
A.?乙电极为正极,发生氧化反应???????????
B.?甲电极的反应为:CH3OH-6e-+8OH-=CO +6H2O
C.?放电过程中溶液的pH升高????????????????
D.?电子移动方向为:甲电极→电流计→乙电极→溶液→甲电极
7.关于下图中原电池的盐桥(由饱和KCl溶液和琼脂制成)说法正确的是(?? )
A.?有无盐桥不影_???è?????????±????_工作
B.?电池工作时,盐桥中K+会向Zn电极一侧移动
C.?电池工作时,盐桥中Cl-会向Zn电极一侧移动
D.?电池工作时,盐桥中的电子由Cu电极向Zn电极移动【出处:21教育名师】
8.向20 0.20 溶液中加入少量 溶液,发生以下反应:i. ;ⅱ. 。 分解反应过程中能量变化和不同时刻测得生成 的体积(已折算成标准状况)如下: 21教育名师原创作品
0 5 10 20 …
0.0 8.96 15.68 22.40 …
下列判断正确的是(??? )
A.?反应ⅰ是放热反应
B.?反应ⅱ是整个反应的决速步骤
C.?是 分解反应的催化剂
D.?0~20 的平均反应速率:
9.一定温度下的密闭容器中发生C(s)+H2O(g) CO(g)+H2(g)-Q(Q>0),达到化学平衡后(??? )
A.?加入更多的C,平衡正向移动?????????????????????????B.?升高温度,平衡逆向移动
C.?增大压强,平衡逆向移动????????????????????????????????D.?加入催化剂,CO的浓度增大2-1-c-n-j-y
10.已知反应2CO(g)+4H2(g) CH2=CH2(g)+2H2O(g)在不同条件下的化学反应速率如下,其中表示反应速率最快的是(??? )
A.?v(H2O)=0.1mol·L-1·s-1??????????????????????????????????????B.?v(H2)=4.5mol·L-1·s-1
C.?v(CH2=CH2)=0.03mol·L-1·s-1????????????????????????????D.?v(CO)=1.5mol·L-1·s-1
11.过量的铁粉与100mL0.01mol·L﹣1的稀盐酸反应。为了减慢反应速率而不改变H2的产量,可以使用如下方法中的(??? )
①加H2O?_??_____??_??????N_aOH固体?? ? ③将盐酸用量减半,浓度不变???
④加CuO固体??? ⑤加NaCl溶液??? ⑥加入硝酸钾溶液??? ⑦降低温度(不考虑盐酸挥发)
A.?①⑤⑦????????????????????????????????B.?①⑤⑥⑦????????????????????????????????C.?③⑦????????????????????????????????D.?②④⑥
12.在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,下列说法正确的是( ??)
A.?温度:T2>T1?????????????B.?压强:P1>P2?????????????C.?该正反应是吸热反应?????????????D.?x的取值是:x=1
二、综合题(共5题;共39分)
13.在一个密闭容器中发生反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。回答下列问题:
(1)增加Fe的量,反应速率________(填“增大”“不变”或“减小”,下同)。
(2)将容器容积缩小一半,反应速率________。
(3)保持容器容积不变,充入N2使体系压强增大,反应速率________。
(4)保持压强不变,充入N2使容器容积增大,正反应速率________,逆反应速率________。
14.如图为铜锌原电池的装置示意图,其中盐桥内装琼脂-饱和KCl溶液。请回答下列问题:
(1)Zn电极为电池的________(填“正极”或“负极”)。
(2)写出电极反应式:Zn电极:________ Cu电极:________。
(3)盐桥中向CuSO4溶液中迁移的离子是________。
(4)若保持原电池的总反应不变,下列替换不可行的是____________(填字母)。
A.用石墨替换Cu电极
B.用NaCl溶液替换ZnSO4溶液
C.用稀H2SO4代替CuSO4溶液
(5)请选择适当的材料和试剂,将反应2Fe3+ + 2I-= 2Fe2+ + I2设计成一个原电池,请填写表格:
设计思路
负极 负极材料? ________
负极反应物 ________
正极 正极材料? ________
正极反应物 ________
电子导体 ________
离子导体 ________
在方框内画出简单的装置示意图,并标明使用的材料和试剂________。
15.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。
(1)若 a电极材料为_??????b?????????_ FeCl3溶液,则正极的电极反应式为________,当有1.6g负极材料溶解时,转移的电子为________mol; 2·1·c·n·j·y
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为________→ ________(填电极材料,下同),溶液中的NO 向________极移动; 【来源:21·世纪·教育·网】
(3)氢氧燃_???????±??·???¨???_航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________。 【来源:21cnj*y.co*m】
16.为了研究碳酸钙与盐_é?????????????????_速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。 21*cnjy*com
(1)化学反应速率最快的时间段是________,原因是________
A.0~t1 ???????B.t1~t2 C.t2~t3 ??????????D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的是________;
A.通入HCl
B.NaCl固体
C.NaCl溶液
D.蒸馏水
(3)若盐酸_?????????????§????_20 mL,图中CO2的体积是标准状况下的体积,则t1~t2 , 时间段平均反应速率v(HCl)=________ mol·L-1·min-1。
17.X、Y、Z、W、R为元_?????¨???è?¨??????_十号元素,原子序数依次增大,其中有两种元素同主族。X原子的核外电子数是电子层数的三倍,X、Y 化合形成温室气体 M,X、Z原子最外层电子数之和等于Y的族序数,W 的单质常温下为黄绿色气体。回答下列问题:
(1)写出元素符号:X________,Y________,R________。
(2)W 的原子结构示意图为________。
(3)M 的电子式为________,属于________(填“共价”或“离子”)化合物。
(4)Z、W、R简单离子半径由大到小的顺序为________(填离子符号)。
(5)Z、R的最高价氧化物对应水化物碱性由强到弱的顺序为________(填化学式)。
(6)用电子式表示Y 的最简单氢化物的形成过程:________。
答案解析部分
一、单选题
1 D
解析:A.风力发电机,将风能转化为电能,A不符合题意;
B.天然气烧水,通过天然气的燃烧,将化学能转化为热能,B不符合题意;
C.硅太阳能电池,是将太阳能(光能)转化为电能,C不符合题意;
D.电解熔融氯化钠获得钠和氯气,是将电能转化为化学能,D符合题意;
故答案为:D。
分析:电能转换为化学能一般是原电池,化学能转化为电能一般是原电池
2 D
解析:A.H2S分子中H原子和S原子之间只存在共价键,故A不符合题意;
B.Na2S中钠离子和硫离子之间只存在离子键,故B不符合题意;
C.硫酸分子中S原子和H原子、O原子及O原子和H原子之间只存在共价键,为共价化合物,故C不符合题意;21教育网
D.(NH4)2SO4中铵根离子和硫酸根离子之间存在离子键,N原子和H原子、硫原子和O原子之间存在共价键,故D符合题意;21cnjy.com
故答案为D。
分析:关于化学_é?????????????????_有关判断还需要注意:(1)活泼金属和活泼非金属不一定形成离子键,例如AlCl3中Al—Cl键为共价键;另外非金属元素的两个原子之间一定形成共价键,但多个原子间也可形成离子键,如NH4Cl等。(2)离子化合物和共价化合物的判断方法:①根据化学键的类型判断:凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,一定是共价化合物。②根据化合物的类型来判断:大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸和大多数有机物都属于共价化合物。③根据化合物的性质来判断:通常熔点、沸点较低的化合物是共价化合物;溶于水后不能发生电离的化合物是共价化合物;熔化状态下能导电的化合物是离子化合物,不导电的化合物是共价化合物。21·cn·jy·com
3 D
解析:①S就既有氧化_??§?????????è?????_性
②比如氯化铵为离子化合物
③比如铁离子能被还原到亚铁离子
④高锰酸根中有金属元素锰
⑤氯化铝为共价化合物
故答案为:D
分析:一般来说非金属元素之间形成的是共价化合物,但铵盐除外,
金属元素与非金属元素形成的化合物一般是离子化合物,但氯化铝除外www.21-cn-jy.com
4 A
解析:_???????±????_较活泼的金属是负极,失去电子,发生氧化反应;电子经导线流向正极,溶液中的阳离子向正极移动,在正极得到电子,发生还原反应;Y电极质量增加,这说明Y电极是正极,溶液中的金属阳离子得到电子而析出,X是负极,因此符合条件的是选项A,
故答案为:A。
分析:该题是高考中的常见_é????????è????????_属于中等难度的试题。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力和逆向思维能力。
5 A
解析:A.石墨电极为正极,得电子,发生还原反应,A符合题意;
B.电池工作时,OH-移向负极,即 电极,B不符合题意;
C.电池总反应为: ,工作一段时间,OH-被消耗一部分,电解质溶液的pH减小,C不符合题意;
D.外电路中电子流动方向为负极经导线负载流向正极,所以是: 灯泡 (石墨),D不符合题意。
故答案为:A
分析:该装置为原电池装置, 失电子,做负极;石墨为正极,得电子,电解质溶液为强碱
6 B
解析:A.根据分析,乙为原电池正极,氧气得到电子生还原反应,故A不符合题意;
B.通入甲醇的一端为电池的负极,电极反应为:CH3OH-6e-+8OH-=CO +6H2O,故B符合题意;
C.放电过程中消耗氢氧根离子,溶液的pH降低,故C不符合题意;
D.电子不能通过溶液,故D不符合题意;
故答案为:B。
分析:通入甲醇的一端为电池的负极,通入空气的一端乙为燃料电池的正极,电解质溶液为碱性溶液,负极电极反应式为:CH3OH-6e-+8OH-=CO +6H2O,正极反应式为O2+4e-+2H2O=4OH- , 据此解答。
7 C
解析:A、没有盐桥,不能形成闭合回路,则不能形成原电池,选项A不符合题意;
B、电池工作时,盐桥中K+会向正极移动,即向铜电极一侧移动,选项B不符合题意;
C、电池工作时,盐桥中Cl-会向负极移动,即向Zn电极一侧移动,选项C符合题意;
D、电子只能在导线中移动,不能在溶液中移动,所以电子不能通过盐桥,选项D不符合题意。
故答案为:C。
分析:本题考查原电池原理,侧重于学生的分析能力的考查,明确原电池中正负极上发生的反应是解本题的关键。注意电子不经过电解质溶液。21·世纪*教育网
8 D
解析:A. 由图可知,反应ⅰ的反应物的总能量比生成物的总能量低,是吸热反应,A不符合题意; 【版权所有:21教育】
B. 由图可知,反应ⅰ的活化能比反应ⅱ的活化能大,活化能越大,反应速率越小,则反应ⅰ是整个反应的决速步骤,B不符合题意;
C. 由图以及反应方程式可知, 是 分解反应的催化剂,C不符合题意;
D. 0~20 内,生成22.4mL氧气,即生成氧气的物质的量为1.0×10-3mol,则参加反应的 的物质的量为2.0×10-3mol,则平均反应速率: ,D符合题意;
故答案为:D。
分析_?????????é????????_在加入催化剂之后,出现两个小峰,第一个峰是反应进行的过程,第二个峰是第二个反应进行的过程,活化能越高说明反应速率越慢,反应1速率慢,反应2速率快,根据能量的变化情况,反应1是吸热,反应2是放热,整个放反应也是放热反应,在反应的其实状态碘离子为发生改变,故碘离子是催化剂,可以根据数据计算出平均速率即可
9 C
解析:A.在可逆反应里_????????????è?????_体的浓度是一个常数,则加入更多的C(s),平衡不移动,A不符合题意;
B.已知反应为吸热反应,则升高温度,平衡正向移动,B不符合题意;
C.增大压强,平衡向气体计量数减小的方向移动,即平衡逆向移动,C符合题意;
D.加入催化剂,化学平衡不移动,则CO的浓度不变,D不符合题意;
故答案为:C。
分析:A.在可逆反应里,固体或者液体的浓度是一个常数,则加入更多的C(s),平衡不移动;
B.已知反应为吸热反应,则升高温度,平衡正向移动;
C.增大压强,平衡向气体计量数减小的方向移动,即平衡逆向移动;
D.加入催化剂,只改变化学反应速率,化学平衡不移动,则CO的浓度不变。
10 B
解析:A.v(H2O)=0.1mol·L-1·s-1
B.v(H2O)= v(H2)=2.25mol·L-1·s-1
C.v(H2O)=2v(CH2=CH2)=0.06mol·L-1·s-1???
D.v(H2O)=v(CO)=1.5mol·L-1·s-1
所以反应速率最快的是B,
故答案为:B;
分析:给出的是不同物质的反应速率,所以先转化为同一种物质的速率。转为为水的速率进行计算
11 A
解析:_??????H2_O,氢离子浓度减小,反应速率减慢,但氢离子的物质的量不变,所以不改变H2的产量,故符合题意;②加NaOH固体,消耗氢离子,氢离子浓度减小,反应速率减慢,氢离子的物质的量减小,生成氢气的物质的量减少,故不符合题意;③将盐酸用量减半,氢离子的物质的量减少,生成氢气的物质的量减少,浓度不变,反应速率不变,故不符合题意;④加CuO固体与盐酸反应生成氯化铜,铁与氯化铜反应生成铜、与原来的铁构成原电池,反应速率加快,Fe过量,导致生成的氢气减少,故不符合题意;⑤加NaCl溶液,氢离子的物质的量不变、但氢离子的浓度变小,反应速率减小,故符合题意;⑥加入硝酸钾溶液,溶液中硝酸根离子与盐酸电离出的氢离子构成强氧化性的硝酸,与铁反应生成氮的氧化物,而不生成氢气,所以生成氢气的物质的量减小,故不符合题意;⑦降低温度(不考虑盐酸挥发)反应速率减慢,氢离子的物质的量不变,则生成氢气的物质的量不变,故符合题意;
故①⑤⑦符合,
故答案为_???A???
_???_分析】减缓速率但不影响氢气的量,即不减少氢离子的量。
①加水稀释浓度降低②消耗氢离子③减少氢离子④减少氢离子⑤稀释⑥有氢离子和硝酸根与铁产生一氧化氮⑦降温速率减小
12 D
解析:由I、II对比_?????????T1???_度下先达到化学平衡,说明T1>T2 , 达到平衡时T1温度下C%高于T2 , 即升高温度平衡逆向移动,说明该反应正向为放热反应;对比II、III可知,P2下先达到平衡,说明P2>P1 , 达到平衡时P2下C%高于P1 , 说明增大压强平衡正向移动,因此1+1>x,因此x=1,综上所述,说法正确的是D项,
故答案为D。
分析:A、压强相_???????????????è??_高越先达到平衡;
B、温度相同时,压强越大越先达到平衡;
C、压强相同时,温度高平衡时C的百分含量小,说明升温平衡逆向移动,则正反应放热;
D、相同温度时,增大压强,平衡正向移动,正反应为气体体积减小的方向,据此解答。
二、综合题
13 (1)不变
(2)增大
(3)不变
(4)减小;减小
解析:(1)Fe为_??????????????¤???_加Fe的量,反应速率不变,故答案为:不变;(2)将容器的容积缩小一半,体系中各气态物质的浓度均增大,正反应速率和逆反应速率都增大,故答案为:增大;(3)保持容器的容积不变,充入N2使体系压强增大,体系中各物质的浓度不变,正反应速率和逆反应速率均不变,故答案为:不变;(4)保持压强不变,充入N2使容器的容积增大,体系中各气态物质的浓度均减小,正反应速率和逆反应速率均减小,故答案为:减小;减小。
分析:(1)Fe是固体,不影响反应速率;
(2)将容器容积缩小一半,相当于增大压强,正逆反应速率都增大;
(3)保持容器容积不变,充入氮气,水和氢气浓度都不变;
(4)保持压强不变,充入氮气使容器容积增大,则水和氢气浓度都减小。
14 (1)负极
(2)Zn-2e-=Zn2+;Cu2++2e-=Cu
(3)K+
(4)C
(5)石墨;KI溶液;石墨;FeCl3溶液;导线;盐桥;
【解析】【解_??????(1)__该装置是原电池,Zn易失去电子做负极,故答案为:负极;(2) Zn做负极,负极反应式为:Zn-2e-=Zn2+ , Cu做正极,正极反应式为Cu2++2e-=Cu,故答案为:Zn-2e-=Zn2+ , Cu2++2e-=Cu;(3)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4中迁移的离子应是阳离子,应是K+ , 故答案为K+;(4)A.若将Cu换成石墨,锌仍然为负极,石墨为正极,电极反应式为Zn+Cu2+=Zn2++Cu,电池反应不变,故A可行;
B.用NaCl溶液替换_ZnSO4???_液,NaCl是电解质溶液,还是Zn失去电子,电极反应式仍然为Zn+Cu2+=Zn2++Cu,电池反应不变,故B可行;
C.若将CuSO4溶液换成稀H2SO4 , 电池反应变成Zn+2H+=Zn2++H2↑,电池反应发生变化,故C不可行;
故答案为:C。(5)在2Fe3+ + 2I-= 2Fe2+ + I2中,反应式中碘元素由-1价升成0价,失去电子,发生氧化反应,负极反应物为KI溶液,铁元素由+3价降低为+2价,得到电子,发生还原反应,可以选正极反应物为FeCl3溶液,正负极用石墨作电极材料,连接导线,用盐桥形成闭合回路,组成原电池,故答案为:石墨,KI溶液;石墨,FeCl3溶液;导线,盐桥, 。
分析:(1)_?????????????±?è??_计的原理,锌活动性强于铜,锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应
(2)根据原电池设计的原理,锌活动性强于铜,锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应
(3)锌做负极,失去电子发生氧化反应,而铜做正极,铜离子得到电子发生还原反应,阴离子向负极移动,阳离子向正极移动
(4)考查的是原电池的设计,无非就是电解质溶液和电极材料,右边电极材料可以换为石墨或惰性电极,左边电解质溶液可以换成不与锌反应的即可
(5)根据原电池的设计规则:负极发生氧化反应,失去电子,而正极得电子发生还原反应,根据给出的总反应 2Fe3+?+ 2I-= 2Fe2+?+ I2?负极是碘离子放电,正极是铁离子放电,所以电极材料是惰性电极或者石墨电极,所以需要用到盐桥
15 _???1???Fe3_++e-=Fe2+;0.05
(2)铜(Cu);铁(Fe);铜(Cu)
(3)2H2O+O2+4e-=4OH-
解析:(1)若a电极材料为碳、b溶液为FeCl3溶液,则该原电池中自发进行的氧化还原反应为2Fe3++Cu=Cu2++2Fe2+ , 所以铜电极为负极,碳电极为正极,电极反应式为Fe3++e-=Fe2+;负极反应为Cu-2eˉ=Cu2+ , 1.6gCu的物质的量为 =0.025mol,所以转移电子0.05mol;(2)若a电极材料为铁、b溶液为浓硝酸,由于Fe在浓硝酸中发生钝化,所以总反应为铜和浓硝酸的反应,铜被氧化,所以铜电极为负极,铁电极为正极,原电池中电子从负极经导线流向正极,即从铜电极→铁电极;电解质溶质中阴离子流向负极,所以NO 向铜电极移动;(3)供电时总反应为:2H2+O2=2H2O,所以通入氧气的一极为正极,由于电解质溶液显碱性,所以氧气得电子被氧化和水结合生成氢氧根,电极方程式为2H2O+O2+4e-=4OH-。
分析:铁、_é?????é???±???????_下在浓硝酸、浓硫酸中会发生钝化;原电池中电子由负极经导线流向正极,电流与电子流向相反,电解质溶液中阳离子流向正极,阴离子流向负极。
16 (1)B;t1~t2斜率最大
(2)C,D
(3)
解析:(1)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知斜率最大的是t1~t2 , 故答案为:B;t1~t2斜率最大;(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,故答案为:CD;(3) t1~t2时间生成气体体积=(V2-V1)mL,则二氧化碳的物质的量= mol,根据HCl和二氧化碳的关系式知,消耗盐酸的物质的量=(2× )mol,盐酸的反应速率= = ,故答案为: 。
分析:(1)根据图象的倾斜程度进行分析,斜率越大其反应速率越大;
(2)减小溶液中氢离子浓度,即可降低反应速率;
(3)先利用图象求出 t1~t2时间生成气体体积,计算出生成二氧化碳的量,再利用HCl和二氧化碳的关系式结合速率计算公式解答。
17 (1)C;O;Ca
(2)
(3);共价
(4)Cl- >Ca2+ >Mg2+
(5)Ca(OH)2>Mg(OH)2
(6)
解析:由题意得,X为C,Y为O,M为CO2,Z为Mg,W为Cl,R为Ca
(1)X为C,Y为O,R为Ca
(2)Cl的原子结构示意图如下
(3)M为CO2,电子式为? ,非金属与非金属形成的化合物,为共价化合物
(4)电子层数越大,离子半径越大,当电子层数相同的情况下,原子序数越大, 离子半径越小,故有 Cl-?>Ca2+?>Mg2+
(5) 最高价氧化物对应水化物碱性 取决于元素的非金属性, 而同一主族越往下,金属性越强,故 Ca(OH)2>Mg(OH)2
(6)Y的最简单氢化物是水,形成过程如下,
分析:本题最难的点在于_????????¨??????__X原子的核外电子数是电子层数的三倍 ,可知X为C, X、Y 化合形成温室气体 ,故Y是O, X、Z原子最外层电子数之和等于Y的族序数 则Z是Mg, W 的单质常温下为黄绿色气体 ,则W是Cl,又 其中有两种元素同主族 ,且都为短周期元素,故R为Ca,推断出元素之后,再结合元素周期律可解题。
_21?????????è?????(www.21cnjy.com)_
