八下第二章空气与生命第1-3节检测题(无答案)
文档属性
| 名称 | 八下第二章空气与生命第1-3节检测题(无答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 222.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2012-03-23 00:00:00 | ||
图片预览

文档简介
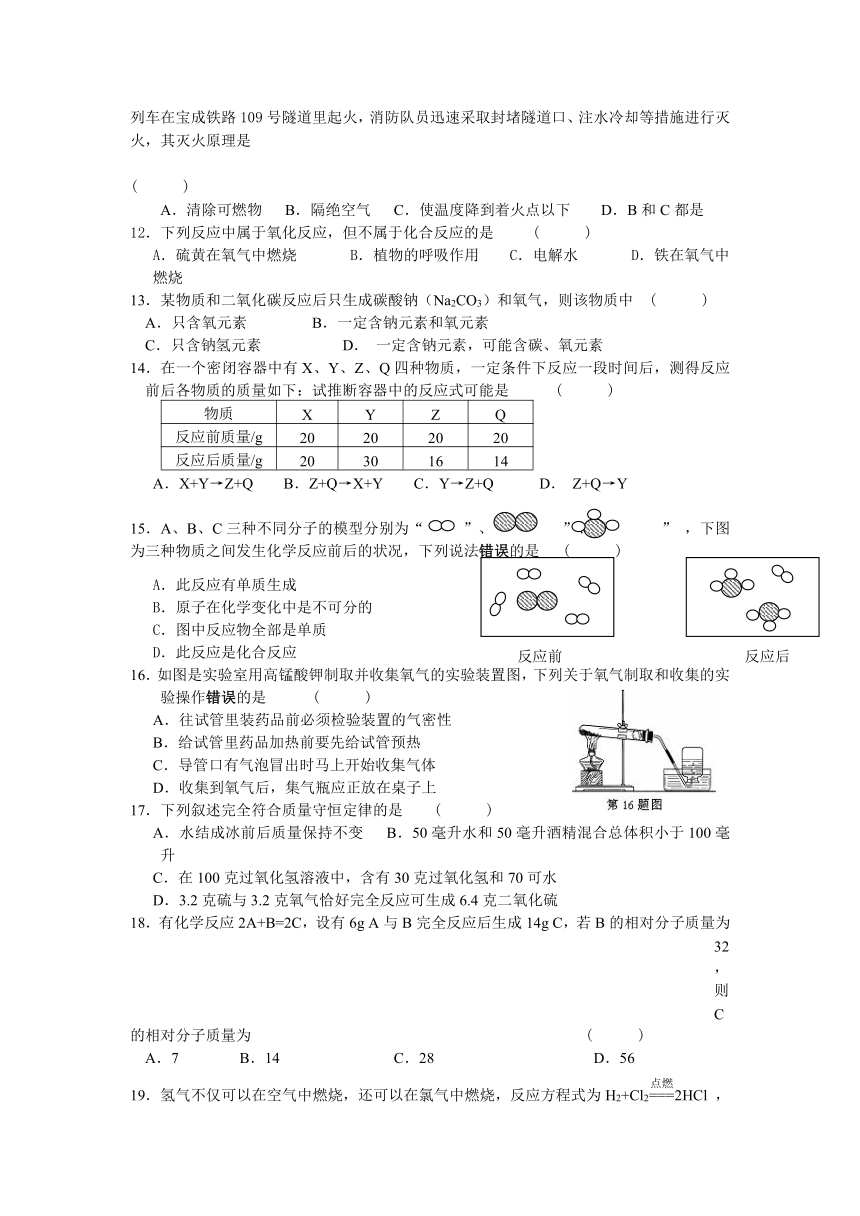
第二章1—3节测试卷
本卷所用的相对原子质量:H 1;O 16;Cl 35.5;N 14;C 12; K 39
一、选择题:(每题2分,共40分)
1.夏天从冰箱里拿出的饮料瓶放在空气中外壁变湿,说明空气中含有 ( )
A.氮气 B.氧气 C.水蒸气 D.二氧化碳
2.下列有关氧气的“自述,,错误的是 ( )
A.我不易溶于水 B.我具有可燃性 C.我能供给呼吸 D.我的化学性质比较活泼
3.薯片等易碎食品宜采用充气袋包装,下列气体中最不适宜充入的是 ( )
A.N2 B.O2 C.CO2 D.空气
4.下列实验操作正确的是 ( )
5.2008年北京奥运会上,会放飞数以万计的彩色气球。用你所学的有关物质化学性质知识和下表提供的数据,气球最好充灌的气体是(空气密度:1.29g/L) ( )
选项 A B C D
气体名称 氢气 氦气 氮气 氧气
密度(g/L) 0.089 0.17 1.25 1.43
6.下列实验现象描述正确的是 ( )
A.磷在氧气中燃烧,有大量白雾产生
B.木炭在氧气中燃烧,发出白光,产生大量的白烟
C.铁丝在氧气中燃烧,火焰呈蓝色并有黑色固体生成
D.硫在氧气中燃烧,发出明亮的蓝紫色火焰,并生成刺激性气味的气体
7.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该 ( )
A.继续用大针筒向澄清石灰水压入空气
B.撤去大针筒,用嘴向澄清石灰水吹气
C.得出空气中没有二氧化碳的结论
D.得出空气中含有少量二氧化碳的结论
8. 目前,瑞安市空气质量日报的监测项目中包括下列物质,其中不属于氧化物的是 ( )
A.二氧化硫(SO2) B.一氧化碳(CO) C.二氧化氮(NO2) D.臭氧(O3)
9.燃烧、缓慢氧化、自燃的共同点时 ( )
A. 需要点燃 B.反应很剧烈 C.都是化合反应 D.都是氧化反应
10.当你受到不良环境的威胁时,必须保护好自己的身体。如被困在火灾现场时,可采取的措施是
①打119火警电话求救 ②烟很大时,用湿毛巾捂住口鼻 ( )
③有烟雾的地方要蹲下或匍匐前进 ④立即打开所有门窗
A.①④ B.②④ C.①②③ D.①②④
11.2008年5月12日,四川汶川发生里氏8.0级地震。地震造成一列含有12节油罐车的列车在宝成铁路109号隧道里起火,消防队员迅速采取封堵隧道口、注水冷却等措施进行灭火,其灭火原理是
( )
A.清除可燃物 B.隔绝空气 C.使温度降到着火点以下 D.B和C都是
12.下列反应中属于氧化反应,但不属于化合反应的是 ( )
A.硫黄在氧气中燃烧 B.植物的呼吸作用 C.电解水 D.铁在氧气中燃烧
13.某物质和二氧化碳反应后只生成碳酸钠(Na2CO3)和氧气,则该物质中 ( )
A.只含氧元素 B.一定含钠元素和氧元素
C.只含钠氢元素 D. 一定含钠元素,可能含碳、氧元素
14.在一个密闭容器中有X、Y、Z、Q四种物质,一定条件下反应一段时间后,测得反应前后各物质的质量如下:试推断容器中的反应式可能是 ( )
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
A.X+Y→Z+Q B.Z+Q→X+Y C.Y→Z+Q D. Z+Q→Y
15.A、B、C三种不同分子的模型分别为“ ”、“ ”、“ ” ,下图为三种物质之间发生化学反应前后的状况,下列说法错误的是 ( )
A.此反应有单质生成
B.原子在化学变化中是不可分的
C.图中反应物全部是单质
D.此反应是化合反应
16.如图是实验室用高锰酸钾制取并收集氧气的实验装置图,下列关于氧气制取和收集的实验操作错误的是 ( )
A.往试管里装药品前必须检验装置的气密性
B.给试管里药品加热前要先给试管预热
C.导管口有气泡冒出时马上开始收集气体
D.收集到氧气后,集气瓶应正放在桌子上
17.下列叙述完全符合质量守恒定律的是 ( )
A.水结成冰前后质量保持不变 B.50毫升水和50毫升酒精混合总体积小于100毫升
C.在100克过氧化氢溶液中,含有30克过氧化氢和70可水
D.3.2克硫与3.2克氧气恰好完全反应可生成6.4克二氧化硫
18.有化学反应2A+B=2C,设有6g A与B完全反应后生成14g C,若B的相对分子质量为32,则C
的相对分子质量为 ( )
A.7 B.14 C.28 D.56
19.氢气不仅可以在空气中燃烧,还可以在氯气中燃烧,反应方程式为H2+Cl22HCl ,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为( )
20.在一定条件下,在一个完全封闭的容器内发生某反应生,测得反应过程中各物质的质量如下表所示,下列说法错误的是 ( )
物质 a b c d
反应前质量/g 10 10 10 2
反应后质量/g 待测 2 21 2
A.a、b两种物质中元素种类一定与c物质中元素种类相同 B.b物质可能是单质
C.该反应属于化合反应,d可能是催化剂 D.反应后a物质质量为3克
二、简答题:(每空格2分,共32分)
21. 下列有A、B、C、D四种物质,A是没有颜色气味的气体,B在A中燃烧产生明亮的蓝紫色火焰,且生成刺激性气味的气体C,将燃着的火条伸入到D的集气瓶中,火焰立即熄灭,且能使澄清的石灰水变浑浊。由此推断:(写化学式)B D
22.煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔。请分析这种变化的优点是: _________________ ;
煤在燃烧时会产生许多污染物,将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式 。
23.实验室经常用分解高锰酸钾的方法制取氧气,也可以用 的方法制取氧气,工业上生产中需要大量氧气,常采用 的方法制取氧气。
24.在实验室做实验时,发生了下列情况,简要写出由于实验操作而引起下列后果的原因。
(1)铁丝在盛有氧气的集气瓶中燃烧,瓶底炸裂 __________ ;
(2)实验室制氧气并用排水法收集时,水槽中的水沿导管进入热的试管中,使试管炸裂 ;
25.如图是常用的气体发生装置和收集装置。
(1)装置A可用于加热分解高锰酸钾制取氧气,制取时需要在试管口放一团棉花,它的作用是 ___________________________ ;
(2)检验收集的气体是O2的方法是 ___________________ ;
(3)甲烷是一种最简单的有机物,实验室常用AC或AD装置加热分解无水醋酸钠和碱石灰的混合
物来制取甲烷气体。由此可推得甲烷气体具有 _________ 的物理性质。
26.如图是白磷燃烧前后质量的测定的实验时。
(1)把铁丝放在酒精灯外焰上加热,当铁丝发红时,接触引燃白磷,并立即塞紧瓶塞。此过程中最关键的燃烧条件是 ___ ;白磷燃烧后生成物的化学式是 ;
(2)由质量守恒定律可知,化学反应前后一定不变的是 ______ (填序号)
①原子数目 ②原子种类 ③分子数目 ④分子种类 ⑤元素种类 ⑥物质种类
(3)我国使用“长征3号甲”运载火箭将“嫦娥Ⅱ号”送上月球轨道,该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2 NH4ClO4N2↑+Cl2↑+4X+2O2↑,则X的化学式为 _______ ,判断该反应的基本反应类型是 ______ 。
三、科学探究题:(每空格2分,共16分)
27.科学课上做“用红磷燃烧测定空气中氧气的体积分数”的实验时,由于红磷燃烧生成的P2O5对人体有一定危害,小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装置如右图所示。实验时用夹子B夹住橡胶管,打开夹子A,点燃纯净的氢气并迅速插入甲瓶中,使氢气在甲瓶中燃烧。(1)当氢气燃烧的火焰刚好熄灭时,对夹子的操作应是 __ 。
(2)实验测得甲瓶中氧气的体积远小于瓶中空气体积的l/5,写出一种 可能的原因: _____________________________ 。
(3)有同学提出,若用CO取代H2,进行如上操作也能完成氧气体积分数的测定。你是否认同?需要说明理由。 _________________________________________________ 。
28.某学校科学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,向5只集气瓶中分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;
③将带火星的木条依次插入1~5号瓶中,把观察到现象和计算数据,填入下表。
集气瓶标号 1 2 3 4 5
集气瓶中氧气的体积分数 28.9% 36.8% 44.7% 52.6% 60.5%
带火星木条的状况 微亮 亮 很亮 复燃 复燃
试回答下列问题:
(1)实验室中采用分解过氧化氢(H2O2)的方法制取氧气,其反应的化学方程式是 ________ 。
(2)根据以上实验事实,下列说法中正确的是 _____ (填写相应的字母)。
A、只有在纯氧中才能使带火星的木条复燃
B、集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃
C、只要有氧气存在就可使带火星的木条复燃。
(3)上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。请你再举一例,简明写出实验内容和实验现象。 ________________________________________ 。
29.某同学对催化剂产生了兴趣,通过查资料了解到氧化铜、氧化铁等都能加速氯酸钾的分解。为了证明氧化铜能加快氯酸钾的分解,他们设计了如下图装置,并进行气体的制备和测量实验。实验时均以生成40mL气体为标准,相关记录见下表:
实验序号 KClO3质量 加入其它的物质 待测数据
1 1.2 g 无其它物质
2 1.2 g 加入少量的CuO
试回答下列问题:
(1)上述实验中的“待测数据”指 ___________ ;
(2)为探究CuO在实验2中是否起催化作用,还需探究的内容是 __________________ 。
四、分析计算题:(30题6分、31题6分,共12分)
30.某同学在研究质量守恒定律的实验过程中,记录了如下数据:
第一次 第二次 第三次
碳的质量(克) 3 6 6
氧气的质量(克) 8 8 16
二氧化硫的质量(克) 11 11 22
⑴第二次实验是否符合质量守恒定律?说明原因 __________________________ 。
⑵通过实验说明,参加反应的各物质之间存在着比例关系,从上可知,参加反应碳和氧气的质量比 ___________________ ;
⑶若该同学进行第四次实验,如果将24克碳完全反应,需要多少克氧气?(通过计算说明)
31.在实验室中用MnO2做为KClO3分解制氧气的催化剂,化学方程式为:
小明查阅资料得知,CuO、Fe2O3等氧化物也能对KClO3的分解起催化作用。小明想知道它们的催化能力是否相同,在实验室进行相关实验,获得实验数据如下表:
(1)在催化剂的回收过程中,要进行过滤操作,需要的玻璃仪器有玻璃棒、烧杯、 _______ 。
(2)本实验中,三种催化剂的催化能力最弱的是 ___________ 。
(3)利用表中数据,请计算第2组实验中分解的KClO3的质量。
反应前 反应后
量气管
40
A
B
60
20
第29题图
0
A
B
B
A
本卷所用的相对原子质量:H 1;O 16;Cl 35.5;N 14;C 12; K 39
一、选择题:(每题2分,共40分)
1.夏天从冰箱里拿出的饮料瓶放在空气中外壁变湿,说明空气中含有 ( )
A.氮气 B.氧气 C.水蒸气 D.二氧化碳
2.下列有关氧气的“自述,,错误的是 ( )
A.我不易溶于水 B.我具有可燃性 C.我能供给呼吸 D.我的化学性质比较活泼
3.薯片等易碎食品宜采用充气袋包装,下列气体中最不适宜充入的是 ( )
A.N2 B.O2 C.CO2 D.空气
4.下列实验操作正确的是 ( )
5.2008年北京奥运会上,会放飞数以万计的彩色气球。用你所学的有关物质化学性质知识和下表提供的数据,气球最好充灌的气体是(空气密度:1.29g/L) ( )
选项 A B C D
气体名称 氢气 氦气 氮气 氧气
密度(g/L) 0.089 0.17 1.25 1.43
6.下列实验现象描述正确的是 ( )
A.磷在氧气中燃烧,有大量白雾产生
B.木炭在氧气中燃烧,发出白光,产生大量的白烟
C.铁丝在氧气中燃烧,火焰呈蓝色并有黑色固体生成
D.硫在氧气中燃烧,发出明亮的蓝紫色火焰,并生成刺激性气味的气体
7.如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化。据此,你认为该同学应该 ( )
A.继续用大针筒向澄清石灰水压入空气
B.撤去大针筒,用嘴向澄清石灰水吹气
C.得出空气中没有二氧化碳的结论
D.得出空气中含有少量二氧化碳的结论
8. 目前,瑞安市空气质量日报的监测项目中包括下列物质,其中不属于氧化物的是 ( )
A.二氧化硫(SO2) B.一氧化碳(CO) C.二氧化氮(NO2) D.臭氧(O3)
9.燃烧、缓慢氧化、自燃的共同点时 ( )
A. 需要点燃 B.反应很剧烈 C.都是化合反应 D.都是氧化反应
10.当你受到不良环境的威胁时,必须保护好自己的身体。如被困在火灾现场时,可采取的措施是
①打119火警电话求救 ②烟很大时,用湿毛巾捂住口鼻 ( )
③有烟雾的地方要蹲下或匍匐前进 ④立即打开所有门窗
A.①④ B.②④ C.①②③ D.①②④
11.2008年5月12日,四川汶川发生里氏8.0级地震。地震造成一列含有12节油罐车的列车在宝成铁路109号隧道里起火,消防队员迅速采取封堵隧道口、注水冷却等措施进行灭火,其灭火原理是
( )
A.清除可燃物 B.隔绝空气 C.使温度降到着火点以下 D.B和C都是
12.下列反应中属于氧化反应,但不属于化合反应的是 ( )
A.硫黄在氧气中燃烧 B.植物的呼吸作用 C.电解水 D.铁在氧气中燃烧
13.某物质和二氧化碳反应后只生成碳酸钠(Na2CO3)和氧气,则该物质中 ( )
A.只含氧元素 B.一定含钠元素和氧元素
C.只含钠氢元素 D. 一定含钠元素,可能含碳、氧元素
14.在一个密闭容器中有X、Y、Z、Q四种物质,一定条件下反应一段时间后,测得反应前后各物质的质量如下:试推断容器中的反应式可能是 ( )
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
A.X+Y→Z+Q B.Z+Q→X+Y C.Y→Z+Q D. Z+Q→Y
15.A、B、C三种不同分子的模型分别为“ ”、“ ”、“ ” ,下图为三种物质之间发生化学反应前后的状况,下列说法错误的是 ( )
A.此反应有单质生成
B.原子在化学变化中是不可分的
C.图中反应物全部是单质
D.此反应是化合反应
16.如图是实验室用高锰酸钾制取并收集氧气的实验装置图,下列关于氧气制取和收集的实验操作错误的是 ( )
A.往试管里装药品前必须检验装置的气密性
B.给试管里药品加热前要先给试管预热
C.导管口有气泡冒出时马上开始收集气体
D.收集到氧气后,集气瓶应正放在桌子上
17.下列叙述完全符合质量守恒定律的是 ( )
A.水结成冰前后质量保持不变 B.50毫升水和50毫升酒精混合总体积小于100毫升
C.在100克过氧化氢溶液中,含有30克过氧化氢和70可水
D.3.2克硫与3.2克氧气恰好完全反应可生成6.4克二氧化硫
18.有化学反应2A+B=2C,设有6g A与B完全反应后生成14g C,若B的相对分子质量为32,则C
的相对分子质量为 ( )
A.7 B.14 C.28 D.56
19.氢气不仅可以在空气中燃烧,还可以在氯气中燃烧,反应方程式为H2+Cl22HCl ,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为( )
20.在一定条件下,在一个完全封闭的容器内发生某反应生,测得反应过程中各物质的质量如下表所示,下列说法错误的是 ( )
物质 a b c d
反应前质量/g 10 10 10 2
反应后质量/g 待测 2 21 2
A.a、b两种物质中元素种类一定与c物质中元素种类相同 B.b物质可能是单质
C.该反应属于化合反应,d可能是催化剂 D.反应后a物质质量为3克
二、简答题:(每空格2分,共32分)
21. 下列有A、B、C、D四种物质,A是没有颜色气味的气体,B在A中燃烧产生明亮的蓝紫色火焰,且生成刺激性气味的气体C,将燃着的火条伸入到D的集气瓶中,火焰立即熄灭,且能使澄清的石灰水变浑浊。由此推断:(写化学式)B D
22.煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔。请分析这种变化的优点是: _________________ ;
煤在燃烧时会产生许多污染物,将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式 。
23.实验室经常用分解高锰酸钾的方法制取氧气,也可以用 的方法制取氧气,工业上生产中需要大量氧气,常采用 的方法制取氧气。
24.在实验室做实验时,发生了下列情况,简要写出由于实验操作而引起下列后果的原因。
(1)铁丝在盛有氧气的集气瓶中燃烧,瓶底炸裂 __________ ;
(2)实验室制氧气并用排水法收集时,水槽中的水沿导管进入热的试管中,使试管炸裂 ;
25.如图是常用的气体发生装置和收集装置。
(1)装置A可用于加热分解高锰酸钾制取氧气,制取时需要在试管口放一团棉花,它的作用是 ___________________________ ;
(2)检验收集的气体是O2的方法是 ___________________ ;
(3)甲烷是一种最简单的有机物,实验室常用AC或AD装置加热分解无水醋酸钠和碱石灰的混合
物来制取甲烷气体。由此可推得甲烷气体具有 _________ 的物理性质。
26.如图是白磷燃烧前后质量的测定的实验时。
(1)把铁丝放在酒精灯外焰上加热,当铁丝发红时,接触引燃白磷,并立即塞紧瓶塞。此过程中最关键的燃烧条件是 ___ ;白磷燃烧后生成物的化学式是 ;
(2)由质量守恒定律可知,化学反应前后一定不变的是 ______ (填序号)
①原子数目 ②原子种类 ③分子数目 ④分子种类 ⑤元素种类 ⑥物质种类
(3)我国使用“长征3号甲”运载火箭将“嫦娥Ⅱ号”送上月球轨道,该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2 NH4ClO4N2↑+Cl2↑+4X+2O2↑,则X的化学式为 _______ ,判断该反应的基本反应类型是 ______ 。
三、科学探究题:(每空格2分,共16分)
27.科学课上做“用红磷燃烧测定空气中氧气的体积分数”的实验时,由于红磷燃烧生成的P2O5对人体有一定危害,小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装置如右图所示。实验时用夹子B夹住橡胶管,打开夹子A,点燃纯净的氢气并迅速插入甲瓶中,使氢气在甲瓶中燃烧。(1)当氢气燃烧的火焰刚好熄灭时,对夹子的操作应是 __ 。
(2)实验测得甲瓶中氧气的体积远小于瓶中空气体积的l/5,写出一种 可能的原因: _____________________________ 。
(3)有同学提出,若用CO取代H2,进行如上操作也能完成氧气体积分数的测定。你是否认同?需要说明理由。 _________________________________________________ 。
28.某学校科学兴趣小组在研究“带火星木条复燃与氧气体积分数的关系”的课题中,采取了以下实验步骤:
①取5只250mL集气瓶,向5只集气瓶中分别装入25mL、50mL、75mL、100mL、125mL的水,并用毛玻璃片盖住,依次编号为1、2、3、4、5;
②用分解过氧化氢(H2O2)的方法制取氧气,用制取的氧气通过排水法将上述1~5号瓶中的水排去;
③将带火星的木条依次插入1~5号瓶中,把观察到现象和计算数据,填入下表。
集气瓶标号 1 2 3 4 5
集气瓶中氧气的体积分数 28.9% 36.8% 44.7% 52.6% 60.5%
带火星木条的状况 微亮 亮 很亮 复燃 复燃
试回答下列问题:
(1)实验室中采用分解过氧化氢(H2O2)的方法制取氧气,其反应的化学方程式是 ________ 。
(2)根据以上实验事实,下列说法中正确的是 _____ (填写相应的字母)。
A、只有在纯氧中才能使带火星的木条复燃
B、集气瓶中氧气的体积分数≥52.6%时,带火星的木条就能复燃
C、只要有氧气存在就可使带火星的木条复燃。
(3)上述实验表明:物质燃烧的程度与氧气的浓度有关,氧气浓度越大,燃烧越剧烈。请你再举一例,简明写出实验内容和实验现象。 ________________________________________ 。
29.某同学对催化剂产生了兴趣,通过查资料了解到氧化铜、氧化铁等都能加速氯酸钾的分解。为了证明氧化铜能加快氯酸钾的分解,他们设计了如下图装置,并进行气体的制备和测量实验。实验时均以生成40mL气体为标准,相关记录见下表:
实验序号 KClO3质量 加入其它的物质 待测数据
1 1.2 g 无其它物质
2 1.2 g 加入少量的CuO
试回答下列问题:
(1)上述实验中的“待测数据”指 ___________ ;
(2)为探究CuO在实验2中是否起催化作用,还需探究的内容是 __________________ 。
四、分析计算题:(30题6分、31题6分,共12分)
30.某同学在研究质量守恒定律的实验过程中,记录了如下数据:
第一次 第二次 第三次
碳的质量(克) 3 6 6
氧气的质量(克) 8 8 16
二氧化硫的质量(克) 11 11 22
⑴第二次实验是否符合质量守恒定律?说明原因 __________________________ 。
⑵通过实验说明,参加反应的各物质之间存在着比例关系,从上可知,参加反应碳和氧气的质量比 ___________________ ;
⑶若该同学进行第四次实验,如果将24克碳完全反应,需要多少克氧气?(通过计算说明)
31.在实验室中用MnO2做为KClO3分解制氧气的催化剂,化学方程式为:
小明查阅资料得知,CuO、Fe2O3等氧化物也能对KClO3的分解起催化作用。小明想知道它们的催化能力是否相同,在实验室进行相关实验,获得实验数据如下表:
(1)在催化剂的回收过程中,要进行过滤操作,需要的玻璃仪器有玻璃棒、烧杯、 _______ 。
(2)本实验中,三种催化剂的催化能力最弱的是 ___________ 。
(3)利用表中数据,请计算第2组实验中分解的KClO3的质量。
反应前 反应后
量气管
40
A
B
60
20
第29题图
0
A
B
B
A
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
