2.7元素符号表示的量 复习学案(含解析)
文档属性
| 名称 | 2.7元素符号表示的量 复习学案(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-05-20 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2020-2021学年八年级下册第二章
2.7元素符号表示的量
一、考点分析
考点一、相对原子质量
一个碳原子的质量:1.993×10-26千克;
一个氢原子的质量:1.674×10-27千克;
一个氧原子的质量:2.657×10-26千克。
原子的质量极小,当我们计算一个水分子的质量是多少时,就会发现计算起来极不方便,为此,国际上规定采用相对原子质量来表示原子的质量关系。
把一个________原子的质量分为12等份,则一份质量为1.993×10-26× = 1.661 ×10-27千克(标准),其他原子的质量与1.661×10-27千克(标准)相比后得出一定的比值,这个比值就是该原子的相对原子质量。例如:
碳的相对原子质量= =12
氧的相对原子质量= ≈16
氢的相对原子质量= ≈1
这样的表达就显得简单,计算起来也十分方便!
微 粒 质量(千克) 相对质量 注 释
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
电子的质量是质子质量的
中子 1.6748×10-27 1
电子 9.1176×10-31
相对原子质量 ≈ _________ + _____ ____
(已知原子的质子数与中子数,计算其相对原子质量时可相加)
知道元素符号,就可以查出元素的相对原子质量。查相对原子质量的方法很多,可从元素周期表中查或从相对原子质量表(附录3)中查,也可从有关物理或化学的手册中查。请查出 1~18 号元素
考点二、相对分子质量
分子是由原子构成的,一个分子的质量是组成成分中各原子质量的总和。由于分子质量很小,通常也用相对质量来表示。一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
注意:1、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;
2、结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加。
化学式表示的含义(以CO2为例):
1、表示________;
2、表示_________;
3、表示_____;
4、表示__________;
5、表示_________
考点三、元素质量分数和质量比的确定
1、元素质量比
元素的质量比=_________×______之间的比
例1. 求水中氢元素和氧元素的质量比。
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)水中氢、氧元素的质量比是H2O中H:O=1×2:16×1=1:8
小试牛刀:求铁锈Fe2O3中铁元素和氧元素的质量比。
2、元素的质量分数
纯净物中某元素质量分数:
二、热点题型详解
题型一、计算元素质量比、元素的质量分数、元素质量
求碳酸氢铵(NH4HCO3)中碳、氢、氮、氧元素的质量比
求CuSO4·5H2O中铜、硫、氧、氢元素的质量比
计算尿素CO(NH2)2中N元素的质量分数。
计算碱式碳酸铜(Cu2(OH)2CO3)中铜元素的质量分数。
求79克碳酸氢铵(NH4HCO3)中氮元素的质量。
含氧化铁(Fe2O3)的质量分数为70%的赤铁矿600kg与多少kg含四氧化三铁的质量分数为70%的磁铁矿中所含的铁元素的质量相等?
题型二:比较元素质量分数的大小、混合物中元素质量分数的计算。
①FeO、②Fe3O4、③Fe2O3、④FeS化合物中,铁的质量分数由低到高排序正确的是( )
A.①②③④ B、④③②① C、③④②① D、②③①④
比较CO、CO2、CH4、C2H2中碳元素的质量分数大小。
在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数是46%,该混合物中铁元素的质量分数是 ( )
A、69% B、46% C、31% D、无法确定
由甲醛(CH2O)、乙酸(C2H4O2)和乙酸乙酯(C4H8O2)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
A、27% B、9% C、54% D、无法计算
CO与x气体的混合气中氧元素的质量分数为50%,则x气体是( )
A.CO2 B.N2O C.SO2 D.NO
某硝酸铵(NH4NO3)样品中混有一种其它氮肥,经分析样品氮元素的质量分数为36%,则该样品可能混有的氮肥是( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
在硫酸铁和硫酸亚铁的混合物中,硫元素的质量分数为22%,则混合物中铁元素的质量分数为多少?
题型三计算分子个数比、元素质量比、物质的质量之比
在两个SO2分子和两个CO2分子中含有一样多的是( )
A、氧分子 B、氧原子 C、氧元素 D、氧的百分含量
相同分子数的SO2与SO3中氧元素的质量比是( )
A、5:6 B、2:3 C、1:1 D、4:5
氧元素质量相同的CO和CO2,分子个数比为: ,碳元素的质量比为: ,CO和CO2的质量比为: 。
含有相同质量氧元素的FeO、Fe3O4、Fe2O3、Fe(OH)3四种化合物,铁元素的质量比为 。
题型四相对分子质量与化合价
某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价是多少?
元素R的氯化物的相对分子质量为M,它的氢氧化物的相对分子质量为N,则R的化合价是多少?
金属R只有一种化合价,相对原子质量为70,其硫酸盐相对分子质量为428,则R的磷酸盐的相对分子质量为(提示:磷酸根离子PO43-)( )
A.165 B.231 C.336 D.无法计算
某元素氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子量为b,则此元素的化合价为 。
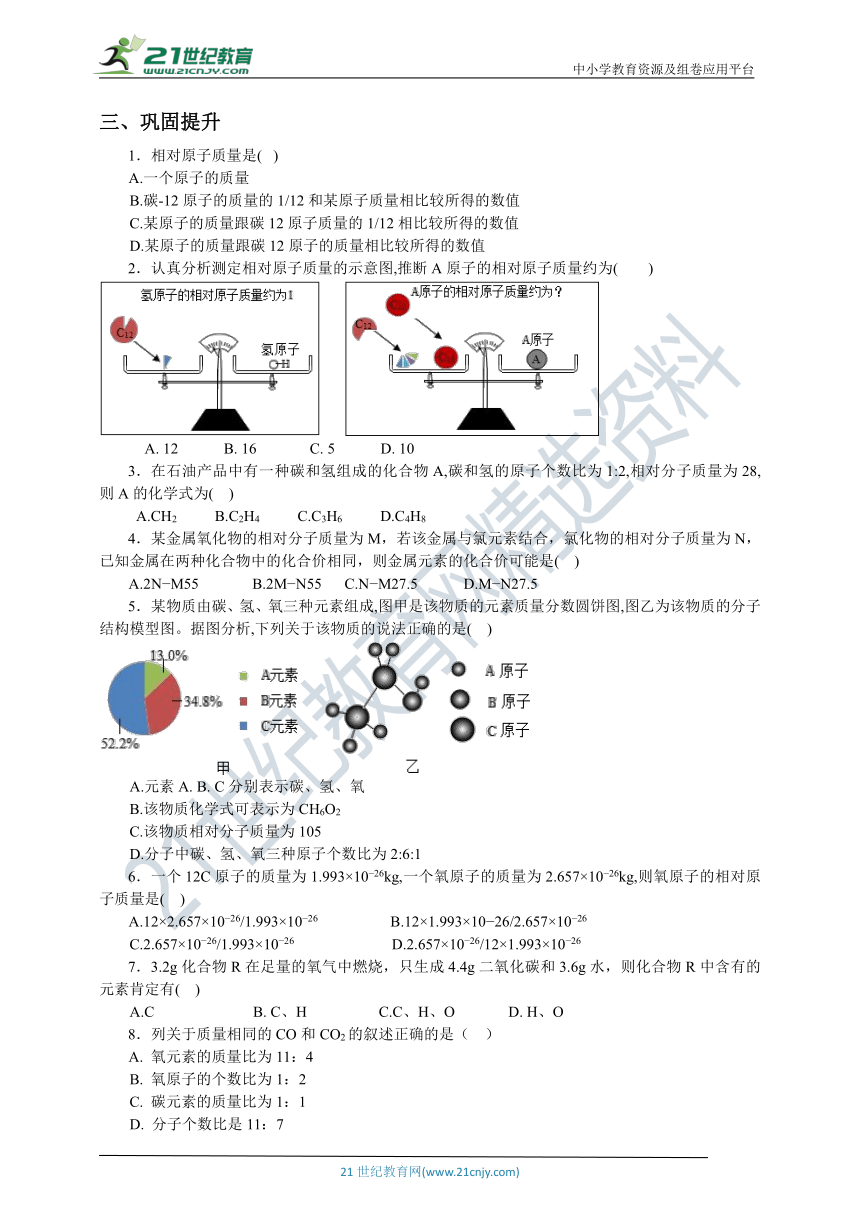
三、巩固提升
相对原子质量是(? )
A.一个原子的质量
B.碳-12原子的质量的1/12和某原子质量相比较所得的数值
C.某原子的质量跟碳12原子质量的1/12相比较所得的数值
D.某原子的质量跟碳12原子的质量相比较所得的数值
认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.?12 B.?16 C.?5 D.?10
在石油产品中有一种碳和氢组成的化合物A,碳和氢的原子个数比为1:2,相对分子质量为28,则A的化学式为( )
A.CH2 B.C2H4 C.C3H6 D.C4H8
某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( )
A.2N?M55 B.2M?N55 C.N?M27.5 D.M?N27.5
某物质由碳、氢、氧三种元素组成,图甲是该物质的元素质量分数圆饼图,图乙为该物质的分子结构模型图。据图分析,下列关于该物质的说法正确的是( )
A.元素A. B.?C分别表示碳、氢、氧
B.该物质化学式可表示为CH6O2
C.该物质相对分子质量为105
D.分子中碳、氢、氧三种原子个数比为2:6:1
一个12C原子的质量为1.993×10?26kg,一个氧原子的质量为2.657×10?26kg,则氧原子的相对原子质量是( )
A.12×2.657×10?26/1.993×10?26 B.12×1.993×10?26/2.657×10?26
C.2.657×10?26/1.993×10?26 D.2.657×10?26/12×1.993×10?26
3.2g化合物R在足量的氧气中燃烧,只生成4.4g二氧化碳和3.6g水,则化合物R中含有的元素肯定有( )
A.C B. C、H ?C.C、H、O D. H、O?
列关于质量相同的CO和CO2的叙述正确的是( )
A. 氧元素的质量比为11:4
B. 氧原子的个数比为1:2
C. 碳元素的质量比为1:1
D. 分子个数比是11:7
只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g。已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( )
A.样品一定是CuO
B.样品可能是Cu、CuO和Cu2O的混合物
C.样品不可能含有Cu2O
D.样品一定是CuO和Cu2O的混合物
模型可以反映客观现象,简单明了地表示事物。
(1)某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是_____________;
(2)图乙是某同学模仿甲图构建的尿素[CO(NH2)2]各元素质量分数的模型,则图中的D表示的是_________元素。
1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1Kg米面食品中加入明矾2g(明矾的化学式为K:Al:S:O:H,相对分子质量为474),请回答下列问题:(1)人从食物中摄入的铝指的是______(填字母)。
A.铝元素 B.铝单质
C.铝合金 D.只有明矾
(2)明矾中各元素的质量比K:Al:S:O:H=______;铝元素的质量分数为______(计算结果精确到0.1%)。
(3)如果某人一天吃了100g上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?______。
钠摄入过量或钾摄入不足都是导致高血压的风险因素。日常生活中选择食用低钠盐能实现减钠补钾。下图为某品牌低钠盐的标签,请你根据标签回答以下问题:
XX品牌? 低钠盐 产品标准号********
配料及含量:氯化钠70%?
氯化钾30%
生产日期********?
保质期*******
(1)氯化钾的相对分子质量为????。
(2)人体每天摄入钠元素的质量不宜超过2.3g。如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过多少克?(结果保留一位小数)
下图是一瓶医用注射盐水标签的部分内容。请完成下列问题。
主要成分:NaCl、H2O 体积:500mL
密度:1g/cm3
NaCl的含量(质量分数):0.9%
(1)在氯化钠中,钠、氯元素的质量比是?? ??。
(2)在氯化钠中,钠元素的质量分数是 ??。(结果精确到0.1%)
(3)该瓶盐水能给病人提供氯化钠的质量是 ??g。
(4)该瓶盐水能给病人提供钠元素的质量是 ??g。(结果精确到0.1g)
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
XXX牌补锌口服液 主要成分:葡萄糖酸锌
化学式:C12H22O14Zn
含锌:5.0mg/支
质量:10.0g/支
(1)葡萄糖酸锌由?? ??种元素组成。
(2)葡萄糖酸锌中碳、氢元素的质量比为?? ??。
(3)要满足儿童身体正常发育的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
2015年10月,中国女药学家屠呦呦因创新型抗疟药——青蒿素和双氢青蒿素的贡献,与另外两位科学家共获2015年度诺贝尔生理学或医学家,请回答下列问题。如图是青蒿素(化学式C15H22O5)和双氢青蒿素(化学式C25H24O5)中各元素质量分数的模型,则表示青蒿素中各元素质量分数的模型是 。
我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有????个原子。
(2)青蒿素中氢元素与氧元素的质量比是????。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
帕拉米韦氯化钠注射液是治疗H7N9亚型流感的有效药物之一,帕拉米韦化学方程式为C15H28NxO4。试计算:
(1)帕拉米韦中氢元素与氧元素的质量比为______;
(2)帕拉米韦的相对分子量为328,则x的数值为______;
(3)32.8g的帕拉米韦中氧元素的质量为______g(写出计算过程,结果精确到0.1g)。
某地1000Kg化肥的市场价格如下:CO(NH2)2?1080元,NH4NO3?810元,NH4HCO3?330元,试计算:
(1)CO(NH2)2的相对分子质量。
(2)NH4NO3中氮元素的含量。
(3)现用10000元采购上述化肥中的一种,要想购得化肥中氮元素的质量最多,你应该购买哪一种?
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合所学知识,回答下列问题。
配料表 精制海盐,碘酸钾
含碘量/kg 20g?40g
包装日期 见封底
储存方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘酸钾的化学式为KIO3,则碘酸钾的相对分子质量为______,其中碘元素的质量分数为______,碘元素的化合价为______价。
(2)根据加碘食盐的储藏方法和食用方法可推测:碘酸钾的化学性质______(填“稳定”或“不稳定”).
(3)从2000年10月1日起。我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐中含碘酸钾______g.
我国从1994年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防制碘缺乏病的发生,2010年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至25mg.试计算:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比为 ;
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到0.1%)
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg碘,即少加碘酸钾___mg(计算结果精确至0.1mg)
维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水。α?丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“?”表示原子之间的相互连接)。
从物质分类看,蛋白质、糖类、维生素和α?丙氨酸均属于有机物;在α?丙氨酸中各元素的原子个数比为C:H:O:N= ,其中氮元素的百分含量为 (保留一位小数)。
2020-2021学年八年级下册第二章
2.7元素符号表示的量
一、考点分析
考点一、相对原子质量
一个碳原子的质量:1.993×10-26千克;
一个氢原子的质量:1.674×10-27千克;
一个氧原子的质量:2.657×10-26千克。
原子的质量极小,当我们计算一个水分子的质量是多少时,就会发现计算起来极不方便,为此,国际上规定采用相对原子质量来表示原子的质量关系。
把一个____碳-12_____原子的质量分为12等份,则一份质量为1.993×10-26× = 1.661 ×10-27千克(标准),其他原子的质量与1.661×10-27千克(标准)相比后得出一定的比值,这个比值就是该原子的相对原子质量。例如:
碳的相对原子质量= =12
氧的相对原子质量= ≈16
氢的相对原子质量= ≈1
这样的表达就显得简单,计算起来也十分方便!
微 粒 质量(千克) 相对质量 注 释
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
电子的质量是质子质量的
中子 1.6748×10-27 1
电子 9.1176×10-31
相对原子质量 ≈ ______质子数_____ + _____ 中子数_____
(已知原子的质子数与中子数,计算其相对原子质量时可相加)
知道元素符号,就可以查出元素的相对原子质量。查相对原子质量的方法很多,可从元素周期表中查或从相对原子质量表(附录3)中查,也可从有关物理或化学的手册中查。请查出 1~18 号元素
考点二、相对分子质量
分子是由原子构成的,一个分子的质量是组成成分中各原子质量的总和。由于分子质量很小,通常也用相对质量来表示。一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
注意:1、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;
2、结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加。
化学式表示的含义(以CO2为例):
1、表示____二氧化碳气体____;
2、表示______一个二氧化碳分子_____;
3、表示_____二氧化碳分子由碳元素和氧元素组成___;
4、表示_____一个二氧化碳分子由一个碳原子和两个氧原子构成______;
5、表示______二氧化碳的相对分子质量为12+16×2=44____
考点三、元素质量分数和质量比的确定
1、元素质量比
元素的质量比=______(各元素的相对原子质量_____×____原子个数)___之间的比
例1. 求水中氢元素和氧元素的质量比。
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)水中氢、氧元素的质量比是H2O中H:O=1×2:16×1=1:8
小试牛刀:求铁锈Fe2O3中铁元素和氧元素的质量比。
2、元素的质量分数
纯净物中某元素质量分数:
二、热点题型详解
题型一、计算元素质量比、元素的质量分数、元素质量
求碳酸氢铵(NH4HCO3)中碳、氢、氮、氧元素的质量比
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)碳酸氢铵中碳、氢、氮、氧元素的质量比是
C ∶H∶N∶O==12∶(1×5)∶14∶(16×3)==12∶5∶14∶48
答:碳酸氢铵中碳、氢、氮、氧元素的质量比是12∶5∶14∶48
求CuSO4·5H2O中铜、硫、氧、氢元素的质量比
【答案】Cu:S:O:H=64:32:144:10=32:16:72:5
计算尿素CO(NH2)2中N元素的质量分数。
【答案】46.7%
计算碱式碳酸铜(Cu2(OH)2CO3)中铜元素的质量分数。
【答案】 57.6%
求79克碳酸氢铵(NH4HCO3)中氮元素的质量。
解:先根据化学式计算出相对分子质量:M=14+1×4+1+12+16×3=79
再算出氮肥元素的质量分数:14/79
最后计算出氮元素的质量=氮的相对原子质量/碳酸氢铵的相对分子质量×79克=14/79×79克=14克
含氧化铁(Fe2O3)的质量分数为70%的赤铁矿600kg与多少kg含四氧化三铁的质量分数为70%的磁铁矿中所含的铁元素的质量相等?
解:赤铁矿中所含铁元素质量=600kg×70%×=294kg 磁铁矿中m=/70%=580kg
题型二:比较元素质量分数的大小、混合物中元素质量分数的计算。
①FeO、②Fe3O4、③Fe2O3、④FeS化合物中,铁的质量分数由低到高排序正确的是( B )
A.①②③④ B、④③②① C、③④②① D、②③①④
解:本题可将Fe元素的系数定为1,则化学式变为FeO、FeO、FeO、FeS,由于每个分子中铁元素的质量相同,则其他元素的质量越少,则铁的质量分数越大。
比较CO、CO2、CH4、C2H2中碳元素的质量分数大小。
【答案】 C2H2>CH4>CO>CO2
【教学法建议】 可在老师的指导下,由学生自己总结出解决该类型题目的基本方法、并学会应用
在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数是46%,该混合物中铁元素的质量分数是 ( C )
A、69% B、46% C、31% D、无法确定
由甲醛(CH2O)、乙酸(C2H4O2)和乙酸乙酯(C4H8O2)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( C )
A、27% B、9% C、54% D、无法计算
解:在混合物中,只有3种元素C、H、O,氧元素的质量分数为37%,那么碳和氢元素的质量分数为63%,在甲醛(CH2O)、乙酸(C2H4O2)、乙酸乙酯(C4H8O2)中,碳氢比例相同,C:H=6:1(质量比),所以C占6/7、故为63%×6/7=54%,故选C。
在硫酸铁和硫酸亚铁的混合物中,硫元素的质量分数为22%,则混合物中铁元素的质量分数为多少?
【答案】 34%
【教学法建议】 在解决混合物中元素质量分数的计算的时候,要让学生善于发现规律,找到突破口。
CO与x气体的混合气中氧元素的质量分数为50%,则x气体是( B )
A.CO2 B.N2O C.SO2 D.NO
【答案】 CO中氧元素的质量分数为57.1%>混合物中氧元素的质量分数50%,表明X气体中氧元素的质量分数小于50%,故选B
某硝酸铵(NH4NO3)样品中混有一种其它氮肥,经分析样品氮元素的质量分数为36%,则该样品可能混有的氮肥是( D )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
题型三计算分子个数比、元素质量比、物质的质量之比
在两个SO2分子和两个CO2分子中含有一样多的是( B )
A、氧分子 B、氧原子 C、氧元素 D、氧的百分含量
相同分子数的SO2与SO3中氧元素的质量比是( B )
A、5:6 B、2:3 C、1:1 D、4:5
氧元素质量相同的CO和CO2,分子个数比为: ,碳元素的质量比为: ,CO和CO2的质量比为: 。
【答案】 2:1、2:1、14:11
含有相同质量氧元素的FeO、Fe3O4、Fe2O3、Fe(OH)3四种化合物,铁元素的质量比为 。
【答案】12:9:8:4
【教学法建议】 在做该类型题目的时候,可以采用通分的方法,即定其中一种元素的质量(或个数)相同,从而判断出其它物质(或元素)的质量比,相比繁琐的计算来说,该种方法比较简单、快捷。
题型四、相对分子质量与化合价
某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价是多少?
【答案】(2n-m)/55
元素R的氯化物的相对分子质量为M,它的氢氧化物的相对分子质量为N,则R的化合价是多少?
【答案】
金属R只有一种化合价,相对原子质量为70,其硫酸盐相对分子质量为428,则R的磷酸盐的相对分子质量为(提示:磷酸根离子PO43-)( A )
A.165 B.231 C.336 D.无法计算
某元素氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子量为b,则此元素的化合价为 。
【答案】 (b-a)/40、(b-a)/80
三、巩固提升
相对原子质量是(?C )
A.一个原子的质量
B.碳-12原子的质量的1/12和某原子质量相比较所得的数值
C.某原子的质量跟碳12原子质量的1/12相比较所得的数值
D.某原子的质量跟碳12原子的质量相比较所得的数值
认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( B )
A.?12 B.?16 C.?5 D.?10
在石油产品中有一种碳和氢组成的化合物A,碳和氢的原子个数比为1:2,相对分子质量为28,则A的化学式为( B )
A.CH2 B.C2H4 C.C3H6 D.C4H8
某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( A )
A.2N?M55 B.2M?N55 C.N?M27.5 D.M?N27.5
某物质由碳、氢、氧三种元素组成,图甲是该物质的元素质量分数圆饼图,图乙为该物质的分子结构模型图。据图分析,下列关于该物质的说法正确的是( D )
A.元素A. B.?C分别表示碳、氢、氧
B.该物质化学式可表示为CH6O2
C.该物质相对分子质量为105
D.分子中碳、氢、氧三种原子个数比为2:6:1
一个12C原子的质量为1.993×10?26kg,一个氧原子的质量为2.657×10?26kg,则氧原子的相对原子质量是( A )
A.12×2.657×10?26/1.993×10?26 B.12×1.993×10?26/2.657×10?26
C.2.657×10?26/1.993×10?26 D.2.657×10?26/12×1.993×10?26
3.2g化合物R在足量的氧气中燃烧,只生成4.4g二氧化碳和3.6g水,则化合物R中含有的元素肯定有( C )
A.C B. C、H ?C.C、H、O D. H、O?
列关于质量相同的CO和CO2的叙述正确的是( D )
A. 氧元素的质量比为11:4
B. 氧原子的个数比为1:2
C. 碳元素的质量比为1:1
D. 分子个数比是11:7
只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g。已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( B )
A.样品一定是CuO
B.样品可能是Cu、CuO和Cu2O的混合物
C.样品不可能含有Cu2O
D.样品一定是CuO和Cu2O的混合物
模型可以反映客观现象,简单明了地表示事物。
(1)某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是_____________;
(2)图乙是某同学模仿甲图构建的尿素[CO(NH2)2]各元素质量分数的模型,则图中的D表示的是_________元素。
答案:(1)碳酸钙;(2)氧。
1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1Kg米面食品中加入明矾2g(明矾的化学式为K:Al:S:O:H,相对分子质量为474),请回答下列问题:(1)人从食物中摄入的铝指的是______(填字母)。
A.铝元素 B.铝单质
C.铝合金 D.只有明矾
(2)明矾中各元素的质量比K:Al:S:O:H=______;铝元素的质量分数为______(计算结果精确到0.1%)。
(3)如果某人一天吃了100g上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?______。
答案:(1)A;(2)39:27:64:320:24;5.7%;(3)超过。
钠摄入过量或钾摄入不足都是导致高血压的风险因素。日常生活中选择食用低钠盐能实现减钠补钾。下图为某品牌低钠盐的标签,请你根据标签回答以下问题:
XX品牌? 低钠盐 产品标准号********
配料及含量:氯化钠70%?
氯化钾30%
生产日期********?
保质期*******
(1)氯化钾的相对分子质量为????。
(2)人体每天摄入钠元素的质量不宜超过2.3g。如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过多少克?(结果保留一位小数)
答:(1)74.5;(2)一个人每天摄入该品牌低钠盐的质量不宜超过8.4克。
下图是一瓶医用注射盐水标签的部分内容。请完成下列问题。
主要成分:NaCl、H2O 体积:500mL
密度:1g/cm3
NaCl的含量(质量分数):0.9%
(1)在氯化钠中,钠、氯元素的质量比是?? ??。
(2)在氯化钠中,钠元素的质量分数是 ??。(结果精确到0.1%)
(3)该瓶盐水能给病人提供氯化钠的质量是 ??g。
(4)该瓶盐水能给病人提供钠元素的质量是 ??g。(结果精确到0.1g)
答案:(1)46:71;(2)39.3%;(3)4.5;(4)1.8。
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
XXX牌补锌口服液 主要成分:葡萄糖酸锌
化学式:C12H22O14Zn
含锌:5.0mg/支
质量:10.0g/支
(1)葡萄糖酸锌由?? ??种元素组成。
(2)葡萄糖酸锌中碳、氢元素的质量比为?? ??。
(3)要满足儿童身体正常发育的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
答案:(1)四;(2)72:11;(3)1支。
2015年10月,中国女药学家屠呦呦因创新型抗疟药——青蒿素和双氢青蒿素的贡献,与另外两位科学家共获2015年度诺贝尔生理学或医学家,请回答下列问题。如图是青蒿素(化学式C15H22O5)和双氢青蒿素(化学式C25H24O5)中各元素质量分数的模型,则表示青蒿素中各元素质量分数的模型是 。
答案:甲
我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有????个原子。
(2)青蒿素中氢元素与氧元素的质量比是????。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
答案:(1)42;(2)11:40;(3)21.5g。
帕拉米韦氯化钠注射液是治疗H7N9亚型流感的有效药物之一,帕拉米韦化学方程式为C15H28NxO4。试计算:
(1)帕拉米韦中氢元素与氧元素的质量比为______;
(2)帕拉米韦的相对分子量为328,则x的数值为______;
(3)32.8g的帕拉米韦中氧元素的质量为______g(写出计算过程,结果精确到0.1g)。
答案:(1)7:16;(2)4;(3)6.4.
某地1000Kg化肥的市场价格如下:CO(NH2)2?1080元,NH4NO3?810元,NH4HCO3?330元,试计算:
(1)CO(NH2)2的相对分子质量。
(2)NH4NO3中氮元素的含量。
(3)现用10000元采购上述化肥中的一种,要想购得化肥中氮元素的质量最多,你应该购买哪一种?
(1)CO(NH2)2的相对分子质量=12+16+(14+1×2)×2=60;
(2)NH4NO3中氮元素的含量为:14×214+1×4+14+16×3×100%=35%;
(3)10000元购买的尿素中氮元素的质量为:10000元÷1080元1000kg×14×260=4320Kg;
10000元购买的硝酸铵中氮元素的质量为:10000元÷810元1000kg×35%=4320Kg;
10000元购买的碳酸氢铵中氮元素的质量为:10000元÷330元1000kg×1479=5370Kg;
故应该购买的是碳酸氢铵。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合所学知识,回答下列问题。
配料表 精制海盐,碘酸钾
含碘量/kg 20g?40g
包装日期 见封底
储存方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘酸钾的化学式为KIO3,则碘酸钾的相对分子质量为______,其中碘元素的质量分数为______,碘元素的化合价为______价。
(2)根据加碘食盐的储藏方法和食用方法可推测:碘酸钾的化学性质______(填“稳定”或“不稳定”).
(3)从2000年10月1日起。我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐中含碘酸钾______g.
答案为:214;59.3%;+5;
(2)由食用方法说明可知,碘酸钾在受热时易分解,热稳定性差,故答案为:不稳定;
(3)每千克食盐含碘0.035克,相当于每千克食盐含碘酸钾的质量=0.035g÷59.3%=0.059g,故答案为:0.059。
我国从1994年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防制碘缺乏病的发生,2010年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至25mg.试计算:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比为 ;
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到0.1%)
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg碘,即少加碘酸钾___mg(计算结果精确至0.1mg)
(1)39:127:48;(2)59.3%;(3)7.5;12.6。
维持人类·生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水。α?丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“?”表示原子之间的相互连接)。
从物质分类看,蛋白质、糖类、维生素和α?丙氨酸均属于有机物;在α?丙氨酸中各元素的原子个数比为C:H:O:N= ,其中氮元素的百分含量为 (保留一位小数)。
答案为:3:7:2:1;15.7%.
_21?????????è?????(www.21cnjy.com)_
2020-2021学年八年级下册第二章
2.7元素符号表示的量
一、考点分析
考点一、相对原子质量
一个碳原子的质量:1.993×10-26千克;
一个氢原子的质量:1.674×10-27千克;
一个氧原子的质量:2.657×10-26千克。
原子的质量极小,当我们计算一个水分子的质量是多少时,就会发现计算起来极不方便,为此,国际上规定采用相对原子质量来表示原子的质量关系。
把一个________原子的质量分为12等份,则一份质量为1.993×10-26× = 1.661 ×10-27千克(标准),其他原子的质量与1.661×10-27千克(标准)相比后得出一定的比值,这个比值就是该原子的相对原子质量。例如:
碳的相对原子质量= =12
氧的相对原子质量= ≈16
氢的相对原子质量= ≈1
这样的表达就显得简单,计算起来也十分方便!
微 粒 质量(千克) 相对质量 注 释
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
电子的质量是质子质量的
中子 1.6748×10-27 1
电子 9.1176×10-31
相对原子质量 ≈ _________ + _____ ____
(已知原子的质子数与中子数,计算其相对原子质量时可相加)
知道元素符号,就可以查出元素的相对原子质量。查相对原子质量的方法很多,可从元素周期表中查或从相对原子质量表(附录3)中查,也可从有关物理或化学的手册中查。请查出 1~18 号元素
考点二、相对分子质量
分子是由原子构成的,一个分子的质量是组成成分中各原子质量的总和。由于分子质量很小,通常也用相对质量来表示。一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
注意:1、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;
2、结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加。
化学式表示的含义(以CO2为例):
1、表示________;
2、表示_________;
3、表示_____;
4、表示__________;
5、表示_________
考点三、元素质量分数和质量比的确定
1、元素质量比
元素的质量比=_________×______之间的比
例1. 求水中氢元素和氧元素的质量比。
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)水中氢、氧元素的质量比是H2O中H:O=1×2:16×1=1:8
小试牛刀:求铁锈Fe2O3中铁元素和氧元素的质量比。
2、元素的质量分数
纯净物中某元素质量分数:
二、热点题型详解
题型一、计算元素质量比、元素的质量分数、元素质量
求碳酸氢铵(NH4HCO3)中碳、氢、氮、氧元素的质量比
求CuSO4·5H2O中铜、硫、氧、氢元素的质量比
计算尿素CO(NH2)2中N元素的质量分数。
计算碱式碳酸铜(Cu2(OH)2CO3)中铜元素的质量分数。
求79克碳酸氢铵(NH4HCO3)中氮元素的质量。
含氧化铁(Fe2O3)的质量分数为70%的赤铁矿600kg与多少kg含四氧化三铁的质量分数为70%的磁铁矿中所含的铁元素的质量相等?
题型二:比较元素质量分数的大小、混合物中元素质量分数的计算。
①FeO、②Fe3O4、③Fe2O3、④FeS化合物中,铁的质量分数由低到高排序正确的是( )
A.①②③④ B、④③②① C、③④②① D、②③①④
比较CO、CO2、CH4、C2H2中碳元素的质量分数大小。
在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数是46%,该混合物中铁元素的质量分数是 ( )
A、69% B、46% C、31% D、无法确定
由甲醛(CH2O)、乙酸(C2H4O2)和乙酸乙酯(C4H8O2)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
A、27% B、9% C、54% D、无法计算
CO与x气体的混合气中氧元素的质量分数为50%,则x气体是( )
A.CO2 B.N2O C.SO2 D.NO
某硝酸铵(NH4NO3)样品中混有一种其它氮肥,经分析样品氮元素的质量分数为36%,则该样品可能混有的氮肥是( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
在硫酸铁和硫酸亚铁的混合物中,硫元素的质量分数为22%,则混合物中铁元素的质量分数为多少?
题型三计算分子个数比、元素质量比、物质的质量之比
在两个SO2分子和两个CO2分子中含有一样多的是( )
A、氧分子 B、氧原子 C、氧元素 D、氧的百分含量
相同分子数的SO2与SO3中氧元素的质量比是( )
A、5:6 B、2:3 C、1:1 D、4:5
氧元素质量相同的CO和CO2,分子个数比为: ,碳元素的质量比为: ,CO和CO2的质量比为: 。
含有相同质量氧元素的FeO、Fe3O4、Fe2O3、Fe(OH)3四种化合物,铁元素的质量比为 。
题型四相对分子质量与化合价
某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价是多少?
元素R的氯化物的相对分子质量为M,它的氢氧化物的相对分子质量为N,则R的化合价是多少?
金属R只有一种化合价,相对原子质量为70,其硫酸盐相对分子质量为428,则R的磷酸盐的相对分子质量为(提示:磷酸根离子PO43-)( )
A.165 B.231 C.336 D.无法计算
某元素氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子量为b,则此元素的化合价为 。
三、巩固提升
相对原子质量是(? )
A.一个原子的质量
B.碳-12原子的质量的1/12和某原子质量相比较所得的数值
C.某原子的质量跟碳12原子质量的1/12相比较所得的数值
D.某原子的质量跟碳12原子的质量相比较所得的数值
认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.?12 B.?16 C.?5 D.?10
在石油产品中有一种碳和氢组成的化合物A,碳和氢的原子个数比为1:2,相对分子质量为28,则A的化学式为( )
A.CH2 B.C2H4 C.C3H6 D.C4H8
某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( )
A.2N?M55 B.2M?N55 C.N?M27.5 D.M?N27.5
某物质由碳、氢、氧三种元素组成,图甲是该物质的元素质量分数圆饼图,图乙为该物质的分子结构模型图。据图分析,下列关于该物质的说法正确的是( )
A.元素A. B.?C分别表示碳、氢、氧
B.该物质化学式可表示为CH6O2
C.该物质相对分子质量为105
D.分子中碳、氢、氧三种原子个数比为2:6:1
一个12C原子的质量为1.993×10?26kg,一个氧原子的质量为2.657×10?26kg,则氧原子的相对原子质量是( )
A.12×2.657×10?26/1.993×10?26 B.12×1.993×10?26/2.657×10?26
C.2.657×10?26/1.993×10?26 D.2.657×10?26/12×1.993×10?26
3.2g化合物R在足量的氧气中燃烧,只生成4.4g二氧化碳和3.6g水,则化合物R中含有的元素肯定有( )
A.C B. C、H ?C.C、H、O D. H、O?
列关于质量相同的CO和CO2的叙述正确的是( )
A. 氧元素的质量比为11:4
B. 氧原子的个数比为1:2
C. 碳元素的质量比为1:1
D. 分子个数比是11:7
只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g。已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( )
A.样品一定是CuO
B.样品可能是Cu、CuO和Cu2O的混合物
C.样品不可能含有Cu2O
D.样品一定是CuO和Cu2O的混合物
模型可以反映客观现象,简单明了地表示事物。
(1)某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是_____________;
(2)图乙是某同学模仿甲图构建的尿素[CO(NH2)2]各元素质量分数的模型,则图中的D表示的是_________元素。
1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1Kg米面食品中加入明矾2g(明矾的化学式为K:Al:S:O:H,相对分子质量为474),请回答下列问题:(1)人从食物中摄入的铝指的是______(填字母)。
A.铝元素 B.铝单质
C.铝合金 D.只有明矾
(2)明矾中各元素的质量比K:Al:S:O:H=______;铝元素的质量分数为______(计算结果精确到0.1%)。
(3)如果某人一天吃了100g上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?______。
钠摄入过量或钾摄入不足都是导致高血压的风险因素。日常生活中选择食用低钠盐能实现减钠补钾。下图为某品牌低钠盐的标签,请你根据标签回答以下问题:
XX品牌? 低钠盐 产品标准号********
配料及含量:氯化钠70%?
氯化钾30%
生产日期********?
保质期*******
(1)氯化钾的相对分子质量为????。
(2)人体每天摄入钠元素的质量不宜超过2.3g。如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过多少克?(结果保留一位小数)
下图是一瓶医用注射盐水标签的部分内容。请完成下列问题。
主要成分:NaCl、H2O 体积:500mL
密度:1g/cm3
NaCl的含量(质量分数):0.9%
(1)在氯化钠中,钠、氯元素的质量比是?? ??。
(2)在氯化钠中,钠元素的质量分数是 ??。(结果精确到0.1%)
(3)该瓶盐水能给病人提供氯化钠的质量是 ??g。
(4)该瓶盐水能给病人提供钠元素的质量是 ??g。(结果精确到0.1g)
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
XXX牌补锌口服液 主要成分:葡萄糖酸锌
化学式:C12H22O14Zn
含锌:5.0mg/支
质量:10.0g/支
(1)葡萄糖酸锌由?? ??种元素组成。
(2)葡萄糖酸锌中碳、氢元素的质量比为?? ??。
(3)要满足儿童身体正常发育的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
2015年10月,中国女药学家屠呦呦因创新型抗疟药——青蒿素和双氢青蒿素的贡献,与另外两位科学家共获2015年度诺贝尔生理学或医学家,请回答下列问题。如图是青蒿素(化学式C15H22O5)和双氢青蒿素(化学式C25H24O5)中各元素质量分数的模型,则表示青蒿素中各元素质量分数的模型是 。
我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有????个原子。
(2)青蒿素中氢元素与氧元素的质量比是????。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
帕拉米韦氯化钠注射液是治疗H7N9亚型流感的有效药物之一,帕拉米韦化学方程式为C15H28NxO4。试计算:
(1)帕拉米韦中氢元素与氧元素的质量比为______;
(2)帕拉米韦的相对分子量为328,则x的数值为______;
(3)32.8g的帕拉米韦中氧元素的质量为______g(写出计算过程,结果精确到0.1g)。
某地1000Kg化肥的市场价格如下:CO(NH2)2?1080元,NH4NO3?810元,NH4HCO3?330元,试计算:
(1)CO(NH2)2的相对分子质量。
(2)NH4NO3中氮元素的含量。
(3)现用10000元采购上述化肥中的一种,要想购得化肥中氮元素的质量最多,你应该购买哪一种?
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合所学知识,回答下列问题。
配料表 精制海盐,碘酸钾
含碘量/kg 20g?40g
包装日期 见封底
储存方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘酸钾的化学式为KIO3,则碘酸钾的相对分子质量为______,其中碘元素的质量分数为______,碘元素的化合价为______价。
(2)根据加碘食盐的储藏方法和食用方法可推测:碘酸钾的化学性质______(填“稳定”或“不稳定”).
(3)从2000年10月1日起。我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐中含碘酸钾______g.
我国从1994年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防制碘缺乏病的发生,2010年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至25mg.试计算:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比为 ;
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到0.1%)
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg碘,即少加碘酸钾___mg(计算结果精确至0.1mg)
维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水。α?丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“?”表示原子之间的相互连接)。
从物质分类看,蛋白质、糖类、维生素和α?丙氨酸均属于有机物;在α?丙氨酸中各元素的原子个数比为C:H:O:N= ,其中氮元素的百分含量为 (保留一位小数)。
2020-2021学年八年级下册第二章
2.7元素符号表示的量
一、考点分析
考点一、相对原子质量
一个碳原子的质量:1.993×10-26千克;
一个氢原子的质量:1.674×10-27千克;
一个氧原子的质量:2.657×10-26千克。
原子的质量极小,当我们计算一个水分子的质量是多少时,就会发现计算起来极不方便,为此,国际上规定采用相对原子质量来表示原子的质量关系。
把一个____碳-12_____原子的质量分为12等份,则一份质量为1.993×10-26× = 1.661 ×10-27千克(标准),其他原子的质量与1.661×10-27千克(标准)相比后得出一定的比值,这个比值就是该原子的相对原子质量。例如:
碳的相对原子质量= =12
氧的相对原子质量= ≈16
氢的相对原子质量= ≈1
这样的表达就显得简单,计算起来也十分方便!
微 粒 质量(千克) 相对质量 注 释
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
电子的质量是质子质量的
中子 1.6748×10-27 1
电子 9.1176×10-31
相对原子质量 ≈ ______质子数_____ + _____ 中子数_____
(已知原子的质子数与中子数,计算其相对原子质量时可相加)
知道元素符号,就可以查出元素的相对原子质量。查相对原子质量的方法很多,可从元素周期表中查或从相对原子质量表(附录3)中查,也可从有关物理或化学的手册中查。请查出 1~18 号元素
考点二、相对分子质量
分子是由原子构成的,一个分子的质量是组成成分中各原子质量的总和。由于分子质量很小,通常也用相对质量来表示。一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
注意:1、含有原子团的化学式,先求出一个原子团的相对质量,再乘以其个数;
2、结晶水合物化学式中的“· ”表示结合的含义,在计算相对分子质量时直接相加。
化学式表示的含义(以CO2为例):
1、表示____二氧化碳气体____;
2、表示______一个二氧化碳分子_____;
3、表示_____二氧化碳分子由碳元素和氧元素组成___;
4、表示_____一个二氧化碳分子由一个碳原子和两个氧原子构成______;
5、表示______二氧化碳的相对分子质量为12+16×2=44____
考点三、元素质量分数和质量比的确定
1、元素质量比
元素的质量比=______(各元素的相对原子质量_____×____原子个数)___之间的比
例1. 求水中氢元素和氧元素的质量比。
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)水中氢、氧元素的质量比是H2O中H:O=1×2:16×1=1:8
小试牛刀:求铁锈Fe2O3中铁元素和氧元素的质量比。
2、元素的质量分数
纯净物中某元素质量分数:
二、热点题型详解
题型一、计算元素质量比、元素的质量分数、元素质量
求碳酸氢铵(NH4HCO3)中碳、氢、氮、氧元素的质量比
解:(1)查出组成物质分子的原子的相对原子质量
(2)确定各个元素的原子个数
(3)碳酸氢铵中碳、氢、氮、氧元素的质量比是
C ∶H∶N∶O==12∶(1×5)∶14∶(16×3)==12∶5∶14∶48
答:碳酸氢铵中碳、氢、氮、氧元素的质量比是12∶5∶14∶48
求CuSO4·5H2O中铜、硫、氧、氢元素的质量比
【答案】Cu:S:O:H=64:32:144:10=32:16:72:5
计算尿素CO(NH2)2中N元素的质量分数。
【答案】46.7%
计算碱式碳酸铜(Cu2(OH)2CO3)中铜元素的质量分数。
【答案】 57.6%
求79克碳酸氢铵(NH4HCO3)中氮元素的质量。
解:先根据化学式计算出相对分子质量:M=14+1×4+1+12+16×3=79
再算出氮肥元素的质量分数:14/79
最后计算出氮元素的质量=氮的相对原子质量/碳酸氢铵的相对分子质量×79克=14/79×79克=14克
含氧化铁(Fe2O3)的质量分数为70%的赤铁矿600kg与多少kg含四氧化三铁的质量分数为70%的磁铁矿中所含的铁元素的质量相等?
解:赤铁矿中所含铁元素质量=600kg×70%×=294kg 磁铁矿中m=/70%=580kg
题型二:比较元素质量分数的大小、混合物中元素质量分数的计算。
①FeO、②Fe3O4、③Fe2O3、④FeS化合物中,铁的质量分数由低到高排序正确的是( B )
A.①②③④ B、④③②① C、③④②① D、②③①④
解:本题可将Fe元素的系数定为1,则化学式变为FeO、FeO、FeO、FeS,由于每个分子中铁元素的质量相同,则其他元素的质量越少,则铁的质量分数越大。
比较CO、CO2、CH4、C2H2中碳元素的质量分数大小。
【答案】 C2H2>CH4>CO>CO2
【教学法建议】 可在老师的指导下,由学生自己总结出解决该类型题目的基本方法、并学会应用
在FeSO4和Fe2(SO4)3的混合物中,氧元素的质量分数是46%,该混合物中铁元素的质量分数是 ( C )
A、69% B、46% C、31% D、无法确定
由甲醛(CH2O)、乙酸(C2H4O2)和乙酸乙酯(C4H8O2)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( C )
A、27% B、9% C、54% D、无法计算
解:在混合物中,只有3种元素C、H、O,氧元素的质量分数为37%,那么碳和氢元素的质量分数为63%,在甲醛(CH2O)、乙酸(C2H4O2)、乙酸乙酯(C4H8O2)中,碳氢比例相同,C:H=6:1(质量比),所以C占6/7、故为63%×6/7=54%,故选C。
在硫酸铁和硫酸亚铁的混合物中,硫元素的质量分数为22%,则混合物中铁元素的质量分数为多少?
【答案】 34%
【教学法建议】 在解决混合物中元素质量分数的计算的时候,要让学生善于发现规律,找到突破口。
CO与x气体的混合气中氧元素的质量分数为50%,则x气体是( B )
A.CO2 B.N2O C.SO2 D.NO
【答案】 CO中氧元素的质量分数为57.1%>混合物中氧元素的质量分数50%,表明X气体中氧元素的质量分数小于50%,故选B
某硝酸铵(NH4NO3)样品中混有一种其它氮肥,经分析样品氮元素的质量分数为36%,则该样品可能混有的氮肥是( D )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
题型三计算分子个数比、元素质量比、物质的质量之比
在两个SO2分子和两个CO2分子中含有一样多的是( B )
A、氧分子 B、氧原子 C、氧元素 D、氧的百分含量
相同分子数的SO2与SO3中氧元素的质量比是( B )
A、5:6 B、2:3 C、1:1 D、4:5
氧元素质量相同的CO和CO2,分子个数比为: ,碳元素的质量比为: ,CO和CO2的质量比为: 。
【答案】 2:1、2:1、14:11
含有相同质量氧元素的FeO、Fe3O4、Fe2O3、Fe(OH)3四种化合物,铁元素的质量比为 。
【答案】12:9:8:4
【教学法建议】 在做该类型题目的时候,可以采用通分的方法,即定其中一种元素的质量(或个数)相同,从而判断出其它物质(或元素)的质量比,相比繁琐的计算来说,该种方法比较简单、快捷。
题型四、相对分子质量与化合价
某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价是多少?
【答案】(2n-m)/55
元素R的氯化物的相对分子质量为M,它的氢氧化物的相对分子质量为N,则R的化合价是多少?
【答案】
金属R只有一种化合价,相对原子质量为70,其硫酸盐相对分子质量为428,则R的磷酸盐的相对分子质量为(提示:磷酸根离子PO43-)( A )
A.165 B.231 C.336 D.无法计算
某元素氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子量为b,则此元素的化合价为 。
【答案】 (b-a)/40、(b-a)/80
三、巩固提升
相对原子质量是(?C )
A.一个原子的质量
B.碳-12原子的质量的1/12和某原子质量相比较所得的数值
C.某原子的质量跟碳12原子质量的1/12相比较所得的数值
D.某原子的质量跟碳12原子的质量相比较所得的数值
认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( B )
A.?12 B.?16 C.?5 D.?10
在石油产品中有一种碳和氢组成的化合物A,碳和氢的原子个数比为1:2,相对分子质量为28,则A的化学式为( B )
A.CH2 B.C2H4 C.C3H6 D.C4H8
某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( A )
A.2N?M55 B.2M?N55 C.N?M27.5 D.M?N27.5
某物质由碳、氢、氧三种元素组成,图甲是该物质的元素质量分数圆饼图,图乙为该物质的分子结构模型图。据图分析,下列关于该物质的说法正确的是( D )
A.元素A. B.?C分别表示碳、氢、氧
B.该物质化学式可表示为CH6O2
C.该物质相对分子质量为105
D.分子中碳、氢、氧三种原子个数比为2:6:1
一个12C原子的质量为1.993×10?26kg,一个氧原子的质量为2.657×10?26kg,则氧原子的相对原子质量是( A )
A.12×2.657×10?26/1.993×10?26 B.12×1.993×10?26/2.657×10?26
C.2.657×10?26/1.993×10?26 D.2.657×10?26/12×1.993×10?26
3.2g化合物R在足量的氧气中燃烧,只生成4.4g二氧化碳和3.6g水,则化合物R中含有的元素肯定有( C )
A.C B. C、H ?C.C、H、O D. H、O?
列关于质量相同的CO和CO2的叙述正确的是( D )
A. 氧元素的质量比为11:4
B. 氧原子的个数比为1:2
C. 碳元素的质量比为1:1
D. 分子个数比是11:7
只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g。已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( B )
A.样品一定是CuO
B.样品可能是Cu、CuO和Cu2O的混合物
C.样品不可能含有Cu2O
D.样品一定是CuO和Cu2O的混合物
模型可以反映客观现象,简单明了地表示事物。
(1)某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是_____________;
(2)图乙是某同学模仿甲图构建的尿素[CO(NH2)2]各元素质量分数的模型,则图中的D表示的是_________元素。
答案:(1)碳酸钙;(2)氧。
1989年世界卫生组织把铝列为食品污染源之一,每人每日的摄入量控制在0.004g以下。若在1Kg米面食品中加入明矾2g(明矾的化学式为K:Al:S:O:H,相对分子质量为474),请回答下列问题:(1)人从食物中摄入的铝指的是______(填字母)。
A.铝元素 B.铝单质
C.铝合金 D.只有明矾
(2)明矾中各元素的质量比K:Al:S:O:H=______;铝元素的质量分数为______(计算结果精确到0.1%)。
(3)如果某人一天吃了100g上述面食品,通过计算说明其摄入的铝的量是否超过安全摄入量?______。
答案:(1)A;(2)39:27:64:320:24;5.7%;(3)超过。
钠摄入过量或钾摄入不足都是导致高血压的风险因素。日常生活中选择食用低钠盐能实现减钠补钾。下图为某品牌低钠盐的标签,请你根据标签回答以下问题:
XX品牌? 低钠盐 产品标准号********
配料及含量:氯化钠70%?
氯化钾30%
生产日期********?
保质期*******
(1)氯化钾的相对分子质量为????。
(2)人体每天摄入钠元素的质量不宜超过2.3g。如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过多少克?(结果保留一位小数)
答:(1)74.5;(2)一个人每天摄入该品牌低钠盐的质量不宜超过8.4克。
下图是一瓶医用注射盐水标签的部分内容。请完成下列问题。
主要成分:NaCl、H2O 体积:500mL
密度:1g/cm3
NaCl的含量(质量分数):0.9%
(1)在氯化钠中,钠、氯元素的质量比是?? ??。
(2)在氯化钠中,钠元素的质量分数是 ??。(结果精确到0.1%)
(3)该瓶盐水能给病人提供氯化钠的质量是 ??g。
(4)该瓶盐水能给病人提供钠元素的质量是 ??g。(结果精确到0.1g)
答案:(1)46:71;(2)39.3%;(3)4.5;(4)1.8。
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
XXX牌补锌口服液 主要成分:葡萄糖酸锌
化学式:C12H22O14Zn
含锌:5.0mg/支
质量:10.0g/支
(1)葡萄糖酸锌由?? ??种元素组成。
(2)葡萄糖酸锌中碳、氢元素的质量比为?? ??。
(3)要满足儿童身体正常发育的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
答案:(1)四;(2)72:11;(3)1支。
2015年10月,中国女药学家屠呦呦因创新型抗疟药——青蒿素和双氢青蒿素的贡献,与另外两位科学家共获2015年度诺贝尔生理学或医学家,请回答下列问题。如图是青蒿素(化学式C15H22O5)和双氢青蒿素(化学式C25H24O5)中各元素质量分数的模型,则表示青蒿素中各元素质量分数的模型是 。
答案:甲
我国科学家屠呦呦因为“发现青蒿素(化学式为C15H22O5)——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命”而获得2015年诺贝尔生理学或医学奖。磺胺(化学式为C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。回答下列问题。
(1)一个青蒿素分子中含有????个原子。
(2)青蒿素中氢元素与氧元素的质量比是????。
(3)14.1g青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
答案:(1)42;(2)11:40;(3)21.5g。
帕拉米韦氯化钠注射液是治疗H7N9亚型流感的有效药物之一,帕拉米韦化学方程式为C15H28NxO4。试计算:
(1)帕拉米韦中氢元素与氧元素的质量比为______;
(2)帕拉米韦的相对分子量为328,则x的数值为______;
(3)32.8g的帕拉米韦中氧元素的质量为______g(写出计算过程,结果精确到0.1g)。
答案:(1)7:16;(2)4;(3)6.4.
某地1000Kg化肥的市场价格如下:CO(NH2)2?1080元,NH4NO3?810元,NH4HCO3?330元,试计算:
(1)CO(NH2)2的相对分子质量。
(2)NH4NO3中氮元素的含量。
(3)现用10000元采购上述化肥中的一种,要想购得化肥中氮元素的质量最多,你应该购买哪一种?
(1)CO(NH2)2的相对分子质量=12+16+(14+1×2)×2=60;
(2)NH4NO3中氮元素的含量为:14×214+1×4+14+16×3×100%=35%;
(3)10000元购买的尿素中氮元素的质量为:10000元÷1080元1000kg×14×260=4320Kg;
10000元购买的硝酸铵中氮元素的质量为:10000元÷810元1000kg×35%=4320Kg;
10000元购买的碳酸氢铵中氮元素的质量为:10000元÷330元1000kg×1479=5370Kg;
故应该购买的是碳酸氢铵。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合所学知识,回答下列问题。
配料表 精制海盐,碘酸钾
含碘量/kg 20g?40g
包装日期 见封底
储存方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘酸钾的化学式为KIO3,则碘酸钾的相对分子质量为______,其中碘元素的质量分数为______,碘元素的化合价为______价。
(2)根据加碘食盐的储藏方法和食用方法可推测:碘酸钾的化学性质______(填“稳定”或“不稳定”).
(3)从2000年10月1日起。我国食盐中加碘含量将调整为每千克食盐中含碘约为0.035g,相当于每千克食盐中含碘酸钾______g.
答案为:214;59.3%;+5;
(2)由食用方法说明可知,碘酸钾在受热时易分解,热稳定性差,故答案为:不稳定;
(3)每千克食盐含碘0.035克,相当于每千克食盐含碘酸钾的质量=0.035g÷59.3%=0.059g,故答案为:0.059。
我国从1994年开始强制实行食盐加碘,即在食盐中加入碘酸钾(KIO3),以防制碘缺乏病的发生,2010年开始下调食盐加碘量,由原来每千克食盐加碘40mg下调至25mg.试计算:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比为 ;
(2)碘酸钾中碘元素的质量分数为 (计算结果精确到0.1%)
(3)现售加碘食盐每袋(500g)应比调整前减少了 mg碘,即少加碘酸钾___mg(计算结果精确至0.1mg)
(1)39:127:48;(2)59.3%;(3)7.5;12.6。
维持人类·生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水。α?丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“?”表示原子之间的相互连接)。
从物质分类看,蛋白质、糖类、维生素和α?丙氨酸均属于有机物;在α?丙氨酸中各元素的原子个数比为C:H:O:N= ,其中氮元素的百分含量为 (保留一位小数)。
答案为:3:7:2:1;15.7%.
_21?????????è?????(www.21cnjy.com)_
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
